Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Untitled
Cargado por
Luis CabreraDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Untitled
Cargado por
Luis CabreraCopyright:
Formatos disponibles
UNIDAD 4 ESTEQUIOMETRIA Estequiometria se deriva del griego Stoicheion que significa elemento y Metrn que si gnifica medir, estudia
las relaciones cuantitativas entre elementos y compuesto s en las reacciones qumicas. Una reaccin qumica es todo proceso qumico en el cual dos o ms sustancias (llamadas reactantes) por efecto de un factor energtico, se transforma en otras sustancias llamadas productos. o LEYES QUMICAS La leyes qumicas son un conjunto de leyes que se descubrieron por va experimental y que hacen referencia a las relaciones que en una reaccin qumica cumple los pesos de las sustancias reaccionantes y los productos de la reaccin. o Ley de la Conservacin de la Materia y Energa Esta ley nos dice que en una reaccin qumica, la suma de las masas de las sustancia s reaccionantes es igual a la suma de las masas de los productos de la reaccin. E sto quiere decir que la materia ni se crea ni se destruye, slo se puede transform ar al igual que la energa. La materia y la energa trabajan juntas ya que la materia al ser supuestamente des truda se transforma en energa y por eso se dice que la materia no se destruye sino que se convierte en energa. Este resultado se debe al qumico francs A.L. Lavoisier , quien lo formulo en 1774. o Ley de las proporciones definidas o de las proporciones constantes. En 1808, tras ocho aos de las investigaciones, j.l. Proust llego a la conclusin de que para formar un determinado compuesto, dos o ms elementos qumicos se unen sie mpre en la misma proporcin ponderal, esto quiere decir que en cualquier muestra de un compuesto, sin importar el tamao, los elementos estn siempre presentes en la misma proporcin (relacin) de masa. o Ley de Proporciones Mltiples La teora atmica de Dlton nos lleva a que los tomos se combinan para formar compuesto s. Considerando que un tomo de A se combina con un tomo de B para formar el compue sto AB y que un tomo de A se combina con 2 tomos de B, para formar el compuesto AB 2, Dlton propuso la ley de las proporciones mltiples que puede enunciarse as: Cuando dos elementos se combinan para formar ms de un compuesto, los pesos diferentes d e uno de ellos, que se combinan con un peso fijo del otro, guardan una relacin se ncilla de nmeros enteros pequeos. Esto quiere decir que si se mantiene fija la cantidad de uno y se determinan las cantidades del otro se tienen nmeros que guarden entre s relaciones expresables m ediante nmeros enteros. Tenemos por ejemplo el Carbono de Hidrgeno que forma Hidro carburos en los cuales intervienen relaciones que an siendo de nmeros enteros, est os son a veces muy grandes. 4.1 Concepto de peso atmico, peso molecular, composicin porcentual de una mo lcula, mol y nmero de Avogadr. Peso atmico: Tambin masa atmica es la masa de los protones y neutrones del p romedio de los isotopos del tomo del carbono. La masa atmica promedio de cada elemento se le conoce como peso atmico. Estos son los valores que se dan en las tablas peridicas. Peso molecular o peso formula: Es la suma de los pesos atmicos de los tomos que constituyen una molcula o conocida como formula molecular. Por ejemplo, el carbono, el hidrgeno y el oxgeno pueden unirse para formar la molcu la del azcar glucosa que tiene la frmula qumica C6H12O6. Por lo tanto el peso molecular de la glucosa ser: [6 x (12 uma)] + [12 x (1,00794 uma)] + [6 x (15,9994 uma)] = 180,0 uma Composicin porcentual de compuesto. La frmula de un compuesto indica el nmero de tomos de cada elemento presente en una unidad del compuesto. A partir de la frmula del compuesto es posible calcular el porcentaje que cada elemento proporciona a la masa total del compuesto, as poder determinar la pureza del mismo. La composicin porcentual en masa es el porcentaje en masa de cada elemento en un
compuesto. La composicin porcentual se obtiene al dividir la masa de cada uno de los elementos en 1 mol del compuesto entre la masa molar del compuesto y multipl icndolo por 100%.
También podría gustarte
- Que Es La CalidadDocumento5 páginasQue Es La CalidadLuis CabreraAún no hay calificaciones
- Ejemplo Ingenieria EconómicaDocumento2 páginasEjemplo Ingenieria EconómicaLuis CabreraAún no hay calificaciones
- Conducta FamiliarDocumento2 páginasConducta FamiliarLuis Cabrera100% (1)
- Enlaces QuímicosDocumento18 páginasEnlaces QuímicosLuis CabreraAún no hay calificaciones
- Familia DisfuncionalDocumento3 páginasFamilia DisfuncionalLuis CabreraAún no hay calificaciones
- Lider PracticoDocumento27 páginasLider PracticoLuis CabreraAún no hay calificaciones
- Italiano para Españoles PDFDocumento39 páginasItaliano para Españoles PDFEmmanuel TartagalAún no hay calificaciones
- 1curso PDFDocumento57 páginas1curso PDFBrandonSneyderRodríguezAún no hay calificaciones
- Distribucion de PlantaDocumento18 páginasDistribucion de Plantafredd_milesAún no hay calificaciones
- Microsoft Excel Aplicado Contabilidad PDFDocumento40 páginasMicrosoft Excel Aplicado Contabilidad PDFLuis CabreraAún no hay calificaciones
- Intro.... Oracle PDFDocumento60 páginasIntro.... Oracle PDFLuis CabreraAún no hay calificaciones
- Mysql Basico 1 PDFDocumento24 páginasMysql Basico 1 PDFLuis CabreraAún no hay calificaciones
- La CorrupcionDocumento27 páginasLa CorrupcionLuis CabreraAún no hay calificaciones
- Costos de Materiales PDFDocumento14 páginasCostos de Materiales PDFLuis CabreraAún no hay calificaciones
- Ergonomia - TablerosDocumento27 páginasErgonomia - TablerosAlberto Carranza0% (1)
- Probabilidad e Inferencia Estadistica, Luis Santaló PDFDocumento140 páginasProbabilidad e Inferencia Estadistica, Luis Santaló PDFLuis CabreraAún no hay calificaciones
- Libro de Ergonomia 1 ParteDocumento15 páginasLibro de Ergonomia 1 ParteIvan FloresAún no hay calificaciones
- Principios de La Tecnologia de Fundicion PDFDocumento130 páginasPrincipios de La Tecnologia de Fundicion PDFLuis CabreraAún no hay calificaciones
- Liderazgo Muy Bueno PDFDocumento54 páginasLiderazgo Muy Bueno PDFLuis CabreraAún no hay calificaciones
- SPSS-resumen PracticoDocumento54 páginasSPSS-resumen PracticoNestor Santana ElguetaAún no hay calificaciones
- Trabajo Equipo PDFDocumento46 páginasTrabajo Equipo PDFLuis CabreraAún no hay calificaciones
- Apunte - Modelos de TransporteDocumento5 páginasApunte - Modelos de TransporteKarla HuertaAún no hay calificaciones
- Psicologia Industrial PDFDocumento13 páginasPsicologia Industrial PDFLuis CabreraAún no hay calificaciones
- UntitledDocumento2 páginasUntitledLuis CabreraAún no hay calificaciones
- Historia Del Método CientíficoDocumento5 páginasHistoria Del Método CientíficoLuis CabreraAún no hay calificaciones
- Administracion de Empresas PDFDocumento0 páginasAdministracion de Empresas PDFLuis CabreraAún no hay calificaciones
- UntitledDocumento2 páginasUntitledLuis CabreraAún no hay calificaciones
- Intro Adminostración OperacionesDocumento40 páginasIntro Adminostración OperacionesivncastilloAún no hay calificaciones
- 3 Método SimplexDocumento20 páginas3 Método Simplexapi-373675995% (20)
- UntitledDocumento2 páginasUntitledLuis CabreraAún no hay calificaciones
- AGUA DE USO FARMACÉUTICO Grupo 1.....Documento13 páginasAGUA DE USO FARMACÉUTICO Grupo 1.....Xavelys De LeonAún no hay calificaciones
- Química II: Conservación de la masaDocumento26 páginasQuímica II: Conservación de la masaPaul Emmanuel Mora EscuderoAún no hay calificaciones
- Membrana Celular y Fisiologia de La Membrana CelularDocumento7 páginasMembrana Celular y Fisiologia de La Membrana CelularIsabel Torrez100% (2)
- Intoxicacion Carbamatos FinalDocumento15 páginasIntoxicacion Carbamatos FinalGonzalo Vallejos OroscoAún no hay calificaciones
- Desarrollo Taller 4Documento5 páginasDesarrollo Taller 4Carolina ZuluagaAún no hay calificaciones
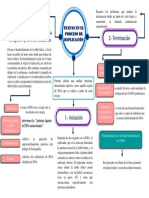
- Proceso de ReplicaciónDocumento1 páginaProceso de ReplicaciónGabriela SalinasAún no hay calificaciones
- NTP 334.131Documento136 páginasNTP 334.131CY Evelyn100% (1)
- Tierras Raras Neptunio Samario y TorioDocumento14 páginasTierras Raras Neptunio Samario y TorioLuis JerezAún no hay calificaciones
- Mapeo 29 PDFDocumento36 páginasMapeo 29 PDFregolita013Aún no hay calificaciones
- Determinacion de Acido Acetilsalicilico PDFDocumento9 páginasDeterminacion de Acido Acetilsalicilico PDFstone kaizerAún no hay calificaciones
- Fauna MarinaDocumento16 páginasFauna MarinaJeiner GarateAún no hay calificaciones
- Manual Qai 1Documento87 páginasManual Qai 1ENRIQUE CORTES VALLEAún no hay calificaciones
- El Aparato UrinarioDocumento17 páginasEl Aparato UrinarioANA JULIA SANTOS AZAMARAún no hay calificaciones
- Bases Moleculares de La Psicofarmacologia - Daniela FerrerDocumento27 páginasBases Moleculares de La Psicofarmacologia - Daniela Ferrerbely labarca perezAún no hay calificaciones
- Ejercicios Resueltos Leyes PonderalesDocumento9 páginasEjercicios Resueltos Leyes PonderalesPablo Mery67% (43)
- GLIFOSOLDocumento4 páginasGLIFOSOLDaniela Zamudio CortesAún no hay calificaciones
- Riesgos QuimicoDocumento13 páginasRiesgos QuimicoFelipe ZipaAún no hay calificaciones
- Ficha Del AmoniacoDocumento4 páginasFicha Del Amoniacostefany trujilloAún no hay calificaciones
- Evidencia Nuevo ProductoDocumento5 páginasEvidencia Nuevo ProductoNikolas TrujilloAún no hay calificaciones
- u1QUIMICA 2Documento47 páginasu1QUIMICA 2Rocio Yactayo ReyesAún no hay calificaciones
- B66 Multi Surface Acrylic Gloss 2019Documento3 páginasB66 Multi Surface Acrylic Gloss 2019Sherwin Williams BolivarAún no hay calificaciones
- Compuestos Aromaticos - PDF' PDFDocumento20 páginasCompuestos Aromaticos - PDF' PDFKevin JaldinAún no hay calificaciones
- Guía Técnicas II de 2018 - (Actualizada) PDFDocumento112 páginasGuía Técnicas II de 2018 - (Actualizada) PDFManuel RosasAún no hay calificaciones
- DROGAS RECREATIVAS: EFECTOS, TIPOS Y POLÍTICAS ANTIDROGASDocumento1 páginaDROGAS RECREATIVAS: EFECTOS, TIPOS Y POLÍTICAS ANTIDROGASLilianaAún no hay calificaciones
- Reporte Laboratorio Virtual #5 - Reconocimiento y Propiedades de La Tabla PeriódicaDocumento5 páginasReporte Laboratorio Virtual #5 - Reconocimiento y Propiedades de La Tabla PeriódicaEdison Orcon AcuñaAún no hay calificaciones
- Cinética QuímicaDocumento35 páginasCinética QuímicaAlejandro QuilcaAún no hay calificaciones
- Química Orgánica - Sem-02 - Sesión-04 - 2022-2Documento32 páginasQuímica Orgánica - Sem-02 - Sesión-04 - 2022-2keysi aparcoAún no hay calificaciones
- Resumen Santoyo VargasDocumento3 páginasResumen Santoyo VargasKarla SantoyoAún no hay calificaciones
- Problemario No 2 PDFDocumento2 páginasProblemario No 2 PDFJosé Fernando Hernández RodríguezAún no hay calificaciones
- CuestionarioDocumento3 páginasCuestionarioGiancarlo MendizabalAún no hay calificaciones