Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Trifoliar
Cargado por
Tzunún Xiquin Juana Cecilia0 calificaciones0% encontró este documento útil (0 votos)
0 vistas2 páginasTrifoliar.
Título original
trifoliar
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoTrifoliar.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
0 vistas2 páginasTrifoliar
Cargado por
Tzunún Xiquin Juana CeciliaTrifoliar.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
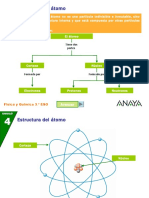
IDENTIFICACIÓN
DE ATOMOS Los átomos son los constituyentes
fundamentales de la materia. Cada átomo
POR SU NUMERO está compuesto por un núcleo central que
contiene protones y neutrones, rodeado
ATOMICO DE
por electrones que orbitan alrededor del
núcleo. Para identificar un átomo
específico, es crucial comprender su
MASA E número atómico, masa e isotopía.
ISOTOPOS. La identificación de átomos por su número atómico,
masa e isótopos es esencial en numerosos campos,
incluyendo la química, la física nuclear, la medicina y
la geología.
Número Atómico (Z) Masa Atómica (A) Isótopos
El número atómico de un átomo es la La masa atómica de un átomo es la suma Los isótopos son átomos del mismo
cantidad de protones que posee en su del número de protones y neutrones en elemento que tienen el mismo número de
núcleo. Es una propiedad única para su núcleo. Aunque los electrones protones, pero difieren en el número de
cada elemento químico y determina su también tienen masa, su contribución es neutrones en su núcleo. Esto conduce a
posición en la tabla periódica. Por mínima en comparación con la de los diferencias en la masa atómica entre los
ejemplo, el carbono tiene seis números protones y neutrones. isótopos de un mismo elemento. Por
atómicos de 6, lo que significa que tiene ejemplo, el hidrógeno tiene tres isótopos
seis protones en su núcleo. principales: el protio (¹H) con un protón
y ningún neutrón, el deuterio (²H) con un
protón y un neutrón, y el tritio (³H) con
un protón y dos neutrones.
También podría gustarte
- à - Tomo 2Documento6 páginasà - Tomo 2Camilo Andres Paternina BedoyaAún no hay calificaciones
- Física 2BA. Unidad 4. La Física NuclearDocumento24 páginasFísica 2BA. Unidad 4. La Física NuclearMelissaMaraviAlvarado100% (1)
- Sesion 1 Estructura Atomica PDFDocumento35 páginasSesion 1 Estructura Atomica PDFfernandoAún no hay calificaciones
- Clase 1 QuimicaDocumento14 páginasClase 1 QuimicaEugenioAún no hay calificaciones
- 03 Ep 5 P Estructura AtomoDocumento5 páginas03 Ep 5 P Estructura AtomoAnonymous 6uTnzywkAún no hay calificaciones
- Teoría Actual Del ÁtomoDocumento4 páginasTeoría Actual Del ÁtomoReynaldo HerreraAún no hay calificaciones
- 03 Ep 5 P Estructura AtomoDocumento5 páginas03 Ep 5 P Estructura AtomoPeter Aguirre KlugeAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa ConceptualValentina QuiñónezAún no hay calificaciones
- Los Atomos y Su EstructuraDocumento2 páginasLos Atomos y Su EstructuraVictor BarrónAún no hay calificaciones
- Estructura AtomicaDocumento13 páginasEstructura AtomicaHologranmaAún no hay calificaciones
- P1 - Introduccion AtomoDocumento7 páginasP1 - Introduccion Atomojonas jimenezAún no hay calificaciones
- Estructura Del ÁtomoDocumento1 páginaEstructura Del ÁtomomariapiamosqueraAún no hay calificaciones
- Isotopos PDFDocumento17 páginasIsotopos PDFRoberto MartinezAún no hay calificaciones
- Número AtómicoDocumento4 páginasNúmero AtómicoHugo PootAún no hay calificaciones
- En El Átomo Distinguimos Dos PartesDocumento1 páginaEn El Átomo Distinguimos Dos PartesMiguel LoyoAún no hay calificaciones
- Triptico - ATOMODocumento3 páginasTriptico - ATOMOJanet Laura TecciAún no hay calificaciones
- Modulo 2do Cuatrimestre (2do Año) FYQ 2024Documento32 páginasModulo 2do Cuatrimestre (2do Año) FYQ 2024solsi7518Aún no hay calificaciones
- Clase1e3m 2019Documento46 páginasClase1e3m 2019ninnette valenzuelaAún no hay calificaciones
- Guia 8vo Cs N°3Documento8 páginasGuia 8vo Cs N°3Jaime KeatingAún no hay calificaciones
- Átomos y Sus Principales CaracterísticasDocumento4 páginasÁtomos y Sus Principales Característicasharryarcila85% (13)
- Actividad #2Documento3 páginasActividad #2eduar nicolas cabiativa hernadezAún no hay calificaciones
- Partículas Elementales.Documento8 páginasPartículas Elementales.mariaAún no hay calificaciones
- ÁTOMODocumento2 páginasÁTOMOLuis SifuentesAún no hay calificaciones
- Trabajo Original IsotoposDocumento22 páginasTrabajo Original IsotoposjeanpoolAún no hay calificaciones
- Unidad #1 Atomo Moleculas IonesDocumento32 páginasUnidad #1 Atomo Moleculas IonesPedro BarreraAún no hay calificaciones
- ÁtomoDocumento7 páginasÁtomoIdd YedAún no hay calificaciones
- Guia 4 Biologia 8Documento2 páginasGuia 4 Biologia 8elerrosse93Aún no hay calificaciones
- Estructura Nuclear Del ÁtomoDocumento21 páginasEstructura Nuclear Del ÁtomoCarlos Dario Santander GarceteAún no hay calificaciones
- A3 QuimicadocxDocumento4 páginasA3 QuimicadocxMajoAún no hay calificaciones
- Tipos de Atomos 01Documento12 páginasTipos de Atomos 01Valentina TobarAún no hay calificaciones
- ATOMODocumento8 páginasATOMOjemaAún no hay calificaciones
- 2-Apunte Estructura Atómica (C - Videos)Documento21 páginas2-Apunte Estructura Atómica (C - Videos)Mar MoralesAún no hay calificaciones
- Teoria Átomica Exponer 1Documento16 páginasTeoria Átomica Exponer 1brayanzapanaroqueAún no hay calificaciones
- Tarea 10 Teoria AtomicaDocumento2 páginasTarea 10 Teoria AtomicaJuanCarlosOrozcoCaicedoAún no hay calificaciones
- Átomo: DefiniciónDocumento2 páginasÁtomo: DefiniciónelmerbootsAún no hay calificaciones
- ÁtomoDocumento3 páginasÁtomoLuis CórdobaAún no hay calificaciones
- Ficha Estudiante-Quimica-Sem16Documento5 páginasFicha Estudiante-Quimica-Sem16jostin berronesAún no hay calificaciones
- EXPOSICIONDocumento28 páginasEXPOSICIONGIHAN CARLOS ALVA REYESAún no hay calificaciones
- Teoria Estructura Del ÁtomoDocumento16 páginasTeoria Estructura Del ÁtomoJaquelina MamaníAún no hay calificaciones
- Estructura Del Átomo - Docx ISABELLADocumento206 páginasEstructura Del Átomo - Docx ISABELLAGregory OrdazAún no hay calificaciones
- Átomo y Partículas SubatómicasDocumento18 páginasÁtomo y Partículas SubatómicasAlejandra Huerta100% (1)
- Sin Título 2Documento1 páginaSin Título 2Valentina FernandezAún no hay calificaciones
- Repasoteorico EstructuradelamateriaDocumento4 páginasRepasoteorico EstructuradelamateriaRoxana MocciaAún no hay calificaciones
- Examen FinalDocumento5 páginasExamen FinalManuel Jose Sandoval UrízarAún no hay calificaciones
- UNIDAD #2 ATOMO MOLECULAS IONES Final EstudiantesDocumento38 páginasUNIDAD #2 ATOMO MOLECULAS IONES Final EstudiantesJonxthxnAghxsakxbasAún no hay calificaciones
- Apuntes 2 Estructura AtomicaDocumento6 páginasApuntes 2 Estructura Atomicaaestay100% (7)
- Como Es Un AtomoDocumento5 páginasComo Es Un AtomoAnita AceboAún no hay calificaciones
- 2MT NúcleDocumento1 página2MT NúcleLili Zapana VelásquezAún no hay calificaciones
- BII-Sesión de Aprendizaje 02Documento10 páginasBII-Sesión de Aprendizaje 02Adiel Sebastian Panduro EspinozaAún no hay calificaciones
- La Estructura AtómicaDocumento10 páginasLa Estructura AtómicaAbraham GuzmánAún no hay calificaciones
- Apuntes Estructura Atã MicaDocumento3 páginasApuntes Estructura Atã MicaValeria Boo RodriguesAún no hay calificaciones
- Sesión 2 Estructura AtómicaDocumento76 páginasSesión 2 Estructura AtómicaYang Mi YoonAún no hay calificaciones
- Estructura Atómica 2022 1 ADocumento21 páginasEstructura Atómica 2022 1 AGINPERUAún no hay calificaciones
- Teoria Atomica IDocumento16 páginasTeoria Atomica IRichard ParkerAún no hay calificaciones
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- La tabla periódica de los elementos químicosDe EverandLa tabla periódica de los elementos químicosCalificación: 1 de 5 estrellas1/5 (1)
- From One To Zero A Universal History Of-250-541Documento292 páginasFrom One To Zero A Universal History Of-250-541jorgeAún no hay calificaciones
- Informe - 2 BGU - Física - Quimestral-IDocumento1 páginaInforme - 2 BGU - Física - Quimestral-Ipaty pinan jotaAún no hay calificaciones
- Tampografía y HuecografíaDocumento17 páginasTampografía y HuecografíasabrinaAún no hay calificaciones
- Actividad 3 - Negociación EmpresarialDocumento11 páginasActividad 3 - Negociación EmpresarialVictor Ramírez CaballeroAún no hay calificaciones
- Memorando de Llamada de Atención Abandono de TrabajoDocumento1 páginaMemorando de Llamada de Atención Abandono de TrabajoRőnald Villavicencio Rojas100% (8)
- Tema 7 - Secundaria - Organología, Clasificación de Instrumentos - PDF Versión 1Documento18 páginasTema 7 - Secundaria - Organología, Clasificación de Instrumentos - PDF Versión 1Franco VargasAún no hay calificaciones
- Cobranza Abusiva AlejoDocumento6 páginasCobranza Abusiva AlejoCarrascal Negrete MarceloAún no hay calificaciones
- Ficha Técnica Megaroot.Documento2 páginasFicha Técnica Megaroot.brayanAún no hay calificaciones
- Cap - II.Fundamentación Teórica - Gestión Por Procesos.Documento4 páginasCap - II.Fundamentación Teórica - Gestión Por Procesos.lesterAún no hay calificaciones
- Syllabus ExcelDocumento8 páginasSyllabus ExcelOctavio BastidasAún no hay calificaciones
- Temario de Gestión Por ProcesosDocumento4 páginasTemario de Gestión Por ProcesosarcesciochiclayoAún no hay calificaciones
- Caracterización de Dos Variables Cualitativas-Sandoval LopezDocumento1 páginaCaracterización de Dos Variables Cualitativas-Sandoval Lopez32 Maria Paula Sandoval LopezAún no hay calificaciones
- ForoDocumento5 páginasForoMireya Katherinne Urrego UrregoAún no hay calificaciones
- La Selva Baja Es La Ecorregión Más Grande y Rica Del PerúDocumento5 páginasLa Selva Baja Es La Ecorregión Más Grande y Rica Del PerúKasumy Gaspar AlvarezAún no hay calificaciones
- Tupa - Direpro Ancash - AprobadoDocumento21 páginasTupa - Direpro Ancash - AprobadoromykleintAún no hay calificaciones
- Justificacion de Un Proyecto de InvestigaciónDocumento1 páginaJustificacion de Un Proyecto de InvestigaciónJesús Alfredo Estela MarticorenaAún no hay calificaciones
- Modelo Proyecto Distribucion UtilidadesDocumento4 páginasModelo Proyecto Distribucion UtilidadesSilvia María González Robles100% (1)
- Primer Informe de Lectura - Debray - Emmanuel Orozco GuerreroDocumento3 páginasPrimer Informe de Lectura - Debray - Emmanuel Orozco GuerreroEmmanuel Orozco GuerreroAún no hay calificaciones
- Actividad Empresarial 2da ParteDocumento4 páginasActividad Empresarial 2da ParteAngineth MoralesAún no hay calificaciones
- Bases Historico Epistemologicas de La Psicologia Cognitiva-with-cover-page-V2Documento11 páginasBases Historico Epistemologicas de La Psicologia Cognitiva-with-cover-page-V2Lucero AzabacheAún no hay calificaciones
- La Comunicacion de La Malas Noticias en CP 2013Documento4 páginasLa Comunicacion de La Malas Noticias en CP 2013Susy RamirezAún no hay calificaciones
- Semana 6Documento35 páginasSemana 6Roy CayoAún no hay calificaciones
- Roger Von Gunten - Los Instantes de La MemoriaDocumento4 páginasRoger Von Gunten - Los Instantes de La MemoriaEmmanuel Albarrán RuedaAún no hay calificaciones
- Ecuaciones NRTLDocumento24 páginasEcuaciones NRTLAndres PeñaAún no hay calificaciones
- Caracterización Del ContextoDocumento2 páginasCaracterización Del ContextoOmar Saúl Antesano ChávezAún no hay calificaciones
- 3° Grado - PPT - Dia 24 de OctubreDocumento7 páginas3° Grado - PPT - Dia 24 de OctubreLiliana MamaniAún no hay calificaciones
- Juan Jose Riveros RepizoDocumento2 páginasJuan Jose Riveros RepizocatedrasalternasAún no hay calificaciones
- Proyecto Burj Al ArabDocumento16 páginasProyecto Burj Al ArabOscar LeonAún no hay calificaciones
- PROC-T-003 Procedimiento para Asegurar La Integridad de Los Ítems Bajo ServicioDocumento6 páginasPROC-T-003 Procedimiento para Asegurar La Integridad de Los Ítems Bajo ServicioEmily Brock100% (1)
- Practica No.1 C0ntab, II Ene Abr 2021Documento2 páginasPractica No.1 C0ntab, II Ene Abr 2021Yuceilan Vidal TurbiAún no hay calificaciones