Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Mapa Mental Fuerzas Intermoleculares
Cargado por
rorro.ariascarreraDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Mapa Mental Fuerzas Intermoleculares
Cargado por
rorro.ariascarreraCopyright:
Formatos disponibles
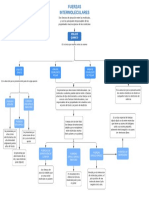
Fuerzas de atracción entre moléculas polares.
Fuerzas dipolo-dipolo
Fuerzas ion-dipolo Atraen entre sí a un ion y una molécula polar.
Tipos de Fuerzas Intermoleculares
Fuerzas de atracción que se generan a
partir de dipolos temporales inducidos en
Las fuerzas dipolo-dipolo son de origen electrostático, por Fuerzas de Dispersión
átomos o moléculas.
lo que a mayor momento dipolar, mayor será la fuerza. Están
solo en las moléculas covalentes polares. Son más intensas
que las fuerzas de dispersión.
La intensidad de las fuerzas ion-dipolo dependerán de la caga y el Tipo especial de interacción dipolo-dipolo entre el
El Enlace de Hidrógeno átomo de hidrógeno de un enlace polar (N-H; O-H; F-H)
tamaño del ion. El catión experimenta una interacción más fuerte con
y un átomo electronegativo de O, N o F.
los dipolos que un anión. Solamente está en moléculas iónicas. Es la
fuerza más intensa. Comparación de Intensidades en
Fuerzas Intermoleculares
Las fuerzas de dispersión aumentan con la masa molar porque las ¿Qué es?
moléculas con mayor masa molar, son las más débiles. Están en las
partículas covalentes y es la única en las moléculas covalentes no
polares. Fuerzas Intermoleculares
Fuerzas de atracción entre moléculas.
La fuerza de un enlace de hidrógeno se determina por la
interacción coulómbica entre el par libre de electrones del átomo
electronegativo y el núcleo del hidrógeno. Es la fuerza más
intensa de las moléculas covalentes y partículas neutras.
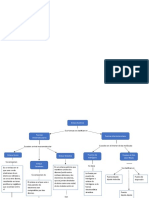
El Efecto de los Enlaces Químicos en las Fuerzas
Intermoleculares
Punto de Fusión Los enlaces no covalentes poseen fuerzas intermoleculares
El punto de fusión aumenta a medida que las fuerzas más débiles en comparación a los enlaces covalentes.
intermoleculares son más intensas.
Cohesión: Atracción intermolecular entre Tensión Superficial
moléculas semejantes (como el agua).
Adhesión: Atracción entre moléculas distintas
(como las de agua y el tubo de vidrio).
Propiedades Afectadas por Fuerzas
Intermoleculares
Mientras más fuerte sea la fuerza
intermolecular del líquido, más viscoso será.
Viscosidad
Entre mayores sean las fuerzas
intermoleculares, mayor será el punto de
ebullición. Punto de Ebullición
También podría gustarte
- Actividad Integradora 2Documento9 páginasActividad Integradora 2Efren Camacho Hernandez76% (25)
- Mapa Conceptual Fuerzas IntermolecularesDocumento1 páginaMapa Conceptual Fuerzas IntermolecularesAli Longoria.88% (8)
- Atmosfera Estándar-Altitud Presión y DensidadDocumento47 páginasAtmosfera Estándar-Altitud Presión y DensidadJose TejedaAún no hay calificaciones
- Mapa ConceptualDocumento4 páginasMapa ConceptualNinaElizabethVelozaAún no hay calificaciones
- 1.-¿Qué Son Las Fuerzas Intermoleculares?Documento4 páginas1.-¿Qué Son Las Fuerzas Intermoleculares?yami vieraAún no hay calificaciones
- Taller N°4 - Enlace Químico (1) ArregladoDocumento4 páginasTaller N°4 - Enlace Químico (1) ArregladoangelAún no hay calificaciones
- AC2-22 Cap11 Fuerzas Intermolec. en Liquidos - Hasta Cambios de Fases-2019Documento46 páginasAC2-22 Cap11 Fuerzas Intermolec. en Liquidos - Hasta Cambios de Fases-2019Marielys VasquezAún no hay calificaciones
- Fuerzas IntermolecularesDocumento13 páginasFuerzas IntermolecularesDavid Ignacio Gallardo DeloyaAún no hay calificaciones
- Tecnicas de ExtracciónDocumento100 páginasTecnicas de Extracciónnicolas briceño lopezAún no hay calificaciones
- Cuadro Comparativo de Las Fuerzas Intermoleculares e IntramolecularesDocumento1 páginaCuadro Comparativo de Las Fuerzas Intermoleculares e IntramolecularesjorgeAún no hay calificaciones
- Universidad Tecnológica de Tecámac. Grupo 1pim2 11 de Octubre 2022Documento16 páginasUniversidad Tecnológica de Tecámac. Grupo 1pim2 11 de Octubre 2022Diana Santillan DelgadoAún no hay calificaciones
- Fuerzas IntermolecularesDocumento7 páginasFuerzas IntermolecularesKYRA ON YTAún no hay calificaciones
- Fuerzas de Enlaces Intermoleculares para Tercer Grado de SecundariaDocumento8 páginasFuerzas de Enlaces Intermoleculares para Tercer Grado de SecundariaNENA TORRES BORGESAún no hay calificaciones
- Mapa Mental Fuerzas Intermoleculares Mapa 3 QuimicaDocumento2 páginasMapa Mental Fuerzas Intermoleculares Mapa 3 QuimicaMelanie Sch100% (1)
- Actividad 5 - Quimica - Cuadro ComparativoDocumento6 páginasActividad 5 - Quimica - Cuadro ComparativoArmando MorenoAún no hay calificaciones
- 4.4. Enlaces IntermolecularesDocumento15 páginas4.4. Enlaces Intermolecularesjavi jlmAún no hay calificaciones
- FUERZAS INTERMOLECULARES (Inforgrafía)Documento2 páginasFUERZAS INTERMOLECULARES (Inforgrafía)Jesús JiménezAún no hay calificaciones
- Wuolah Free TEMA 5Documento6 páginasWuolah Free TEMA 5AuroraAún no hay calificaciones
- Fuerzas Intermoleculares, Javier CorralesDocumento5 páginasFuerzas Intermoleculares, Javier Corralesjavier.corralesAún no hay calificaciones
- El Átomo Fuerzas Intramoleculares e Intermoleculares PDFDocumento1 páginaEl Átomo Fuerzas Intramoleculares e Intermoleculares PDFSharith GarzónAún no hay calificaciones
- 08 Fuerzas Intermoleculares PDFDocumento80 páginas08 Fuerzas Intermoleculares PDFmiloAún no hay calificaciones
- Introducción A Las Fuerzas IntermolecularesDocumento5 páginasIntroducción A Las Fuerzas IntermolecularesMágicos OchentasAún no hay calificaciones
- Fuerzas Intermoleculares - Lecturas.Documento8 páginasFuerzas Intermoleculares - Lecturas.Karol ErazoAún no hay calificaciones
- Clase 5Documento12 páginasClase 5PaulusAún no hay calificaciones
- Fuerzas IntermolecularesDocumento18 páginasFuerzas Intermolecularesel ruxorAún no hay calificaciones
- Cuestionario de 100 PreguntasDocumento10 páginasCuestionario de 100 PreguntasUlises OlveraAún no hay calificaciones
- Fuerzas IntermolecularesDocumento52 páginasFuerzas IntermolecularesDsam IIAún no hay calificaciones
- Fuerzas de Interaccion MolecularDocumento13 páginasFuerzas de Interaccion MolecularSara Angélica Pimentel BonillaAún no hay calificaciones
- MapaConceptual-Estructura MolecularDocumento2 páginasMapaConceptual-Estructura MolecularCarlos Andrés Lagos PinoAún no hay calificaciones
- Infografia Acerca de Las Fuerzas IntermolecularesDocumento1 páginaInfografia Acerca de Las Fuerzas IntermolecularesFrank SantiagoAún no hay calificaciones
- Quimica Organica Clase 4. Fuerzas Intermoleculares 2020Documento101 páginasQuimica Organica Clase 4. Fuerzas Intermoleculares 2020Felipe A. PérezAún no hay calificaciones
- Fuerzas IntermolecularesDocumento2 páginasFuerzas IntermolecularesDanna Ramírez100% (2)
- Fuerzas IntermolecularesDocumento2 páginasFuerzas IntermolecularesValentina100% (4)
- Fuerzas IntermolecularesDocumento4 páginasFuerzas IntermolecularesJuan Pedro Rivas TorresAún no hay calificaciones
- Fuerzas IntermolecularesDocumento12 páginasFuerzas IntermolecularesNatalia Lucia Escorcia FrancoAún no hay calificaciones
- Mapa QuímicaDocumento1 páginaMapa QuímicaJermay Bryan vincentAún no hay calificaciones
- Fuerzas Intermoleculares-1Documento23 páginasFuerzas Intermoleculares-1gaimeschilquebelenAún no hay calificaciones
- ACFrOgCOBnR Zzq9uXh0Zt0cA p3IzdIM5-ET2YWavS2konAVLUcjqgqYZdhUvM28BgVlVFlTf-7QmkK 3ejN2EP5M8zR 0Bg7KKMGBAM5By05NYFJQDB EVXrR8QADocumento23 páginasACFrOgCOBnR Zzq9uXh0Zt0cA p3IzdIM5-ET2YWavS2konAVLUcjqgqYZdhUvM28BgVlVFlTf-7QmkK 3ejN2EP5M8zR 0Bg7KKMGBAM5By05NYFJQDB EVXrR8QAJuli WidnikiewiczAún no hay calificaciones
- Actividad 1 Fuerzas IntermolecularesDocumento2 páginasActividad 1 Fuerzas IntermolecularesCristianAún no hay calificaciones
- Practica 2 - Fuerzas Intermoleculares y SolubilidadDocumento2 páginasPractica 2 - Fuerzas Intermoleculares y SolubilidadIsaac JuradoAún no hay calificaciones
- Fuerzas IntramolecularesDocumento1 páginaFuerzas IntramolecularesAnto RaspudichAún no hay calificaciones
- Análisis Cloruro de Sodio Un Compuesto Iónico Común e ImportanteDocumento3 páginasAnálisis Cloruro de Sodio Un Compuesto Iónico Común e ImportantelauraAún no hay calificaciones
- Fuerzas IMDocumento1 páginaFuerzas IMFer EsparzaAún no hay calificaciones
- Que Son Las Fuerzas IntermolecularesDocumento7 páginasQue Son Las Fuerzas Intermolecularesjosbelis santoyoAún no hay calificaciones
- Fuerzas IntermolecularesDocumento2 páginasFuerzas IntermolecularesMagaña Palacios Ivana MontserratAún no hay calificaciones
- Química TrípticoDocumento2 páginasQuímica TrípticoJennifer AriasAún no hay calificaciones
- Investigación Fuerzas de Van Der Waals - Delaney AcostaDocumento6 páginasInvestigación Fuerzas de Van Der Waals - Delaney AcostaRoxangel AdamesAún no hay calificaciones
- Archivo 20215818177Documento23 páginasArchivo 20215818177Erick RicardoAún no hay calificaciones
- Trabajo 3 Tecnologia de Los MaterialesDocumento5 páginasTrabajo 3 Tecnologia de Los MaterialesLeonardoAún no hay calificaciones
- Qué Son Las Fuerzas de Van Der WaalsDocumento6 páginasQué Son Las Fuerzas de Van Der Waalsloren del portilloAún no hay calificaciones
- Fuerzas de Enlaces Intermoleculares para Quinto Grado de SecundariaDocumento8 páginasFuerzas de Enlaces Intermoleculares para Quinto Grado de SecundariaPreparación Católica PucpAún no hay calificaciones
- Fuerzas Intermoleculares.Documento22 páginasFuerzas Intermoleculares.EfraínAún no hay calificaciones
- Expo Q1 AnnDocumento28 páginasExpo Q1 AnnPercy QuispeAún no hay calificaciones
- Tipo de Fuerzas MolecularesDocumento4 páginasTipo de Fuerzas MolecularesGuillermo FuentesAún no hay calificaciones
- Fuerza de Van Der WaalsDocumento10 páginasFuerza de Van Der WaalsJorgeAún no hay calificaciones
- Fuerzas Intermoleculares PDFDocumento31 páginasFuerzas Intermoleculares PDFDAR DUAAún no hay calificaciones
- Tema 8Documento2 páginasTema 8Sandra Sánchez GomezAún no hay calificaciones
- INTRODUCCIONDocumento9 páginasINTRODUCCIONDiego Hernandez CisnerosAún no hay calificaciones
- Fuerzas Intermoleculares, Hibridación de OrbitalesDocumento3 páginasFuerzas Intermoleculares, Hibridación de OrbitalesSharlyn DuarteAún no hay calificaciones
- Fuerzas InetrmolecularesDocumento21 páginasFuerzas InetrmolecularesMilagros PereyraAún no hay calificaciones
- Punto de RocioDocumento7 páginasPunto de RociodrespetoAún no hay calificaciones
- Apunte 09 - Sistemas de Calefacción Por Vapor de AguaDocumento12 páginasApunte 09 - Sistemas de Calefacción Por Vapor de AguaAraceli DelfinoAún no hay calificaciones
- ASTM D 86 07a TraducciónDocumento44 páginasASTM D 86 07a TraducciónRael CabreraAún no hay calificaciones
- Taller 8. 1 LeyDocumento4 páginasTaller 8. 1 LeyJEAN CAMILO PORRAS RICOAún no hay calificaciones
- Practica # 2 Componentes Basicos de Los Sistemas Neumaticos e HidraulicosDocumento2 páginasPractica # 2 Componentes Basicos de Los Sistemas Neumaticos e Hidraulicosadonis ordoñez100% (2)
- Materiales SemiconductoresDocumento11 páginasMateriales SemiconductoresArturo FloresAún no hay calificaciones
- Natalia Herrera - Ley de Gases - Taller - 11°BDocumento9 páginasNatalia Herrera - Ley de Gases - Taller - 11°BKeythelAún no hay calificaciones
- Contaminacionambiental Problemas ResueltosDocumento3 páginasContaminacionambiental Problemas ResueltosGrace CR100% (1)
- Cálculos para La Presión ManométricaDocumento12 páginasCálculos para La Presión ManométricaAntonioAún no hay calificaciones
- Infografía Inteligencia Artificial Moderno NegroDocumento2 páginasInfografía Inteligencia Artificial Moderno NegroSantiago Emilio SERQUEN CABREJOAún no hay calificaciones
- Precipitaciones Registradas Por DepartamentoDocumento7 páginasPrecipitaciones Registradas Por DepartamentoNataly MoyaAún no hay calificaciones
- Un Tubo Capilar de 2mm de Radio Interior Se Introduce Un LíquidoDocumento5 páginasUn Tubo Capilar de 2mm de Radio Interior Se Introduce Un Líquidojuan davidAún no hay calificaciones
- Practica N°2. DETERMINACIÓN DE LAS LEYES DE LOS GASES PDFDocumento22 páginasPractica N°2. DETERMINACIÓN DE LAS LEYES DE LOS GASES PDFLaura Valentina RodriguezAún no hay calificaciones
- Caudales Medios Del Río Chancay-LambayequeDocumento11 páginasCaudales Medios Del Río Chancay-LambayequeJhosmelVàsquezRAún no hay calificaciones
- Light Emitting Diode (Led)Documento36 páginasLight Emitting Diode (Led)Marcos Luna CervantesAún no hay calificaciones
- Tema 6 Fluidos de YacimientoDocumento21 páginasTema 6 Fluidos de YacimientoIsraeljose CastellanoAún no hay calificaciones
- Segundo Examen OrdinarioDocumento1 páginaSegundo Examen OrdinarioEduardo RM0% (1)
- Gases Reales Ecuacion de Estado PitzerDocumento17 páginasGases Reales Ecuacion de Estado PitzerBautista GioAún no hay calificaciones
- Guía de Prácticas de Laboratorio Masa II 2018ADocumento21 páginasGuía de Prácticas de Laboratorio Masa II 2018AIsrael CachumbaAún no hay calificaciones
- Características Del Estado Líquido de La MateriaDocumento6 páginasCaracterísticas Del Estado Líquido de La MateriaJuan Jesús OrtízAún no hay calificaciones
- Problema 8-6Documento4 páginasProblema 8-6EduardodelAngelAún no hay calificaciones
- Unidad 2 2.9 - 2.15Documento4 páginasUnidad 2 2.9 - 2.15Martinez Ramirez100% (1)
- Informe N°4 - Evaporador Doble EfectoDocumento13 páginasInforme N°4 - Evaporador Doble EfectoDAHANA CAROLINA VARGAS AGROTAAún no hay calificaciones
- ClasedeestadogaseosoDocumento8 páginasClasedeestadogaseosoEdith LlerenaAún no hay calificaciones
- Laboratorio Fenómenos Ley de StokeDocumento10 páginasLaboratorio Fenómenos Ley de StokeFelipe Vásquez ArribasplataAún no hay calificaciones
- Thomas-Andrews (Katherin Montesdeoca)Documento4 páginasThomas-Andrews (Katherin Montesdeoca)Gonzalo MontesdeocaAún no hay calificaciones
- Ecuaciones de EstadoDocumento6 páginasEcuaciones de EstadoFerna DiazAún no hay calificaciones
- La Materia, Sus Propiedades y CambiosDocumento18 páginasLa Materia, Sus Propiedades y CambiosSheila VargasAún no hay calificaciones