Documentos de Académico
Documentos de Profesional
Documentos de Cultura
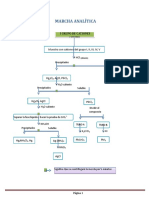
Esquemas Cationes
Cargado por
joselyn bulleTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Esquemas Cationes
Cargado por
joselyn bulleCopyright:
Formatos disponibles
Manual de Laboratorio de Química Analítica
SOLUCIÓN PROBLEMA
↓
Añadir HCl a la solución caliente.
Centrifugar mientras está caliente
Precipitado ↓ Solución
↓ ↓
AgCl, Hg2Cl2 Ajustar el pH entre 3 y 4. Utilice NaOH
Grupo I Cloruros y HCl. Añada Benzoato de sodio y
benzoato de amonio. Caliente en baño
de María y centrifugue mientras está
caliente.
Precipitado Solución
↓ ↓
SnO2 xH2O, BiOCl, SbOCl, Fe(OH)Bz2,
●
Al(OH)Bz2, Cr(OH)Bz2. Añadir NaF ó NH4F. Centrifugar
Grupo II Benzoatos*
Precipitado Solución
↓ ↓
PbF2, Mg F2, BaF2, SrF2, CaF2. Alcalinizar con exceso de NaOH.
Grupo III Fluoruros Centrifugar
Precipitado Solución
↓ ↓
Mn(OH)2, Fe(OH)2, Hg(OH)2, Cu(OH)2, SnO2 2─ , AsO2 2─ , ZnO2 2─
Co(OH)2, Ni(OH)2, Cd(OH)2.
Grupo IV No Anfotéricos Grupo V Anfotéricos
(Hidróxidos)
* Se abrevia la fórmula del ion benzoato (C6H5COO─) como Bz.
Figura 1 Esquema general de separación de cationes
Lic. Marisela Luzardo Cationes -4 Octubre 2006
Manual de Laboratorio de Química Analítica
Una vez separados los grupos de cationes, es necesario realizar pruebas para identificar cada uno
de ellos. A continuación se presenta el esquema de separación e identificación de los cationes de cada uno
de los grupos.
GRUPO I: CLORUROS
↓
Colocar aproximadamente 0,5 mL de la muestra problema,
en un tubo de centrífuga. Calentar ¡cuidadosamente! A
ebullición y añadir 3 gotas de HCl 6 mol/L. Centrifugar
mientras está caliente.
Añadir una gota adicional de HCl para evaluar si ocurrió una
precipitación completa.
Precipitado Solución
↓ ↓
AgCl, Hg2Cl2 Solución para analizar el Grupo II
Añadir 10 gotas de NH4OH 6 mol/L
Agitar fuertemente hasta disolver.
Centrifugar.
Precipitado Solución
↓ ↓
Hg, HgNH2Cl [Ag(NH3)2] +, Cl─
La formación de un precipitado negro Acidificar la solución con HNO3 6
de Hg libre indica la presencia del ion mol/L. La formación de un precipitado
Hg2 2 + en la muestra original blanco (de AgCl) que se oscurece en la
luz indica la presencia del ion Ag + en
la muestra original
Figura 2 Esquema de separación e identificación del Grupo I
Lic. Marisela Luzardo Cationes -5 Octubre 2006
Manual de Laboratorio de Química Analítica
GRUPO II: BENZOATOS
↓
Utilizar la solución remanente del grupo I. (Si no precipitaron
cationes del Grupo I, tomar 1 mL de la muestra original)
Ajustar el pH a 3-4 utilizando NH4OH ó HCl diluídos.
Agregar 2 gotas de benzoato de amono 0,5 mol/L y calentar a
ebullición. Añadir 5 gotas de benzoato de sodio 0,5 mol/L y
calentar por 10 minutos en baño de agua. Centrifugar y lavar el
precipitado tres veces con solución caliente de NH4NO3 1
mol/L
Precipitado Solución y aguas de lavado
↓ ↓
SnO2 xH2O, BiOCl, SbOCl, Fe(OH)Bz2,
●
Solución para analizar el Grupo III
Al(OH)Bz2, Cr(OH)Bz2. *
Añadir 10 gotas de HNO3 6 mol/L
Calentar suavemente. Centrifugar.
Lavar el precipitado con HNO3 6 mol/L
Precipitado Solución y aguas de lavado
↓ ↓
H2SnO3, SbOCl Bi3+, Fe3+, Al3+, Cr3+
Disolver en HCl 6 mol/L.
Dividir en dos porciones
[SnCl6]2─ [SbCl4]─
Añadir un trozo de alambre de hierro y Agregar 10 gotas de
calentar para reducir el volumen. H2C2O4 saturado. Añadir 1
Centrifugar y descartar el precipitado. gota de Na2S 0,1 mol/L.
A la solución añadir 1 gota de HgCl2 0,1 La formación de un
mol/L. La formación de un precipitado precipitado anaranjado de
blanco que se vuelve gris, confirma la Sb2S3 indica la presencia
presencia de Sn 4 + de Sb 3 +
Continúa en la página siguiente
* Se abrevia la fórmula del ion benzoato (C6H5COO─) como Bz.
Figura 3 Esquema de separación e identificación del Grupo II
Lic. Marisela Luzardo Cationes -7 Octubre 2006
Manual de Laboratorio de Química Analítica
GRUPO II: BENZOATOS (continuación)
↓
Bi3+ , Fe3+, Al3+, Cr3+
Alcalinizar la solución con NaOH y
agregar 4 gotas de H2O2 3 %. Calentar
hasta hervir durante 1 minuto.
Centrifugar
Precipitado Solución
↓ ↓
Bi(OH)3 , Fe(OH)3 AlO2─ , CrO2─
Disolver en HCl 6 mol/L. Dividir en dos porciones
Dividir en dos porciones
Alcalinizar con NaOH 6 mol/L. Añadir 1 gota de K4 [Fe(CN)6]
Añadir 1 gota de SnCl2 0,1 mol/L. La formación de un precipitado
La formación de un precipitado negro azul de Fe4[Fe(CN)6]3 (azul de
de Bio indica la presencia de Bi 3 + Prusia) indica la presencia de
Fe 3+
Acidificar con HCl 6 mo/L Añada 2 mL de KMnO4 0,2 mol/L y luego 3 mL de
Añadir 10 gotas de solución de NaOH 2 mol/L. Caliente a ebullición y centrifugue.
alizarina Transfiera el sobrenadante a un tubo limpio.
Alcalinizar con NaOH 6 mol/L Acidifique con HNO3 6 mol/L y añada 1 mL de
exceso. Enfríe la solución en un baño de hielo. Añada
La formación de una laca roja
2 mL de eter y 1 mL de H2O2 3 %. Agite. La
indica la presencia de Al 3 + formación una coloración azul (ácido percrómico) en
(Si la laca, o la solución son de la capa de eter, indica la presencia de Cr 3+ (El ácido
color azul o morado, el test es percrómico formado [H3CrO8] es inestable y se pierde
negativo) el color azul de la solución a temperatura ambiente,
por eso la prueba sólo funciona en soluciones frías)
Procedimiento alternativo para cromo: Acidifique ligeramente con HCl 3 mol/L (evite exceso de HCl) Agregar 1 mL de
acetato de etilo. Añadir (gota a gota) una mezcla (50-50) de HCl 6 mol/L y H2O2 hasta acidificar levemente. Evite añadir
exceso de HCl ya que puede destruir el color. Se puede usar ácido tricloro acético en lugar de HCl. La formación una
coloración azul en la capa de éter, indica la presencia de Cr 3 + (El ácido percrómico formado [H3CrO8] es inestable y se
pierde el color azul de la solución a temperatura ambiente, por eso la prueba sólo funciona en soluciones frías)
Figura 3 Esquema de separación e identificación del Grupo II (continuación)
Lic. Marisela Luzardo Cationes -8 Octubre 2006
Manual de Laboratorio de Química Analítica
GRUPO III: FLUORUROS
↓
Utilizar la solución remanente del grupo I.
(Si no precipitaron cationes del Grupo I ni del Grupo II,
tomar 1 mL de la muestra original)
Añadir 5 gotas de NaF 1 mol/L, dejar en reposo durante 5
minutos, agitando ocasionalmente.
Precipitado Solución
↓ ↓
PbF2 , MgF2 , BaF2 , SrF2 , CaF2 Solución para analizar el Grupo IV
Lavar el precipitado con una mezcla de
KOH - K2CO3
Centrifugar. Repetir el lavado
Precipitado Solución y aguas de lavado
↓ ↓
MgF2 , BaF2 , SrF2 , CaF2 PbO22─
Añadir 3 gotas de HCl concentrado para Acidificar con ácido acético
disolver el precipitado. Agregar 10 gotas de Añadir 2 gotas de KI 0,1 mol/L.
H3BO3 saturado. Añadir NH4Cl sólido hasta La formación de un precipitado amarillo
saturar. Alcalinizar con NH4OH de PbI2 indica la presencia de Pb 2+
concentrado. Calentar casi a ebullición.
Agregar 5 gotas de (NH4)2CO3 dejar reposar
3 minutos y centrifugar.
Precipitado Solución
↓ ↓
BaCO3 , SrCO3 , CaCO3 , Mg2+
Alcalinizar con NH4OH 6 mol/L
Continúa en la página siguiente Agregar 10 gotas de Na2HPO4 0,5
mol/L. dejar en reposo 10 minutos.
La formación de un precipitado blanco
(finamente dividido) de MgHPO4 indica
la presencia de Mg 2+
Figura 4 Esquema de separación e identificación del Grupo III
Lic. Marisela Luzardo Cationes -10 Octubre 2006
Manual de Laboratorio de Química Analítica
GRUPO III: FLUORUROS (continuación)
Precipitado (viene de la página
anterior)
↓
BaCO3 , SrCO3 , CaCO3 ,
Disolver en ácido acético 6 mol/L
Añadir 2 gotas en exceso. Añadir 3
gotas de acetato de amonio 3 mol/L y 2
gotas de K2CrO4 1 mol/L. Centrifugar
Precipitado Solución
↓ ↓
BaCrO4 (amarillo) Sr2+ Ca2+
Disolver en HCl 6 mol/L. Hacer la Alcalinizar con NH4OH 6 mol/L.
prueba de la llama. Una llama verde Agregar 1 gota de K2CrO4 y 1 gota de
amarillenta indica la presencia de Ba etanol 95 %.
2+ Centrifugar
Precipitado Solución
↓ ↓
SrCrO4 Ca2+
Colocar la solución en una cápsula de porcelana.
Disolver en HCl 6 mol/L Hacer la Calentar ¡CON CUIDADO! Para evaporar el
prueba de la llama. etanol.
Una llama roja (con chispas) indica Acidificar con ácido monocloro acético 4 mol/L .
la presencia de Sr 2+ Agregar 10 gotas en exceso.
Calentar casi a ebullición y agregar 2 gotas de
(NH4)2C2O4 0,2 mol/L. Agitar vigorosamente.
Centrifugar. La formación de un precipitado
blanco de CaC2O4 indica la presencia de Ca 2+
Figura 4 Esquema de separación e identificación del Grupo III (continuación)
Lic. Marisela Luzardo Cationes -11 Octubre 2006
Manual de Laboratorio de Química Analítica
GRUPO IV: NO ANFOTÉRICOS (HIDRÓXIDOS)
↓
Utilizar la solución remanente del grupo III.
Agregar 1 mL de NaOH 6 mol/L y calentar a ebullición.
Agitar vigorosamente y centrifugar.
Precipitado Solución y aguas de lavado
↓ ↓
Mn(OH)2, Fe(OH)2, Hg(OH)2, Cu(OH)2,
Solución para analizar el Grupo V
Co(OH)2, Ni(OH)2, Cd(OH)2.
Disolver en HCl 6 mol/L. Alcalinizar con
NH4OH concentrado y agregar un
exceso. Centrifugar. Lavar el
precipitado con NH4OH 6 mol/L.
Centrifugar
Precipitado Solución y aguas de lavado
↓ ↓
Mn(OH)2, Fe(OH)2, HgNH2Cl [Co(NH3)6] 2+ [Cu(NH3)6] 2+
Agregar 5 gotas de H2O2. [Ni(NH3)6] 2+ [Cd(NH3)6] 2+
Disolver en HNO3 6 mol/L.
Dividir en tres porciones
Hervir. Agregar Hervir para reducir el Añadir 1 gota de H2O2
NaBiO3 sólido. Hervir volumen a pocas Añadir 1 gota de
y centrifugar. La gotas. Agregar 10 K4Fe(CN)6. La
formación de una gotas de agua y 5 formación de un
coloración púrpura de gotas de SnCl2 0,1 precipitado color azul
MnO4─ indica la mol/L. La formación de profundo indica la
presencia de Mn 2+ un precipitado blanco presencia de Fe 2+ en
que cambia a gris la muestra original.
indica la presencia de
Hg 2+
Continúa en la página siguiente
Figura 5 Esquema de separación e identificación del Grupo IV
Lic. Marisela Luzardo Cationes -13 Octubre 2006
Manual de Laboratorio de Química Analítica
GRUPO IV: NO ANFOTÉRICOS (continuación)
↓
[Co(NH3)6] 2+ [Cu(NH3)6] 2+ [Ni(NH3)6] 2+
[Cd(NH3)6] 2+
Agregar HCl concentrado hasta acidificar fuertemente.
Calentar a ebullición. Añadir una punta de espátula de
Na2SO3 sólido. Hervir. Repetir el procedimiento hasta
que desaparezca cualquier coloración azul. Agregar 1
mL de NH4SCN a la solución caliente. Centrifugar
Precipitado Solución
↓ ↓
Cu(SCN)2 [Co(SCN)6] 4 ─ [Ni(SCN)6] 2 ─ [Cd(SCN)6] 2
─
Tomar 1 gota de la solución y agregar 5 gotas de
Agregar 12 gotas de HCl concentrado acetona. Si se forma una coloración azul, indica
para disolver. Agregar 3 gotas de la presencia de Co 2+
HNO3 concentrado. Hervir. Descartar Si eso ocurre, colocar el resto de la solución en
cualquier precipitado. Alcalinizar una cápsula de porcelana y evaporar a sequedad.
fuertemente con NH4OH concentrado. Agregar 10 gotas de KCl saturado y disolver el
La formación de una coloración azul de residuo. Acidificar con ácido acético 6 mol/L,
[Cu(NH3)4 ] 2 + confirma la presencia de agregar 2 gotas de exceso. Agregar 5 gotas de
Cu 2+ KNO2 6 mol/L Dejar reposar 10 minutos.
Centrifugar.
Precipitado Solución
↓ ↓
K3[Co(NO2)6] (precipitado amarillo) Ni 2 + Cd 2 +
Disolver en HCl 6 mol/L. Agregar 1 Alcalinizar con NH4OH 6 mol/L, agregar 1 mL
gota de NH4SCN 1 mol/L y 5 gotas de de dimetilglioxima y centrifugar. Comprobar la
acetona. Si la solución se torna azul, precipitación total agregando 1 gota de
dimetilglioxima luego de centrifugar
indica la presencia de Co 2+
Precipitado Solución
↓ ↓
Ni(C4H6O2N2H)2 Cd 2 +
La formación de un precipitado rojo Acidificar ligeramente con HCl 6 mol/L. Agregar 3
indica la presencia de Ni 2+ gotas de Na2S. La formación de un precipitado
amarillo de CdS indica la presencia de Cd 2+
Figura 5 Esquema de separación e identificación del Grupo IV (continuación)
Lic. Marisela Luzardo Cationes -14 Octubre 2006
Manual de Laboratorio de Química Analítica
GRUPO V: ANFOTERICOS
↓
Utilizar la solución remanente del grupo IV.
Alcalinizar la solución con NH4OH concentrado.
Agregar un exceso, centrifugar.
Lavar el precipitado con 10 gotas de NH4OH 3 mol/L
Precipitado Solución y aguas de lavado
↓ ↓
Sn(OH)2 [AsO2]─ , [Zn(NH3)4] 2+
Disolver en HCl concentrado. Añadir un Dividir en dos porciones
trozo de alambre de hierro. Hervir hasta
reducir el volumen a pocas gotas. Remover
el residuo y hierro y agregar 1 gota de HgCl2.
La formación de un precipitado blanco que se
torna gris, indica la presencia de Sn 2+
Agregar 10 gotas de NaOH 6 mol/L. Acidificar con HCl 6 mol/L. Alcalinizar con NH4OH
Agregar un poco de aluminio granulado 6 mol/L y agregar 2 gotas en exceso. Agregar 2
gotas de Na2S 0,1 mol/L.
y colocar un tapón de algodón en la La formación de un precipitado blanco indica la
boca del tubo. Cubrir la boca del tubo presencia de Zn 2 +
con un papel de filtro. Colocar 1 gota de
AgNO3 sobre el papel de filtro. La
formación de una mancha oscura o
negra indica la presencia de As 3 +
!Cuidado: los vapores de arsénico
son tóxicos!
Figura 6 Esquema de separación e identificación del Grupo V
Lic. Marisela Luzardo Cationes -16 Octubre 2006
También podría gustarte
- Cationes Analitica Julio 2023Documento7 páginasCationes Analitica Julio 2023Salvador CorderoAún no hay calificaciones
- Guia de Laboratorio Quimica Analitica IDocumento19 páginasGuia de Laboratorio Quimica Analitica IYESSENIA VELASQUEZ ZUÑIGAAún no hay calificaciones
- 0bjetivos: Separación E Identificación de Cationes Del Sub Grupo Iii B O Sub Grupo Del ZincDocumento6 páginas0bjetivos: Separación E Identificación de Cationes Del Sub Grupo Iii B O Sub Grupo Del Zincroshmel asenciosAún no hay calificaciones
- PRELABORATORIO9Documento6 páginasPRELABORATORIO9roshmel asenciosAún no hay calificaciones
- Analisis Cualitativo Cationes PDFDocumento17 páginasAnalisis Cualitativo Cationes PDFEduardo AlvarezAún no hay calificaciones
- Separaciones Analíticas PDFDocumento32 páginasSeparaciones Analíticas PDFRomán DelgadoAún no hay calificaciones
- Practica de Laboratorio de Quimica InorganicaDocumento7 páginasPractica de Laboratorio de Quimica InorganicaRozanna GarcíaAún no hay calificaciones
- Analisis de Cationes y AnionesDocumento28 páginasAnalisis de Cationes y AnionesARAMAYO JuanAún no hay calificaciones
- Analisis Cualitativo CationesDocumento17 páginasAnalisis Cualitativo CationesingjoselaraAún no hay calificaciones
- Informe 4Documento5 páginasInforme 4Dario Quimis SantanaAún no hay calificaciones
- Separaciones AnaliticasDocumento32 páginasSeparaciones AnaliticasDavid Camilo MojicaAún no hay calificaciones
- Marcha SistemáTica Reducida AnáLisis Cationes 2021Documento20 páginasMarcha SistemáTica Reducida AnáLisis Cationes 2021Mateo Alejandro Martinez PinedaAún no hay calificaciones
- Analisis Cualitativo Cationes PDFDocumento17 páginasAnalisis Cualitativo Cationes PDFaavvilaAún no hay calificaciones
- Guia de Quimica Analítica CualitativaDocumento18 páginasGuia de Quimica Analítica CualitativaDeivis J' GutierrezAún no hay calificaciones
- Introduccion A La Quimica AnaliticaDocumento16 páginasIntroduccion A La Quimica AnaliticaUg JcAún no hay calificaciones
- Marcha Sistematica de AnionesDocumento5 páginasMarcha Sistematica de AnionesjuanAún no hay calificaciones
- 1 GrupoDocumento2 páginas1 GrupoPia AmableAún no hay calificaciones
- 1º Laboratorio de Análisis Químico - 07Documento10 páginas1º Laboratorio de Análisis Químico - 07Anonymous 3u4xMRsAún no hay calificaciones
- Tablas y Procedimiento 2Documento4 páginasTablas y Procedimiento 2JuenetoAún no hay calificaciones
- 3er Informe-Separación de Cationes Del Grupo IiDocumento10 páginas3er Informe-Separación de Cationes Del Grupo IiUNIAún no hay calificaciones
- Lab Nro 3.Documento5 páginasLab Nro 3.Marcos AltamiranoAún no hay calificaciones
- Analisis Quimico Reporte 2Documento9 páginasAnalisis Quimico Reporte 2JAIRO HINOSTROZA ROJASAún no hay calificaciones
- Lab 1 - Cationes en Grupos y 1er GrupoDocumento8 páginasLab 1 - Cationes en Grupos y 1er GrupoEllenAún no hay calificaciones
- Informe 3 PDFDocumento20 páginasInforme 3 PDFKristel AdelaAún no hay calificaciones
- Avance de Informe LaboratorioDocumento7 páginasAvance de Informe LaboratorioRODRIGO GIANPIER SILVERA MEDINAAún no hay calificaciones
- Laboratorio Cationes Grupo IV 7Documento7 páginasLaboratorio Cationes Grupo IV 7huberAún no hay calificaciones
- Informe de Analitica Cationes Grupo 2a (Autoguardado)Documento6 páginasInforme de Analitica Cationes Grupo 2a (Autoguardado)DavidJimenezAún no hay calificaciones
- Reporte Química PDFDocumento12 páginasReporte Química PDFTJEKEYKURFKRYRKAún no hay calificaciones
- Balance de Ecuaciones RedoxDocumento7 páginasBalance de Ecuaciones RedoxnanodelgadoAún no hay calificaciones
- Separacion e Identificacion de CationesDocumento5 páginasSeparacion e Identificacion de CationesLinda Margarita Alcala BoteroAún no hay calificaciones
- QuimicaDocumento5 páginasQuimicaAugusto RamírezAún no hay calificaciones
- 5-Informe Analisis Quimico ImprimirDocumento16 páginas5-Informe Analisis Quimico ImprimirEvelyn Caja UrcuhuarangaAún no hay calificaciones
- Guia Qu518 Lab1Documento7 páginasGuia Qu518 Lab1Steef Mayckol Mauricio DiazAún no hay calificaciones
- Determinación Gravimétrica de NíquelDocumento9 páginasDeterminación Gravimétrica de NíquelReyes ĄllenAún no hay calificaciones
- Trabajo de Química: Marcha AnalíticaDocumento8 páginasTrabajo de Química: Marcha AnalíticaOlinda Susana Rodríguez Díaz100% (1)
- 4ta Divicion de Cationes 1Documento7 páginas4ta Divicion de Cationes 1esmeralda villcaAún no hay calificaciones
- Practica 3 AnaliticaDocumento13 páginasPractica 3 AnaliticaCRISTIAN ELEAZAR HURTADO ANTICONAAún no hay calificaciones
- Práctica de Laboratorio #01 Marcha Analítica de Separación de Cationes en Grupos I. Objetivo: Ii. IntroducciónDocumento8 páginasPráctica de Laboratorio #01 Marcha Analítica de Separación de Cationes en Grupos I. Objetivo: Ii. IntroducciónRicardo HernandezAún no hay calificaciones
- Informe 8 Química Grupo 2018Documento16 páginasInforme 8 Química Grupo 2018Victoria RuizAún no hay calificaciones
- Separacion de AnionesDocumento20 páginasSeparacion de AnionesRonaldo QuispeAún no hay calificaciones
- Quimica Analitica-Practica #1Documento7 páginasQuimica Analitica-Practica #1Vásquez C. VCAún no hay calificaciones
- Procedimiento Esquemático - G15Documento8 páginasProcedimiento Esquemático - G15wilsonAún no hay calificaciones
- Guía de Laboratorio Análisis QuímicoDocumento25 páginasGuía de Laboratorio Análisis Químicojordanzr10Aún no hay calificaciones
- Laboratorio Informe Análisis Químico Tema 2 Uni Figmm 2017Documento10 páginasLaboratorio Informe Análisis Químico Tema 2 Uni Figmm 2017Joel Mamani100% (1)
- Guía QU518 Lab3Documento3 páginasGuía QU518 Lab3Rt JimAún no hay calificaciones
- Práctica 2 Marchas Analiticas 3Documento9 páginasPráctica 2 Marchas Analiticas 3Paulina PMAún no hay calificaciones
- Lms - Inacap.cl - Pluginfile - PHP - 6573086 - Mod - Resource - Content - 0 - Guía N°6 de Laboratorio de Química Analítica IDocumento5 páginasLms - Inacap.cl - Pluginfile - PHP - 6573086 - Mod - Resource - Content - 0 - Guía N°6 de Laboratorio de Química Analítica IGuillermo OliverAún no hay calificaciones
- Informe 3......................Documento22 páginasInforme 3......................Jhonatan EGAún no hay calificaciones
- Calculos y ResultadosDocumento4 páginasCalculos y Resultadosheymi puma segoviaAún no hay calificaciones
- Analisis de CalcioDocumento6 páginasAnalisis de CalcioGeovi Condori CortezAún no hay calificaciones
- Laboratorio N°06 UniDocumento24 páginasLaboratorio N°06 UniMiuler Aguilar GrandezAún no hay calificaciones
- Marcha Analtica Cationes Del 1er y 2do GrupoDocumento16 páginasMarcha Analtica Cationes Del 1er y 2do GrupoStephany CarhuazAún no hay calificaciones
- Tarea Quimica1Documento6 páginasTarea Quimica1Wman Martinez50% (2)
- Informe PsDocumento28 páginasInforme PsHugo Abdel Oblitas HuayapoAún no hay calificaciones
- Identificacion de Cationes Del Grupo IDocumento9 páginasIdentificacion de Cationes Del Grupo IJhonatan IbarraAún no hay calificaciones
- 2do GrupoDocumento15 páginas2do GrupoHerbert De la CruzAún no hay calificaciones
- 3ER LAB. Marcha Analítica de Cationes Del Ácido SulfhídricoDocumento7 páginas3ER LAB. Marcha Analítica de Cationes Del Ácido SulfhídricoGilbert Tomy Japay RoblesAún no hay calificaciones
- Propiedades Fisicas de Las Rocas-Fluidos y Mecanismos de ProduccionDocumento95 páginasPropiedades Fisicas de Las Rocas-Fluidos y Mecanismos de ProduccionGustavo Guerrero100% (4)
- Patente Productos Conformados Con Fibras de Cemento y Fibras de Refuerzo para Dichos ProductosDocumento14 páginasPatente Productos Conformados Con Fibras de Cemento y Fibras de Refuerzo para Dichos ProductosMauro GelmiAún no hay calificaciones
- Texto 9Documento18 páginasTexto 9Anyel Juarez DelgadoAún no hay calificaciones
- Manual para La Fabricacin de Silos Metlicos para Almacenar GranosDocumento162 páginasManual para La Fabricacin de Silos Metlicos para Almacenar GranosLuis GarzaAún no hay calificaciones
- Sgs-Terex 670Documento8 páginasSgs-Terex 670MoisesAún no hay calificaciones
- Quinto OlimpiadaDocumento8 páginasQuinto OlimpiadaLopez PedroAún no hay calificaciones
- 05 Ppto ApriscoDocumento1 página05 Ppto ApriscoJLuis FernandezAún no hay calificaciones
- Lista de Chequeo para Liquidar ContratosDocumento8 páginasLista de Chequeo para Liquidar ContratosJonathan SiervoAún no hay calificaciones
- Investigacion Costos Por Orden de ProduccionDocumento9 páginasInvestigacion Costos Por Orden de ProduccionNeydenAún no hay calificaciones
- Manual Técnico Tubería Hierro Dúctil Edición 1Documento126 páginasManual Técnico Tubería Hierro Dúctil Edición 1Mario LunaAún no hay calificaciones
- 051 Celdas de Flotacion 120211152143 Phpapp01Documento41 páginas051 Celdas de Flotacion 120211152143 Phpapp01ErickAún no hay calificaciones
- Maciasontiveros PDFDocumento163 páginasMaciasontiveros PDFMiry Vásquez RamírezAún no hay calificaciones
- Equipos de LaboratorioDocumento7 páginasEquipos de LaboratorioVely CalderonAún no hay calificaciones
- Tema 6 Factores de ContingenciaDocumento8 páginasTema 6 Factores de Contingenciafederico de LlamasAún no hay calificaciones
- PLV PDFDocumento34 páginasPLV PDFIveth AnduagaAún no hay calificaciones
- Aspirotronic - Terna - SirioDocumento2 páginasAspirotronic - Terna - Siriowilliams9830Aún no hay calificaciones
- Cuestionario Pre PrensaDocumento13 páginasCuestionario Pre PrensaDanyAnabel MaldonadoAún no hay calificaciones
- Ensayo, Agua Como Materia Prima.Documento5 páginasEnsayo, Agua Como Materia Prima.Giovanni JarquinAún no hay calificaciones
- Trabajo FinalDocumento11 páginasTrabajo FinalJose CortesAún no hay calificaciones
- Catalogo de Bujias Bosch 2008Documento72 páginasCatalogo de Bujias Bosch 2008phenix_130% (2)
- Actividades - Metodos de Fraccionamiento de FaseDocumento3 páginasActividades - Metodos de Fraccionamiento de Fasevarela_manuelaAún no hay calificaciones
- Geotextiles en La ConstrucciónDocumento5 páginasGeotextiles en La ConstrucciónHellin Alarma AcedoAún no hay calificaciones
- Inc in Er AdoresDocumento7 páginasInc in Er AdoresGeorgina Guadalupe Segovia CisnerosAún no hay calificaciones
- Proceso de ProduccionDocumento20 páginasProceso de Produccionjosue garciaAún no hay calificaciones
- WPS PernosDocumento1 páginaWPS PernosCharlyAún no hay calificaciones
- Viviendaunifamiliar Laura Alvarez Campana Instalacion SanitariaDocumento11 páginasViviendaunifamiliar Laura Alvarez Campana Instalacion SanitariaYuber Tacuri CristobalAún no hay calificaciones
- Molino de Rodillos y Solera Movil MpsDocumento6 páginasMolino de Rodillos y Solera Movil Mpscarlos ccopaAún no hay calificaciones
- Resumen GreenexDocumento23 páginasResumen GreenexDiego Fernando Sevillano CastilloAún no hay calificaciones
- Costos Por Procesos II 08Documento25 páginasCostos Por Procesos II 08api-3710234100% (2)
- II Plan Integral de Gestión de Residuos Urbanos de Bizkaia (2005-2016)Documento31 páginasII Plan Integral de Gestión de Residuos Urbanos de Bizkaia (2005-2016)kriofirAún no hay calificaciones