Documentos de Académico
Documentos de Profesional
Documentos de Cultura
1QUI01-Química 1 (1) - 6
1QUI01-Química 1 (1) - 6
Cargado por
lomade2224Descripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
1QUI01-Química 1 (1) - 6
1QUI01-Química 1 (1) - 6
Cargado por
lomade2224Copyright:
Formatos disponibles
Este material, de distribución gratuita, no contiene necesariamente las modificaciones
que se hayan incorporado durante la realización de las evaluaciones.
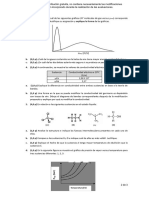
a. (1,5 p) Teniendo en cuenta que cada línea de un espectro corresponde a un color distinto,
explique por qué estos espectros brindan evidencia de la cuantización de la energía de los
átomos.
b. (1,5 p) Determine la energía necesaria (en kJ) para formar 1 mol de iones H+ a partir de la
extracción de los electrones de los átomos de hidrógeno neutros en su estado basal. Determine
también la frecuencia asociada a esta radiación. ¿La energía es emitida o absorbida por los
átomos de hidrógeno?
6. (4 puntos) En algunas zonas de los andes del Perú se utiliza leña, estiércol y residuos de cosechas
como fuentes de energía para cocinar alimentos. También utilizan el kerosene. Entre los compuestos
que conforman el kerosene está el n-dodecano (C12H26). La combustión (quema) del C12H26 (g) se
realiza cuando reacciona con el O2(g) del aire. Esta reacción produce CO2 (g) y H2O (l). Se libera una
energía de 8146,39 kJ por cada mol de n-dodecano quemado.
a. (1,0 p) Escriba la ecuación termoquímica balanceada de la reacción de combustión del n-
dodecano a condiciones estándar y 25 °C. Utilice unidades del Sistema Internacional.
b. (1,5 p) Si se queman 200 gramos de n-dodecano, ¿cuántos gramos de CO2 (g) y de H2O(l) se
producen? ¿Qué cantidad de moles de O2 (g) se necesitarían?
c. (1,5 p) Otra fuente de energía es el metano, CH4 (g). El calor liberado en la quema de 1 mol de
CH4 (g) es 890,25 kJ. Al quemar 200 gramos de cada sustancia (CH4 y C12H26), ¿cuál de las dos
reacciones de combustión produce mayor cantidad de calor? Justifique su respuesta con
cálculos.
Datos:
Masas atómicas (uma): H: 1, C: 12, O: 16
1 kg = 103 g 1 onza =28,7g 1 pie= 30,48 cm 1000 L= 1 m3 1 µ L= 10-6 L
T (K) = T(°C)+273
E = hν c = λν En = -RH (1/n2)
23
NA = 6,022 x 10 RH = 2,18 x 10-18 J h= 6,63 x 10-34 J s c = 3 x 108 ms-1
Lima, 15 de setiembre de 2017
También podría gustarte
- Boletines Quifi - 230710 - 162814Documento21 páginasBoletines Quifi - 230710 - 162814Ser BlancAún no hay calificaciones
- Materiales para ingeniería 1: Introducción a las propiedades, las aplicaciones y el diseñoDe EverandMateriales para ingeniería 1: Introducción a las propiedades, las aplicaciones y el diseñoCalificación: 5 de 5 estrellas5/5 (3)
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- QF1 Tema1 ProbDocumento5 páginasQF1 Tema1 ProbÁLvaro Salsavilca CayetanoAún no hay calificaciones
- 3 2 Termoquimica Problemas Resueltos de Acceso A La Universidad IDocumento109 páginas3 2 Termoquimica Problemas Resueltos de Acceso A La Universidad ICarlos Arranz HerreroAún no hay calificaciones
- Ejercicios PendientesDocumento12 páginasEjercicios PendientesJorman Grisales0% (1)
- Ejercicios-Bao Villarreal, FrankarlosDocumento13 páginasEjercicios-Bao Villarreal, FrankarlosFrancarlos Bao VillarrealAún no hay calificaciones
- Ej - U3 - Cinetica y TermoquimicaDocumento4 páginasEj - U3 - Cinetica y TermoquimicamartatrimbusAún no hay calificaciones
- Deber Entalpia PDFDocumento4 páginasDeber Entalpia PDFkellyAún no hay calificaciones
- TERMODINAMICA QUÍMICA 1° Bachillerato Enero 2021Documento4 páginasTERMODINAMICA QUÍMICA 1° Bachillerato Enero 2021LeticiaAún no hay calificaciones
- 3 3 Termoquimica Problemas Resueltos de Acceso A La Universidad IIDocumento75 páginas3 3 Termoquimica Problemas Resueltos de Acceso A La Universidad IICarlos Arranz HerreroAún no hay calificaciones
- TERMOQUIMICADocumento3 páginasTERMOQUIMICALucia PeñatoAún no hay calificaciones
- Ejercicios 2qDocumento73 páginasEjercicios 2qolimpico1Aún no hay calificaciones
- Ejercicos TermodinámicaDocumento4 páginasEjercicos TermodinámicaJuan Felipe Álvarez GonzalezAún no hay calificaciones
- Ej 01 SolDocumento12 páginasEj 01 SolsornaAún no hay calificaciones
- Termo EBAUDocumento10 páginasTermo EBAUAcademia Santo TomásAún no hay calificaciones
- Ejercicios PAU de TermoquimicaDocumento9 páginasEjercicios PAU de TermoquimicapatriciaAún no hay calificaciones
- Ejercicios de Termoquã MicaDocumento8 páginasEjercicios de Termoquã MicaCelia Carrasco ReyAún no hay calificaciones
- Relación 3Documento2 páginasRelación 3estudiosuja74Aún no hay calificaciones
- Sol QG Giti Giq A16Documento3 páginasSol QG Giti Giq A16Alberto Rios IglesiasAún no hay calificaciones
- Problemas Resueltos de Termoquimica (ANAYA)Documento8 páginasProblemas Resueltos de Termoquimica (ANAYA)Victor García100% (1)
- 2 - ºbachillerato - Ejercicios - TERMOQUÃ MICADocumento3 páginas2 - ºbachillerato - Ejercicios - TERMOQUÃ MICA5npbn9v6xyAún no hay calificaciones
- Trabajo de EjerciciosDocumento18 páginasTrabajo de EjerciciosBrayan Abel Flores CarhuapomaAún no hay calificaciones
- Ej - U3 - SOL - Cinetica y TermoquimicaDocumento13 páginasEj - U3 - SOL - Cinetica y TermoquimicamartatrimbusAún no hay calificaciones
- Asesoria 1 Q2 H206 209Documento5 páginasAsesoria 1 Q2 H206 209Daniel Kenzo Egashira OrtegaAún no hay calificaciones
- 11 Ejercicios - De.termodinamica - Con.solucionDocumento10 páginas11 Ejercicios - De.termodinamica - Con.solucionlacamreAún no hay calificaciones
- Ejercicios Termoquimica 2022Documento11 páginasEjercicios Termoquimica 2022Pamela MoralesAún no hay calificaciones
- Taller No. 2 TermoquímicaDocumento4 páginasTaller No. 2 TermoquímicaMaria Fernanda AyalaAún no hay calificaciones
- Prueba Parcial 1 Termodinámica CDocumento4 páginasPrueba Parcial 1 Termodinámica CJose de la FuenteAún no hay calificaciones
- Problemas TermodinamciaDocumento3 páginasProblemas Termodinamciagabriel sarzuriAún no hay calificaciones
- 2ºBachQuim - Ejercicios Entalpias y Ley Hess - SOLDocumento4 páginas2ºBachQuim - Ejercicios Entalpias y Ley Hess - SOLAdriana PInedaAún no hay calificaciones
- Semana 8guía de Problemas para La Práctica 3Documento7 páginasSemana 8guía de Problemas para La Práctica 3JUNIORAún no hay calificaciones
- Ejercicios de Termodinc3a1mica y Cinc3a9tic1Documento6 páginasEjercicios de Termodinc3a1mica y Cinc3a9tic1Leidy Vargas RämïrêzAún no hay calificaciones
- Actividad 1.3 Determinación de Calor de ReacciónDocumento3 páginasActividad 1.3 Determinación de Calor de ReacciónKaren EspinozaAún no hay calificaciones
- Termodinámica. Cálculo de EntalpíasDocumento8 páginasTermodinámica. Cálculo de EntalpíasAndrea VintilaAún no hay calificaciones
- Problemas Resueltos de Termodinc3a1mica7Documento9 páginasProblemas Resueltos de Termodinc3a1mica7Teresa AristeAún no hay calificaciones
- q2b t03 Termoquc3afmica Doc 5 Ejemplos de Exc3a1menesDocumento4 páginasq2b t03 Termoquc3afmica Doc 5 Ejemplos de Exc3a1menesSebas Locuras y masAún no hay calificaciones
- Problemas Resueltos de Termodinc3a1mica7Documento9 páginasProblemas Resueltos de Termodinc3a1mica7antonioAún no hay calificaciones
- Calor de Combustión PDFDocumento6 páginasCalor de Combustión PDFAlexandra ArboledaAún no hay calificaciones
- Ejercicios de Termodinámica2022 (m2)Documento12 páginasEjercicios de Termodinámica2022 (m2)nelljesus1810Aún no hay calificaciones
- Ejercicios CinéticaDocumento5 páginasEjercicios CinéticalplualuchaAún no hay calificaciones
- Guias TermodinámicaDocumento7 páginasGuias TermodinámicaEmilia Paz Gatica CamposAún no hay calificaciones
- Repartido Ejercicio de Termodinámica PDFDocumento3 páginasRepartido Ejercicio de Termodinámica PDFPablo Martin FagundezAún no hay calificaciones
- Pau Quim Set 15 EsDocumento10 páginasPau Quim Set 15 EsAcademicScientistsAún no hay calificaciones
- SOLUCIONARIO - Parte de TERMOQUÍMICA - Unidad 4Documento5 páginasSOLUCIONARIO - Parte de TERMOQUÍMICA - Unidad 4matiasarmerodiazAún no hay calificaciones
- Ejercicios Selectividad Termodinámica 2º Bach QuímicaDocumento5 páginasEjercicios Selectividad Termodinámica 2º Bach Químicaagurtzane.iturbeAún no hay calificaciones
- Ejercicios Energía de Las Reacciones QuímicasDocumento3 páginasEjercicios Energía de Las Reacciones Químicasparajuegosxd2008Aún no hay calificaciones
- Termoquimica Ejercicios de SelectividadDocumento20 páginasTermoquimica Ejercicios de Selectividadgiulianno26Aún no hay calificaciones
- Ejer Termoquimica 2Documento4 páginasEjer Termoquimica 2rtzAún no hay calificaciones
- Ejercicios+termodinámica Pedro de ValdiviaDocumento8 páginasEjercicios+termodinámica Pedro de ValdiviaIngrid AlvaradoAún no hay calificaciones
- Ejercicios TermodinámicaDocumento8 páginasEjercicios TermodinámicaIngrid AlvaradoAún no hay calificaciones
- 05 Solucionario Fyq 1bach PDFDocumento30 páginas05 Solucionario Fyq 1bach PDFRafael Zamora50% (2)
- Prueba III Industrial Termoqca + Redox A 1º Semestre 2012Documento6 páginasPrueba III Industrial Termoqca + Redox A 1º Semestre 2012pemp1996Aún no hay calificaciones
- Boletin 3 TERMODINAMICADocumento5 páginasBoletin 3 TERMODINAMICAAdolfo VelasquezAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Gasificación de briquetas de carbón con biomasa:: una alternativa energética sostenibleDe EverandGasificación de briquetas de carbón con biomasa:: una alternativa energética sostenibleAún no hay calificaciones
- La ecuación general de segundo grado en dos y tres variablesDe EverandLa ecuación general de segundo grado en dos y tres variablesAún no hay calificaciones
- 1QUI01-Química 1 (1) - 33Documento1 página1QUI01-Química 1 (1) - 33lomade2224Aún no hay calificaciones
- 1QUI01-Química 1 (1) - 28Documento1 página1QUI01-Química 1 (1) - 28lomade2224Aún no hay calificaciones
- 1QUI01-Química 1 (1) - 31Documento1 página1QUI01-Química 1 (1) - 31lomade2224Aún no hay calificaciones
- 1QUI01-Química 1 (1) - 27Documento1 página1QUI01-Química 1 (1) - 27lomade2224Aún no hay calificaciones
- 1QUI01-Química 1 (1) - 19Documento1 página1QUI01-Química 1 (1) - 19lomade2224Aún no hay calificaciones
- 1QUI01-Química 1 (1) - 23Documento1 página1QUI01-Química 1 (1) - 23lomade2224Aún no hay calificaciones
- 1QUI01-Química 1 (1) - 7Documento1 página1QUI01-Química 1 (1) - 7lomade2224Aún no hay calificaciones
- 1QUI01-Química 1 (1) - 18Documento1 página1QUI01-Química 1 (1) - 18lomade2224Aún no hay calificaciones