Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Investigacion Tabla Periodica
Cargado por
Misael Ixcot0 calificaciones0% encontró este documento útil (0 votos)
16 vistas9 páginasHistoria de la Tabla Periodica
Título original
investigacion tabla periodica
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoHistoria de la Tabla Periodica
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
16 vistas9 páginasInvestigacion Tabla Periodica
Cargado por
Misael IxcotHistoria de la Tabla Periodica
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 9
Universidad de Guatemala, Sede Mazatenango.
Facultad de Ingeniería, Matemáticas y ciencias Físicas.
Nombre:
Carné:
Curso: Química Inorgánica I
Catedrático:
Tarea: Tabla periódica.
Introducción:
La tabla periódica actual constituye una de las claves para comprender la química
y, actualmente existen muchos elementos los cuales se han venido descubriendo
y agregando a lo largo de la historia de la tabla periódica, se representan cada uno
por un símbolo, para facilitar, los elementos están ordenados por grupos
considerando diferentes aspectos y características para organizarlos. lo cual nos
ayuda a encontrar información de los elementos y poder conocer sus similitudes
entre ellos.
Objetivos:
Conocer cómo se clasifican los elementos en la tabla periódica.
Conocer que los elementos se representan mediante símbolos.
Diferenciar entre elementos metálicos y no metálicos.
Facilitar la información que se requiera de algún elemento.
Representar de una forma ordenada y organizada todos los elementos
descubiertos.
Tabla Periódica:
Origen:
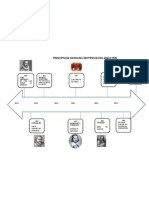
Durante el siglo XIX, los químicos comenzaron a clasificar los elementos
conocidos de acuerdo con similitudes en sus propiedades físicas y químicas. El
final de esos estudios generó la Tabla Periódica Moderna que conocemos.
Entre 1817 y 1829, el químico alemán Johan Dobereiner clasificó a algunos
elementos en grupos de tres denominados triadas, ya que tenían propiedades
químicas similares. Por ejemplo, en la triada cloro (Cl), bromo (Br) y yodo (I) notó
que la masa atómica de Br estaba muy próxima al promedio de la masa de Cl e I.
Desafortunadamente no todos los elementos se agrupaban en triadas y sus
esfuerzos fallaron para proponer una clasificación de los elementos.
En 1863, el químico inglés, John Newlands clasificó los elementos establecidos en
varios grupos proponiendo la Ley de Octavas, conformado por elementos de masa
atómica creciente, donde ciertas propiedades se repetían cada 8 elementos.
En 1869, el químico ruso Dmitri Mendeleev publicó su primera tabla periódica de
los elementos organizada en orden creciente de masa atómica. Al mismo tiempo,
Lothar Meyer, químico alemán, publicó su tabla propia periódica con los elementos
ordenados de menor a mayor masa atómica. Mendeleev organizó su tabla en filas
horizontales dejando espacios vacíos donde debían incorporar algunos elementos
que aún no habían sido descubiertos. En esa organización Mendeleev visualizó un
patrón aparente: elementos con propiedades químicas similares aparecen en
intervalos regulares (o periódicos) en las columnas verticales de la tabla. El
respaldo a las predicciones de Mendeleev se produce tras el descubrimiento de
galio (Ga), escandio (Sc) y germanio (Ge) entre 1874 y 1885 localizándolos en
aquellos espacios vacíos, lo que dio aun mas valor y aceptación de su Tabla
Periódica en la comunidad científica.
En 1913, un químico inglés, Henry Moseley, mediante estudios de rayos X,
determinó la carga nuclear (número atómico) de los elementos, reagrupándolos en
orden creciente de número atómico, tal como la conocemos hoy.
Concepto de la Tabla periódica:
La Tabla Periódica de los elementos es un registro de todos los elementos
químicos conocidos por la humanidad. Los elementos están ordenados en forma
de tabla según su número atómico (número de protones), su configuración
electrónica y sus propiedades químicas. En esta tabla los elementos están
organizados en filas y columnas que muestran cierta periodicidad: los elementos
que pertenecen a una misma columna tienen propiedades similares. En principio,
toda la materia conocida del universo está compuesta por diversas combinaciones
de los 118 elementos, registrados en la Tabla Periódica.
Se han establecido símbolos, llamados símbolos químicos, para representar a
cada elemento de la Tabla Periódica, que además están identificados según
sus estados de agregación (sólido, líquido o gas) a una temperatura de 0 °C y a
una presión de 1atm. La Tabla Periódica es una herramienta fundamental para
la química, la biología y otras ciencias naturales, que se actualiza con el pasar de
los años, conforme aprendemos más sobre las propiedades de la materia y las
relaciones entre los elementos.
Organización de la tabla Periódica:
Las 18 columnas verticales conforman los conocidos como grupos de la tabla
periódica y son elementos que tienden a tener propiedades químicas similares. por
ejemplo, la columna más a la izquierda de la tabla, la conocida como el grupo de
los metales alcalinos, contiene elementos como el sodio, el potasio o el litio, todos
ellos sólidos a temperatura ambiente, con puntos de fusión bajos, muy reactivos y
con tendencia a ennegrecerse en contacto con el aire. Su nomenclatura ha
cambiado, tanto a lo largo del tiempo como de los países donde se nombren.
Clasificación de los elementos de la tabla periódica:
Grupo 1: metales alcalinos Grupo 9: familia del cobalto
Grupo 2: metales Grupo 10: familia del níquel
alcalinotérreos
Grupo 11: familia del cobre
Grupo 3: familia del escandio
Grupo 12: familia del zinc
(tierras raras y actínidos)
Grupo 13: térreos
Grupo 4: familia del titanio
Grupo 14: carbonoideos
Grupo 5: familia del vanadio
Grupo 15: nitrogenoideos
Grupo 6: familia del cromo
Grupo 16: calcógenos o
Grupo 7: familia del
anfígenos
manganeso
Grupo 17: halógenos
Grupo 8: familia del hierro
Grupo 18: gases nobles
Períodos
Las filas horizontales de la tabla periódica son llamadas períodos. 68 El número de
niveles energéticos de un átomo determina el periodo al que pertenece. Cada nivel
está dividido en distintos subniveles, que conforme aumenta su número
atómico se van llenando en este orden:
Siguiendo esa norma, cada elemento se coloca según su configuración
electrónica y da forma a la tabla periódica.
Los elementos en el mismo período muestran tendencias similares en radio
atómico, energía de ionización, afinidad electrónica y electronegatividad. En un
período el radio atómico normalmente decrece si nos desplazamos hacia la
derecha debido a que cada elemento sucesivo añadió protones y electrones, lo
que provoca que este último sea arrastrado más cerca del núcleo. 69 Esta
disminución del radio atómico también causa que la energía de ionización y la
electronegatividad aumenten de izquierda a derecha en un período, debido a la
atracción que ejerce el núcleo sobre los electrones. La afinidad electrónica
también muestra una leve tendencia a lo largo de un período. Los metales —a la
izquierda— generalmente tienen una afinidad menor que los no metales —a la
derecha del período—, excepto para los gases nobles.
Bloques
La tabla periódica se puede también dividir en bloques de acuerdo a la secuencia
en la que se llenan las capas de electrones de los elementos. Cada bloque se
denomina según el orbital en el que en teoría reside el último electrón: s, p, d y f.
El bloque s comprende los dos primeros grupos (metales alcalinos y
alcalinotérreos), así como el hidrógeno y el helio. El bloque p comprende los
últimos seis grupos —que son grupos del 13 al 18 en la IUPAC (3A a 8A en
América)— y contiene, entre otros elementos, todos los metaloides. El bloque
d comprende los grupos 3 a 12 —o 3B a 2B en la numeración americana de grupo
— y contiene todos los metales de transición. El bloque f, a menudo colocado por
debajo del resto de la tabla periódica, no tiene números de grupo y se compone de
lantánidos y actínidos.72 Podría haber más elementos que llenarían otros orbitales,
pero no se han sintetizado o descubierto; en este caso se continúa con el orden
alfabético para nombrarlos. Así surge el bloque g, que es un bloque hipotético.
Grupo IA o grupo 1: metales alcalinos
Los metales alcalinos tienen las siguientes características:
Alta reactividad Potencial de reducción
negativo
Baja energía de ionización
Tienden a formar solo
Baja electronegatividad
compuestos en su estado de
oxidación +1
Grupo IIA o grupo 2: metales alcalinotérreos
Los metales alcalinotérreos tienen estas características:
Son blandos y tienen baja densidad
Son muy reactivos, aunque menos que los del grupo 1
Forman compuestos solo en el estado de oxidación +2
Grupo VII: halógenos
Los halógenos son elementos muy reactivos que, al reaccionar con los metales,
forman sales.
Grupo VIII: Gases nobles (o gases inertes)
Los gases nobles se caracterizan por tener una estructura electrónica cerrada, dos
electrones para el helio (He) y un octeto para los demás (Ne, Ar, Kr, Xe, Rn). Estas
configuraciones son especialmente estables y explican su nula o escasa
reactividad.
Estos, además, son:
Monoatómicos
Incoloros
Inodoros
Insípidos
No inflamables,
Conclusiones:
la tabla periódica fue una investigación en la cual participaron varias
personas a lo largo de su historia.
Para la organización de los grupos y columnas de la tabla periódica se
consideraron varias características de los elementos.
la tabla periódica ha facilitado la obtención de datos de algún elemento que
se encuentre registrado en la tabla periódica.
Cada grupo, columna, fila comparten una similitud entre ellos.
E-grafía:
https://www.nationalgeographic.com.es/ciencia/tabla-
periodica-forma-ordenar-elementos-quimicos_15988
https://www.studysmarter.es/resumenes/quimica/enlaces-
quimicos/tabla-periodica-actual/
https://concepto.de/tabla-periodica/
También podría gustarte
- Trabajo de Investigacion Sobre La Tabla PeriodicaDocumento11 páginasTrabajo de Investigacion Sobre La Tabla PeriodicaAmelia Ysaac GomezAún no hay calificaciones
- Tabla PeriódicaDocumento5 páginasTabla PeriódicamaxAún no hay calificaciones
- UntitledDocumento41 páginasUntitledjania prasca martinezAún no hay calificaciones
- Taller de QuimicaDocumento7 páginasTaller de Quimicacristina arrietaAún no hay calificaciones
- Tabla PeriodicaDocumento19 páginasTabla PeriodicaJoaquin AraujoAún no hay calificaciones
- Clasificación Periódica de Los Elementos QuímicosDocumento20 páginasClasificación Periódica de Los Elementos QuímicosSanty de la OAún no hay calificaciones
- Papito CoronaDocumento11 páginasPapito CoronaAngel AranaAún no hay calificaciones
- Grado 10°. Química. Carlos León 4° Per.Documento11 páginasGrado 10°. Química. Carlos León 4° Per.YENNIFER ALEXANDRA PULIDO SANCHEZAún no hay calificaciones
- Taller 2 Tabla Periódica Rafael HernandezDocumento5 páginasTaller 2 Tabla Periódica Rafael Hernandezkprueba111Aún no hay calificaciones
- Qué Es La Tabla Periódica de Los ElementosDocumento12 páginasQué Es La Tabla Periódica de Los ElementosJuan Carlos Frias OlivarAún no hay calificaciones
- Un Elemento Quimico NanDocumento7 páginasUn Elemento Quimico NanNydia RiosAún no hay calificaciones
- Taller 2 Tabla PeriódicaDocumento5 páginasTaller 2 Tabla PeriódicaFunes FonsecaAún no hay calificaciones
- Tabla PeriodicafcenDocumento15 páginasTabla Periodicafcenmaria magdalena lunaAún no hay calificaciones
- 1b I.I Quimica Investigacion Tun May Jarhet RolandoDocumento20 páginas1b I.I Quimica Investigacion Tun May Jarhet RolandoJarhet Tun MayAún no hay calificaciones
- Tabla PeriódicaDocumento16 páginasTabla PeriódicaCami CriadoAún no hay calificaciones
- Taller 2 Tabla PeriódicaDocumento5 páginasTaller 2 Tabla PeriódicaLuz Deivis JulioAún no hay calificaciones
- La tabla periódica: organización y evoluciónDocumento5 páginasLa tabla periódica: organización y evoluciónDsvAún no hay calificaciones
- 4 2siiDocumento10 páginas4 2siiCHRISTOPHER ENMANUEL POCASANGRE PAZAún no hay calificaciones
- Clase Tabla PeriodicaDocumento43 páginasClase Tabla PeriodicaManuel Alarcón Hidalgo100% (1)
- Guia de Aprendizaje Tabla Periódica 1eros MediosDocumento7 páginasGuia de Aprendizaje Tabla Periódica 1eros Mediosidgd3007Aún no hay calificaciones
- 5 - Propiedades Periodicas PDFDocumento12 páginas5 - Propiedades Periodicas PDFmksilvareyes100% (1)
- 1b I.I Quimica Investigacion Tun May Jarhet RolandoDocumento20 páginas1b I.I Quimica Investigacion Tun May Jarhet RolandoJarhet Tun MayAún no hay calificaciones
- Trabajo de La Tabla PeriodicaDocumento12 páginasTrabajo de La Tabla PeriodicaDeivi Perez100% (1)
- Actividad 3 - Tabla Periódica 1Documento10 páginasActividad 3 - Tabla Periódica 1Sandra Ken RubioAún no hay calificaciones
- Tabla PeriódicaDocumento8 páginasTabla PeriódicaEdwis Castañeda VelásquezAún no hay calificaciones
- Tabla Periódica y Sus ElementosDocumento90 páginasTabla Periódica y Sus ElementosNany HeddrichAún no hay calificaciones
- Clase 5 Ley PeriodicaDocumento33 páginasClase 5 Ley Periodicaluis joseAún no hay calificaciones
- Tabla PeriódicaDocumento10 páginasTabla PeriódicaNoel GalaAún no hay calificaciones
- FICHA de LECTURA Tabla PeriodicaDocumento5 páginasFICHA de LECTURA Tabla PeriodicaSebastian CABRERA SUMARAún no hay calificaciones
- TALLER 4to y 5to Tabla PeriodicaDocumento3 páginasTALLER 4to y 5to Tabla PeriodicaFlorez Yeris0% (1)
- Informe 3 QuimicaDocumento5 páginasInforme 3 QuimicaPriscila Pillaca OlivaresAún no hay calificaciones
- Guía de aprendizaje de tabla periódica y propiedades periódicasDocumento7 páginasGuía de aprendizaje de tabla periódica y propiedades periódicasNatalia Cruz Varón0% (1)
- Sesión N°3Documento44 páginasSesión N°3Karla CoronadoAún no hay calificaciones
- Tema # 1Documento6 páginasTema # 1Antonela RamirezAún no hay calificaciones
- Tarea1Química (Andrés Borgonio)Documento19 páginasTarea1Química (Andrés Borgonio)Andres LopezAún no hay calificaciones
- Tabla PeriódicaDocumento52 páginasTabla PeriódicaKarla AntonelaAún no hay calificaciones
- La Tabla PeriodicaDocumento4 páginasLa Tabla PeriodicaIvan Esmit MayhuaAún no hay calificaciones
- La tabla periódica: organización y familias de elementos químicosDocumento5 páginasLa tabla periódica: organización y familias de elementos químicosNury Lizarazo AlbarracinAún no hay calificaciones
- La importancia de la tabla periódicaDocumento15 páginasLa importancia de la tabla periódicaNeryeth GonzálezAún no hay calificaciones
- Características de La TablaDocumento6 páginasCaracterísticas de La TablaLuisao Aldas OlallaAún no hay calificaciones
- SergioDocumento13 páginasSergioGraciela Ticona LuqueAún no hay calificaciones
- La Tabla Periodica y Sus Elementos UfpsDocumento22 páginasLa Tabla Periodica y Sus Elementos UfpsNathalia AmayaAún no hay calificaciones
- Oxigeno Sustancia Activa Del AireDocumento39 páginasOxigeno Sustancia Activa Del AirexxpgavxxAún no hay calificaciones
- Informe de Laboratorio de Química Practica 10Documento38 páginasInforme de Laboratorio de Química Practica 10Maria Rosa Pillajo Kashijint50% (2)
- Taller de Tabla PeriódicaDocumento4 páginasTaller de Tabla PeriódicaDiego Fernando Ardila Ariza100% (1)
- Tabla PeriodicaDocumento99 páginasTabla PeriodicaRanyelis CabreraAún no hay calificaciones
- Química GUÍA 4 - TABLA PERIODICA10°Documento6 páginasQuímica GUÍA 4 - TABLA PERIODICA10°oso flowAún no hay calificaciones
- Innovar Ciclo 5 Quimica Unidad 1 Tabla PeriodicaDocumento13 páginasInnovar Ciclo 5 Quimica Unidad 1 Tabla PeriodicaestmaayalaAún no hay calificaciones
- Tabla PeriodicaDocumento16 páginasTabla PeriodicaGermanAún no hay calificaciones
- ESCRITOquiicageneral 2020Documento11 páginasESCRITOquiicageneral 2020Tatiana AriasAún no hay calificaciones
- Elementos Químicos Tabla PeriódicaDocumento79 páginasElementos Químicos Tabla PeriódicaElena SalazarAún no hay calificaciones
- 2019-Tabla Periódica para ProyectarDocumento43 páginas2019-Tabla Periódica para ProyectarJhoel Sebastian Torres GaonaAún no hay calificaciones
- Tabla PeriodicaDocumento6 páginasTabla PeriodicaMartinAún no hay calificaciones
- Clasificación de Los Elementos y Su Presencia % en El Cuerpo HumanoDocumento4 páginasClasificación de Los Elementos y Su Presencia % en El Cuerpo HumanoMemo AguilarAún no hay calificaciones
- Generalidades de La Tabla PeriodicaDocumento12 páginasGeneralidades de La Tabla PeriodicaElver GalargaAún no hay calificaciones
- Tabla Periodica de LosDocumento1 páginaTabla Periodica de LosLes JimenezAún no hay calificaciones
- TABLA PERIODICA (1) (Reparado)Documento4 páginasTABLA PERIODICA (1) (Reparado)Angel VanegasAún no hay calificaciones
- TablaperiodicaDocumento20 páginasTablaperiodicaCristianAún no hay calificaciones
- La tabla periódica de los elementos químicosDe EverandLa tabla periódica de los elementos químicosCalificación: 1 de 5 estrellas1/5 (1)
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- Catastrofes AereasDocumento3 páginasCatastrofes AereasSteven Hincapie FlorezAún no hay calificaciones
- Fracttal OneDocumento6 páginasFracttal OnewilliamAún no hay calificaciones
- Mitsubishi L200 SPORTERO 2.5 High Power - Mercado LibreDocumento2 páginasMitsubishi L200 SPORTERO 2.5 High Power - Mercado LibremarcosjuvAún no hay calificaciones
- Apuntes Apendicitis PDFDocumento7 páginasApuntes Apendicitis PDFEslin Cipion Bueno100% (1)
- Conmutable 4 Vias ElectricidadDocumento9 páginasConmutable 4 Vias ElectricidadLuis Carlos RodríguezAún no hay calificaciones
- Especificaciones Tecnicas Especificas Partidas Nuevas #02Documento35 páginasEspecificaciones Tecnicas Especificas Partidas Nuevas #02Guimo LastraAún no hay calificaciones
- Articulo Cientifico AlgasDocumento19 páginasArticulo Cientifico AlgasDiego Cornejo ParedesAún no hay calificaciones
- Apu InicialDocumento38 páginasApu InicialRuben MarquinaAún no hay calificaciones
- Quemaduras Apuntes de InvestigacionDocumento2 páginasQuemaduras Apuntes de InvestigacionLINDA JAZMIN MOSQUERA AGUDELOAún no hay calificaciones
- Trabajo Fósiles OviedoDocumento7 páginasTrabajo Fósiles OviedoNerea Cascon DiazAún no hay calificaciones
- Ejercicio % RemocionDocumento2 páginasEjercicio % RemocionJuan Jose MontenegroAún no hay calificaciones
- Cristian 00553Documento2 páginasCristian 00553Victor Rigoberto Cuc SubAún no hay calificaciones
- Electricidad Del AutomóvilDocumento86 páginasElectricidad Del Automóviljonny david martinez perez100% (1)
- Especificaciones Técnicas Mínimas de La Infraestructura Soporte de La Red Interna de Telecomunicaciones Del InmuebleDocumento18 páginasEspecificaciones Técnicas Mínimas de La Infraestructura Soporte de La Red Interna de Telecomunicaciones Del InmuebleCristian Escobar SantamaríaAún no hay calificaciones
- Ubicación TemporalDocumento10 páginasUbicación TemporalMaría JoséAún no hay calificaciones
- Ética o Filosofía Moral by Luz García Alonso (Z-Lib - Org) - 24Documento1 páginaÉtica o Filosofía Moral by Luz García Alonso (Z-Lib - Org) - 24Luis LozanoAún no hay calificaciones
- Genoma HumanoDocumento7 páginasGenoma HumanoMaria JoseAún no hay calificaciones
- Informe Factores Contaminantes Del Medio AmbienteDocumento9 páginasInforme Factores Contaminantes Del Medio AmbienteNataly CubidesAún no hay calificaciones
- Estabilidad Criterios Routh HurwitzDocumento20 páginasEstabilidad Criterios Routh HurwitzFernando Vasquez CornejoAún no hay calificaciones
- La Normalidad y Anormalidad PsíquicaDocumento3 páginasLa Normalidad y Anormalidad PsíquicaDanielAún no hay calificaciones
- Gestión y Desarrollo TurísticoDocumento8 páginasGestión y Desarrollo TurísticoTequilaAún no hay calificaciones
- Sistema de FrenosDocumento4 páginasSistema de FrenosBrayanAún no hay calificaciones
- Principales Avances Cientificos Del Siglo XviiDocumento1 páginaPrincipales Avances Cientificos Del Siglo XviiSocrates Coronado Calle60% (78)
- Sibine Spanish OPP 12 1996Documento8 páginasSibine Spanish OPP 12 1996Javier Rincón RojasAún no hay calificaciones
- Shampoo CarminDocumento18 páginasShampoo CarminHana RivadeneyraAún no hay calificaciones
- Proyecto de Construcción y MejoramientoDocumento21 páginasProyecto de Construcción y MejoramientoDanny CajahuancaAún no hay calificaciones
- 001-PTS - Instalación de Inclinómetros - Exploración Profunda ENGIE-SIERRA (Rev RGG)Documento15 páginas001-PTS - Instalación de Inclinómetros - Exploración Profunda ENGIE-SIERRA (Rev RGG)Anonymous QZdKvyAún no hay calificaciones
- 2019 Protac CompressedDocumento36 páginas2019 Protac CompressedIliMonteroAún no hay calificaciones
- Determinacion de Cu Por VolumetriaDocumento16 páginasDeterminacion de Cu Por Volumetriajhoni100% (4)