Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Quimica 3
Cargado por
Hansseydel Anibal Salazar GargateDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Quimica 3
Cargado por
Hansseydel Anibal Salazar GargateCopyright:
Formatos disponibles
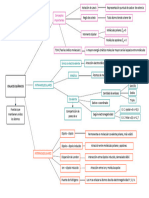
Átomos libres Átomos unidos
• Mayor energía • Menor energía
• Menor estabilidad • Mayor estabilidad
Electrones distribuidos en la capa de
valencia o superior
Fuerza de atracción
principalmente de naturaleza
eléctrica que se da entre 2 Es la energía que se libera cuando se forma un mol
Para elementos
átomos que se unen para alcanzar mayor
Electrones de Valencia Energía de Enlace (EE) de enlace químico o la energía necesaria para
representativos (Grupo A) estabilidad o menor energía.
romper (disociar) un mol de enlace químico.
Concepto
Cuando los átomos de los elementos representativos se
Representación de los electrones de valencia
enlazan, pueden perder, ganar o compartir electrones con
Regla del Octeto Enlace Químico Notación Lewis mediante puntos para cada átomo de elementos
la finalidad de tener 8 electrones en la capa de valencia y
representativos.
así tener mayor estabilidad.
• En general participan
• Hay excepciones donde participan metal y no metal
metal y no metal pero no es compuesto iónico ( no hay iones): BeF2,
Múltiple BeCl2, BeBr2 , BeI2, AlCl3, AlBr3 ,AlI3 etc.
Pi (π )
• En su formación se transfieren 1 o
Características • En compuestos EN: Electronegatividad
Por el # de pares Un enlace más electrones por unidad fórmula. Generales iónicos binarios entre los elementos
Sigma (𝝈 ) Por superposición Clasificación Simple
compartidos
• Estructuras cristalinas, enlace iónico polidireccional
fuerza de atracción
(Química 3) • Unidad fundamental: Unidad fórmula
Propiedades Enlace
Enlace Químico I
electromagnética, mantiene unido
Enlace Iónico o Propiedades • Les corresponde alta temperatura de fusión
a dos átomos que comparten e .
- Generales Covalente Electrovalente Generales • 𝑈𝑟: E. requerida para disociar un mol de unidad F.
Generalmente entre no metales. • Generalmente son solubles en solventes polares.
• (l) o (ac) son conductores eléctricos (electrolitos)
Moléculas estables cuyo
Anomalías del
Estructura Lewis
átomo central no cumple el
Estructura Lewis en C. Iónicos
octeto electrónico
octeto electrónico
Sustancias
Moleculares
Los metales son
sólidos cristalinos.
Enlace Metálico De naturaleza eléctrica Se presenta en los metales y sus aleaciones
Reglas
Modelo del mar de
electrones o gas electrónico
Conductividad eléctrica. Brillo metálico.
Se pueden explicar
ciertas propiedades
Maleabilidad. Conductividad calorífica.
Ductilidad.
También podría gustarte
- Junio - Quimica - 51Documento19 páginasJunio - Quimica - 51Jimmy Alexander Ochoa RuizAún no hay calificaciones
- Mapa Conceptos EnlacesDocumento1 páginaMapa Conceptos EnlacesjaiderAún no hay calificaciones
- Mapa de Enlaces QuimicosDocumento1 páginaMapa de Enlaces QuimicosCeleste LeyvaAún no hay calificaciones
- 18qu - Mica 3S - Ii-Enlaces QuimicosDocumento18 páginas18qu - Mica 3S - Ii-Enlaces Quimicosana maria salamanca chaconAún no hay calificaciones
- Junio - Quimica - 3Documento21 páginasJunio - Quimica - 3Dionne BeckAún no hay calificaciones
- Átomo, Molécula y Tipo de Enlaces - Mapa MentalDocumento1 páginaÁtomo, Molécula y Tipo de Enlaces - Mapa MentalAna JaramilloAún no hay calificaciones
- F3180a1684717789enlacesquimicos Peruanoespañol 2023Documento5 páginasF3180a1684717789enlacesquimicos Peruanoespañol 2023José Carlos Hernández MalcaAún no hay calificaciones
- Bloque VDocumento40 páginasBloque VMafer SolanoAún no hay calificaciones
- Química General: Preparación Al Más Alto NivelDocumento3 páginasQuímica General: Preparación Al Más Alto NivelCarlos Choqueapaza CalizayaAún no hay calificaciones
- Anexo 2 - Tarea 3Documento22 páginasAnexo 2 - Tarea 3andres felipe contrerasAún no hay calificaciones
- Tarea 2 Enlace Quimico y Estructura MolecularDocumento22 páginasTarea 2 Enlace Quimico y Estructura Molecularjulian solaqueAún no hay calificaciones
- Enlace QuimicoDocumento1 páginaEnlace QuimicoMITZAY SANCHEZAún no hay calificaciones
- Enlace QuímicoDocumento14 páginasEnlace QuímicoJuMer LlenQueAún no hay calificaciones
- Clase 7 - U3 (Enlace Químico-Enlace Iónico-Covalente)Documento50 páginasClase 7 - U3 (Enlace Químico-Enlace Iónico-Covalente)BrunoAún no hay calificaciones
- Quim. (03) 23 - 01 - 14Documento6 páginasQuim. (03) 23 - 01 - 14Percy TorresAún no hay calificaciones
- Enlace QuímicoDocumento11 páginasEnlace QuímicoMARIA ALEXANDRA PACHON ARANDIAAún no hay calificaciones
- UC1 - 1. Enlace Iónico: Chang 11 Ed. Cap 9.1-9.3 Brown 12 Ed. Cap 8.1-8.2Documento33 páginasUC1 - 1. Enlace Iónico: Chang 11 Ed. Cap 9.1-9.3 Brown 12 Ed. Cap 8.1-8.2LUCIANA BETZABE ANCHATU�A MORALESAún no hay calificaciones
- 8 Clase Enlace Quimico IDocumento42 páginas8 Clase Enlace Quimico IGerman CanizalesAún no hay calificaciones
- Clase Semana 2 y 3 Completo PDFDocumento20 páginasClase Semana 2 y 3 Completo PDFSawyer Baldwin Katny AdonisAún no hay calificaciones
- Enlaces QuímicosDocumento1 páginaEnlaces QuímicosGenesis Zapata GilAún no hay calificaciones
- Diapositivas de ENLACE QUIMICODocumento30 páginasDiapositivas de ENLACE QUIMICOMax Percy Carhuamaca RojasAún no hay calificaciones
- Mapa Conceptual - Enlaces - Mecanica de MaterialesDocumento1 páginaMapa Conceptual - Enlaces - Mecanica de MaterialesAlejandra PrietoAún no hay calificaciones
- Junio - Quimica - 5toDocumento12 páginasJunio - Quimica - 5toJimmy Alexander Ochoa RuizAún no hay calificaciones
- T4 Enlaces Quimicos y ReferenciaDocumento2 páginasT4 Enlaces Quimicos y ReferenciaYUZULY ANDREA AMAYA HERNANDEZAún no hay calificaciones
- Clase 3 - Enlace Quimico 2024Documento87 páginasClase 3 - Enlace Quimico 2024sylvana maguiñaAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa ConceptualbdanailinAún no hay calificaciones
- QuimicaDocumento9 páginasQuimicasus galireAún no hay calificaciones
- Capítulo 4Documento2 páginasCapítulo 4Carlos Jiménez RomeroAún no hay calificaciones
- Enlace QuímicoDocumento2 páginasEnlace QuímicoLuis Enrique MNAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa ConceptualFer ÁngelesAún no hay calificaciones
- Mapa Conceptual de Enlaces Quimicos 4Documento1 páginaMapa Conceptual de Enlaces Quimicos 4Micol YaksonAún no hay calificaciones
- Guia Nº 03 - ENLACE QUIMICODocumento5 páginasGuia Nº 03 - ENLACE QUIMICOAriana RodriguezAún no hay calificaciones
- Actividad 1Documento1 páginaActividad 1Ivan AsumasaAún no hay calificaciones
- Clasificación de La Materia Masa AtómicaDocumento1 páginaClasificación de La Materia Masa AtómicaPaloma De La CruzAún no hay calificaciones
- Cuadro Sinoptico - Tipos de EnlacesDocumento1 páginaCuadro Sinoptico - Tipos de EnlacesArmando MyAún no hay calificaciones
- Mapa Sesion 6Documento1 páginaMapa Sesion 6AngeloAún no hay calificaciones
- Unidad2 Tarea 2 Enlace Quimico y Estructura MolecularDocumento4 páginasUnidad2 Tarea 2 Enlace Quimico y Estructura MolecularBrayan Bareño FerroAún no hay calificaciones
- Clase 5 El Enlace Químico 2016Documento24 páginasClase 5 El Enlace Químico 2016Ignacio GonzálezAún no hay calificaciones
- 5-Estructura MolecularDocumento35 páginas5-Estructura Molecularivan carvajalAún no hay calificaciones
- Wuolah Free TEMA 3Documento20 páginasWuolah Free TEMA 3AuroraAún no hay calificaciones
- Mapa Mental Lluvia de Ideas Colorido VerdeDocumento1 páginaMapa Mental Lluvia de Ideas Colorido Verderubenvaldezzz15Aún no hay calificaciones
- Enlaces QuimicosDocumento2 páginasEnlaces QuimicosCielo YadhiraAún no hay calificaciones
- Teoria Enlace QuímicoDocumento2 páginasTeoria Enlace QuímicoVerónica Miriam Espinosa SalasAún no hay calificaciones
- QuimicaDocumento4 páginasQuimicaTalia Veronica ReyesAún no hay calificaciones
- Enlaces Ionicos y Nomenclatura QuimicaDocumento9 páginasEnlaces Ionicos y Nomenclatura QuimicaIsabel Palacios NoleAún no hay calificaciones
- Cim Tareas1 GonzalezsolisjaimeDocumento3 páginasCim Tareas1 GonzalezsolisjaimepedroAún no hay calificaciones
- QuimicaaaaDocumento1 páginaQuimicaaaamr.hc.skyAún no hay calificaciones
- Si1ma-Qu-T05 - Enlace QuímicoDocumento38 páginasSi1ma-Qu-T05 - Enlace QuímicoFlavio VRAún no hay calificaciones
- CM1 - Enlace QuímicoDocumento36 páginasCM1 - Enlace QuímicogonsanmiAún no hay calificaciones
- Ucb Contenido 5Documento30 páginasUcb Contenido 5JgAún no hay calificaciones
- Enlaces Químicos P II 2020Documento30 páginasEnlaces Químicos P II 2020LilithAún no hay calificaciones
- Tipos de EnlaceDocumento2 páginasTipos de EnlaceHernández NataliaAún no hay calificaciones
- Enlaces Quimicos y Soluciones QuímicasDocumento35 páginasEnlaces Quimicos y Soluciones QuímicasBrenda HernandezAún no hay calificaciones
- Trabajo de QuímicaDocumento8 páginasTrabajo de QuímicaNatalia Romero VillaAún no hay calificaciones
- Quimica 2Documento12 páginasQuimica 2Wall RemAún no hay calificaciones
- Enlaces QuimicosDocumento8 páginasEnlaces QuimicosCHAMORRO SAAVEDRA ELIOT RICARDOAún no hay calificaciones
- Cuadro Sinoptico Enlaces QuimicosDocumento1 páginaCuadro Sinoptico Enlaces QuimicosGustavo Cc100% (2)
- Actividad 5-Enlace Químico e Interacción MolecularDocumento3 páginasActividad 5-Enlace Químico e Interacción MolecularEduardo Lara100% (1)
- 4° QUIM PD1 PPT Enlace Químico Parte IDocumento10 páginas4° QUIM PD1 PPT Enlace Químico Parte IMARIA EUGENIA MARTINEZ CABEZASAún no hay calificaciones
- Unidad2 Tarea 2 Enlace Quimico y Estructura MolecularDocumento4 páginasUnidad2 Tarea 2 Enlace Quimico y Estructura MolecularBrayan Bareño FerroAún no hay calificaciones
- ECQG - Ejercicios Lewis PDFDocumento20 páginasECQG - Ejercicios Lewis PDFHector Soley100% (1)
- Reglas Del Octeto y Dueto.Documento8 páginasReglas Del Octeto y Dueto.EUGENIO VIDAL LOPEZ LOPEZAún no hay calificaciones
- Q Sem5Documento6 páginasQ Sem5Nils Quiña PomaAún no hay calificaciones
- Ejerciciospropuestos de Enlaces QuimicosDocumento4 páginasEjerciciospropuestos de Enlaces QuimicosLeonardo Condori Mamani0% (1)
- Estructuras de LewisDocumento98 páginasEstructuras de LewisVitore MorleoneAún no hay calificaciones
- Química - Verano Escolar - 4Documento4 páginasQuímica - Verano Escolar - 4jesus.alfabaAún no hay calificaciones
- Quimica Grado Noveno Arturo PizarroDocumento10 páginasQuimica Grado Noveno Arturo PizarroEnery MLAún no hay calificaciones
- Enlaces Químicos y Fuerzas IntermolecularesDocumento13 páginasEnlaces Químicos y Fuerzas IntermolecularesJulieta VillanuevaAún no hay calificaciones
- Clase 5 TC El Enlace Químico 2016Documento25 páginasClase 5 TC El Enlace Químico 2016Mica Colipan EduardsAún no hay calificaciones
- Regla Del OctetoDocumento5 páginasRegla Del OctetoFernando Varela100% (1)
- Jeferson Anchatuña Quimica CuestionarioDocumento8 páginasJeferson Anchatuña Quimica CuestionarioJeferson AnchatuñaAún no hay calificaciones
- Exposición de MoléculasDocumento1 páginaExposición de MoléculasEDWINAún no hay calificaciones
- Reporte de ElectronegatividadDocumento17 páginasReporte de ElectronegatividadOswaldoAún no hay calificaciones
- Problemas Captitulo 9-ChangDocumento10 páginasProblemas Captitulo 9-ChangRocio Mercedes GonzálezAún no hay calificaciones
- Práctica Inorgánica Basicidad de OxoanionesDocumento3 páginasPráctica Inorgánica Basicidad de Oxoanionesaker12Aún no hay calificaciones
- Reporte #5 Enlaces QuímicosDocumento5 páginasReporte #5 Enlaces QuímicosHector David Hernandez AceitunoAún no hay calificaciones
- Práctica No 5 Geometría MolecularDocumento25 páginasPráctica No 5 Geometría MolecularDuvan Antonio Ramirez LottaAún no hay calificaciones
- Respuestas 2Documento3 páginasRespuestas 2JonattanSmithGonzalezGuerra100% (1)
- Química: La Ciencia CentralDocumento16 páginasQuímica: La Ciencia CentralGaby Castillo40% (10)
- Lic EnfermeriaDocumento18 páginasLic EnfermeriaSolange ZavalaAún no hay calificaciones
- Guia QUIMICA 8 III Periodo TIPOS DE ENLACES NURY PDFDocumento11 páginasGuia QUIMICA 8 III Periodo TIPOS DE ENLACES NURY PDFAndrea RomeroAún no hay calificaciones
- Sistema PeriódicoDocumento6 páginasSistema PeriódicoNOELIA RODRIGUEZ BAEZAAún no hay calificaciones
- Capitulo 06-Enlace Quimico-2013Documento29 páginasCapitulo 06-Enlace Quimico-2013Julio OriaAún no hay calificaciones
- Muoz GmezMaraJos FsicayQumica TFMDocumento90 páginasMuoz GmezMaraJos FsicayQumica TFMleon androAún no hay calificaciones
- Enlace QuimicoDocumento2 páginasEnlace QuimicoMarcela Aguilar CampoAún no hay calificaciones
- Seminario DomingoDocumento8 páginasSeminario DomingoJOSE ALEXANDRO LOPEZ MAMANIAún no hay calificaciones
- Conclion de QuimicaDocumento3 páginasConclion de QuimicaSandra BetancourtAún no hay calificaciones
- Enlaces QuimicosDocumento18 páginasEnlaces Quimicoselrasta505Aún no hay calificaciones