Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Mapa Mental
Cargado por
KAREN YAJAIDA AVALOS MAMANIDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Mapa Mental
Cargado por
KAREN YAJAIDA AVALOS MAMANICopyright:
Formatos disponibles
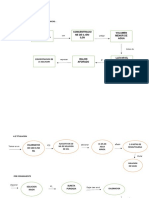
Nivel de pH inferior a 7
Reaccionan con algunos metales
Son conductores de corriente eléctrica
INTEGRANTES: Poseen un sabor agrio (limón, por ejemplos)
AVALOS MAMANI KAREN YAJAIDA
ESCALANTE TISOC DIEGO ESFRAIN Cambian el color del papel tornasol de
A umenta la QUISPE PAREDES VANNERY BIBIANA azul a rojo
concentracion de H en CONDEMAITA ESCOBEDO MAXS ANTONY
una solucion acuosa
PALOMINO HURTADO JHORDAN JEANPOL Pueden destruir tejidos orgánicos
ÁCIDO
Reaccionan con bases produciendo agua
Aumenta la
y sal
concentracion de OH
en solucion acuosa PUNTOS
IMPORTANTES
En una solucion Nivel de pH superior a 7
acido base o reaccion
neutralizacion No reaccionan con los metales
En disolución, conducen corriente eléctrica
CARACTERÍSTICAS BASE Poseen sabor amargo (jabonoso,como el
¿Iones hidrógeno cloro o lejía)
o iones hidronio?
|
Los ácidos de Arrhenius Teoria de Cambian el papel tornasol de rojo a azul
Arrhenius
En disolución, son deslizantes al tacto
La teoría de ácidos y
Reaccionan con los ácidos, produciendo
bases quien sugirió
clasificar ciertos
agua y sal
- Ác. clorhídrico: HCl compuestos como ácidos o
Ejemplos de Ácidos de bases de acuerdo con el tipo
- Ác. nítrico:HNO3 de iones que se forman
Arrhenius cuando el compuesto
- Ác. sulfúrico:H2SO4 añade el agua
Las bases de T EOR IA S D E
Arrhenius A CID OS Y Los ácidos más comunes son
B A S ES HCl, H2SO4 y HNO3
- Hidróxido potásico: KOH Ejemplos de Bases
- Hidróxido de sodio: NaOH ) de Arrhenius
- Hidróxido de Calcio:Ca(OH)2
- Hidróxido de Aluminio:Al(OH)3 Sustancia
BRONSTED ÁCIDO capaz de
LOWRY donar protones
H+
Los ácidos y las bases débiles
solo se ionizan parcialmente. La Es aquella que
base conjugada de un ácido de puede comportarse
Brønsted-Lowry es la especie SUSTANCIA como un ácido o una
que se forma después de que ANFÓTERA base dependiendo de la
un ácido donó un protón. sustancia con la que se
una
Se le llama Sustancia
Capaz de LEWIS
ELECTRÓFILO Por lo tamto
ACEPTAR un par de BASE capaz de
Sustancia que es Ácido
ELECTRONES. aceptar
protones H+
ejemplos de ácidos de Lewis incluyen Capaz de
Lasbases más comunes sonNaOH
especies deficientes en electrones, tales DONAR un par de
como H +, M +, M 2+, BH 3, BF 3, AlCl 3 etc yNH3.
ELECTRONES.
Sustancia que es
Base
Por lo tamto
Las bases de Lewis pueden ser:
amina, éter u otras especies que Se le llama
tengan electrones de pares
NUCLEÓFILO
solitarios para donar.
También podría gustarte
- Is 06Documento1 páginaIs 06Hugo Nelson Aquino BautistaAún no hay calificaciones
- Diseño ApDocumento1 páginaDiseño ApJavier Ignacio Diaz OrellanaAún no hay calificaciones
- Notas:: Deslinde Poniente 10,95 Mts Deslinde Poniente 10,95 MtsDocumento1 páginaNotas:: Deslinde Poniente 10,95 Mts Deslinde Poniente 10,95 MtsdjchachixAún no hay calificaciones
- Proximo PlantillaDocumento3 páginasProximo PlantillaBlack LithiumAún no hay calificaciones
- Ie Nba 05 PDFDocumento1 páginaIe Nba 05 PDFEdwin Luis SalazarAún no hay calificaciones
- Tipos de Soluciones QuimicasDocumento1 páginaTipos de Soluciones QuimicasAlexander Kaabi Alarcon FraileAún no hay calificaciones
- Cruci Materia en BlancoDocumento1 páginaCruci Materia en BlancoALEX CASTILLO PONCIANOAún no hay calificaciones
- Oriflame PDFDocumento69 páginasOriflame PDFDeyse V Cueva SifuentesAún no hay calificaciones
- Seccion Chimenea: Gestion Integral de Los Servicios de Residuos SolidosDocumento1 páginaSeccion Chimenea: Gestion Integral de Los Servicios de Residuos SolidosMashiell AlvarezAún no hay calificaciones
- Folleto Vinos de JerezDocumento2 páginasFolleto Vinos de JerezFrancisco Javier OrellanaAún no hay calificaciones
- Registro 2° IibDocumento2 páginasRegistro 2° IibLeonidas Calderón FernándezAún no hay calificaciones
- NIVELES DE ESCRITURA 1RO 2023 UnoDocumento1 páginaNIVELES DE ESCRITURA 1RO 2023 UnozeferinoAún no hay calificaciones
- Plano Municipal 2Documento1 páginaPlano Municipal 2ROMINAAún no hay calificaciones
- Manejo de LíquidosDocumento1 páginaManejo de LíquidosDiana Guzmán GonzálezAún no hay calificaciones
- Registro 5°iibDocumento2 páginasRegistro 5°iibLeonidas Calderón FernándezAún no hay calificaciones
- Planta y Perfil huaycoloro-PPP-04Documento1 páginaPlanta y Perfil huaycoloro-PPP-04Marco CotrinaAún no hay calificaciones
- Matriz LeopoldDocumento1 páginaMatriz LeopoldRenzo Acosta SotoAún no hay calificaciones
- Presentacion Brainstorming Lluvia de Ideas Doodle BlancoDocumento8 páginasPresentacion Brainstorming Lluvia de Ideas Doodle BlancoPaula Alejandra Sanchez ReyesAún no hay calificaciones
- Registro 4° IibDocumento1 páginaRegistro 4° IibLeonidas Calderón FernándezAún no hay calificaciones
- Casa AronesDocumento17 páginasCasa AronesShianny ArcigaAún no hay calificaciones
- Wuolah Free Tema 2 Equilibrio Acido BaseDocumento4 páginasWuolah Free Tema 2 Equilibrio Acido BaseEduardo CerezoAún no hay calificaciones
- 23-01-23-Ant-Infinitoopen - Water Park - Cortes Bahamas Rio LentoDocumento1 página23-01-23-Ant-Infinitoopen - Water Park - Cortes Bahamas Rio LentoNicolas FernandezAún no hay calificaciones
- Registro 3° IibDocumento2 páginasRegistro 3° IibLeonidas Calderón FernándezAún no hay calificaciones
- Is 05Documento1 páginaIs 05Hugo Nelson Aquino BautistaAún no hay calificaciones
- Planta Bomba Oro Negro ESC 1:50: BosqueDocumento1 páginaPlanta Bomba Oro Negro ESC 1:50: BosqueArq. Lednel Arturo Garcia AldereteAún no hay calificaciones
- Plano de Planta Puesto 04Documento1 páginaPlano de Planta Puesto 04Rafael AndradeAún no hay calificaciones
- MAPA CONCEPTUAL - Cesar Macias EscamillaDocumento1 páginaMAPA CONCEPTUAL - Cesar Macias EscamillaCesar MaciasAún no hay calificaciones
- Instrument OsDocumento14 páginasInstrument Osjerzy hatold romero riosAún no hay calificaciones
- Aceites Escenciales 447038 Downloadable 3814423Documento3 páginasAceites Escenciales 447038 Downloadable 3814423Zulma OcamposAún no hay calificaciones
- Plano de Planta FuerzaDocumento1 páginaPlano de Planta FuerzaMarcos GonzalesAún no hay calificaciones
- Planta Biblioteca 01Documento1 páginaPlanta Biblioteca 01Omar Flores HernándezAún no hay calificaciones
- Recetas Estandar Liquida Estricta - AmpliaDocumento8 páginasRecetas Estandar Liquida Estricta - AmpliaJahel SilvaAún no hay calificaciones
- Recetas EstandarDocumento6 páginasRecetas EstandarJahel SilvaAún no hay calificaciones
- PLANO DE ADICION MORADA SANTA CORREG - Bak.dwg 3.00 pm-ESTRUCTURADocumento1 páginaPLANO DE ADICION MORADA SANTA CORREG - Bak.dwg 3.00 pm-ESTRUCTURAapolonioAún no hay calificaciones
- El Aranjuez Zonificación & Lotificación TotalDocumento1 páginaEl Aranjuez Zonificación & Lotificación TotalRuben Ricardez CarrionAún no hay calificaciones
- Etiqueta y Empaque AltomayoDocumento3 páginasEtiqueta y Empaque AltomayoCrystalAún no hay calificaciones
- Calculo Solucion Nutritiva - UNI DE GUADALAJARADocumento16 páginasCalculo Solucion Nutritiva - UNI DE GUADALAJARAjaeles albAún no hay calificaciones
- 7-8.1 ArmerDocumento3 páginas7-8.1 ArmerMERARI ESTUDILLO RUEDAAún no hay calificaciones
- Agua ReplanteadoDocumento1 páginaAgua ReplanteadoHuber MartinezAún no hay calificaciones
- Is 01Documento1 páginaIs 01Hugo Nelson Aquino BautistaAún no hay calificaciones
- LitoestratigrafiaDocumento1 páginaLitoestratigrafiaJose RamosAún no hay calificaciones
- Mapa Mental AcentuacionDocumento1 páginaMapa Mental AcentuacionMaria Córdoba Zuñiga100% (1)
- MINAM Registro EO-RS Autorizadas - Actualizada 04-09-2023Documento64 páginasMINAM Registro EO-RS Autorizadas - Actualizada 04-09-2023Jorge F Silva GAún no hay calificaciones
- Quimica Tarea - 5Documento5 páginasQuimica Tarea - 5Ale GeoAún no hay calificaciones
- JOSUE IA6 PLANTA ARQUITECTONICA-ModeloDocumento1 páginaJOSUE IA6 PLANTA ARQUITECTONICA-ModeloGuadalupe DuránAún no hay calificaciones
- 8vo Raz Verbal 2023 II Bim (2) .Rv.2023Documento4 páginas8vo Raz Verbal 2023 II Bim (2) .Rv.2023dylan casas ortizAún no hay calificaciones
- La Homeostasis PDFDocumento1 páginaLa Homeostasis PDFjuansebastianAún no hay calificaciones
- Diagrama de Flujo-DisolucionesDocumento2 páginasDiagrama de Flujo-DisolucionesLisbeth Camila MosqueraAún no hay calificaciones
- Is 03Documento1 páginaIs 03nelida barrera vargasAún no hay calificaciones
- Excipientes Algunos Disolventes ESQUEMADocumento1 páginaExcipientes Algunos Disolventes ESQUEMAJennifer C.SAún no hay calificaciones
- Croquis Muro Contension Sf-ModelDocumento1 páginaCroquis Muro Contension Sf-ModelJL LunaAún no hay calificaciones
- Quimica Modulo 3Documento3 páginasQuimica Modulo 3Noelia DiazAún no hay calificaciones
- Ablandar y Desionizar de Agua Dura Por Medio de Resinas de Intercambio IónicoDocumento1 páginaAblandar y Desionizar de Agua Dura Por Medio de Resinas de Intercambio IónicoalejandraAún no hay calificaciones
- Registro Auxiliar Teca2020 4to VigesimalDocumento10 páginasRegistro Auxiliar Teca2020 4to VigesimalJuanaely LlutariAún no hay calificaciones
- Planilla Construccion Civil 2019 ActualizadosDocumento43 páginasPlanilla Construccion Civil 2019 ActualizadosMilagros PalominoAún no hay calificaciones
- Layout WMEOTO EDocumento1 páginaLayout WMEOTO EÁlex CalderónAún no hay calificaciones
- Hiatos y Diptongos PDFDocumento2 páginasHiatos y Diptongos PDFhelengomgoAún no hay calificaciones
- BOCATTOS REST-Layout Requerimiento SanitarioDocumento1 páginaBOCATTOS REST-Layout Requerimiento SanitarioCosta PichilemuAún no hay calificaciones
- Encuesta SocioeconomicaDocumento11 páginasEncuesta SocioeconomicaLuis FajardoAún no hay calificaciones
- Práctica N. 3 Química Práctica para Ciencias MédicasDocumento14 páginasPráctica N. 3 Química Práctica para Ciencias Médicasoscar restrepoAún no hay calificaciones
- Observaciones de LaboratorioDocumento3 páginasObservaciones de LaboratorioMORALES PAREDES FAVIO ALEJANDROAún no hay calificaciones
- SeminariDocumento12 páginasSeminariDaniel Agramonte Rondoy0% (1)
- Ácidos y Bases de Arrhenius 9°Documento2 páginasÁcidos y Bases de Arrhenius 9°Karen Meneses CorzoAún no hay calificaciones
- Trabajo - de - Quimica - Analitica 02 AQUIJEDocumento13 páginasTrabajo - de - Quimica - Analitica 02 AQUIJEJohann Albert Arroyo RojasAún no hay calificaciones
- Práctica Dos QGIIDocumento1 páginaPráctica Dos QGIIAlexis RuizAún no hay calificaciones
- Preparacion de DisolucionesDocumento9 páginasPreparacion de DisolucionesFernanda MartinezAún no hay calificaciones
- METALOIDESDocumento10 páginasMETALOIDESMiguel DelgadoAún no hay calificaciones
- Informe Laboratorio de Química para MineríaDocumento15 páginasInforme Laboratorio de Química para MineríaLeslie Gabriela García FernándezAún no hay calificaciones
- Ejercicios Tema 3. EstequiometriaDocumento4 páginasEjercicios Tema 3. EstequiometriaKarla GAún no hay calificaciones
- S01.s1 - Ejercicios para Resolver-Reacciones RedoxDocumento2 páginasS01.s1 - Ejercicios para Resolver-Reacciones Redoxriquy82456Aún no hay calificaciones
- Actividad 1 de Ecuaciones y RX Quimicas RepasoDocumento2 páginasActividad 1 de Ecuaciones y RX Quimicas Repasojuliana beltranAún no hay calificaciones
- Unidades de ConcentraciónDocumento13 páginasUnidades de Concentraciónfelipe herrera martinezAún no hay calificaciones
- Guias Practicas de Lab Oratorio 2011Documento26 páginasGuias Practicas de Lab Oratorio 2011Lyre ReinaAún no hay calificaciones
- REPASO EXAMEN FINAL CEPRE-UNI 2012-II (Ordenado)Documento8 páginasREPASO EXAMEN FINAL CEPRE-UNI 2012-II (Ordenado)Marco Cisneros PachecoAún no hay calificaciones
- Analisis de Cationes Reporte de LaboratorioDocumento8 páginasAnalisis de Cationes Reporte de LaboratorioJuan Pablo Andres HernándezAún no hay calificaciones
- Analisis Quimico IndustrialDocumento76 páginasAnalisis Quimico IndustrialeAún no hay calificaciones
- BufferDocumento25 páginasBufferTHAIS DANUSKA ROSALES REVOLLEDOAún no hay calificaciones
- Medida de PHDocumento22 páginasMedida de PHCuentaAún no hay calificaciones
- Cta4 U1 Sesión3 AguaDocumento5 páginasCta4 U1 Sesión3 AguaShirley PinedoAún no hay calificaciones
- Prac 2 BQ1 PRACTICA DE LABORATORIO #02 DETERMINACION DE PHDocumento21 páginasPrac 2 BQ1 PRACTICA DE LABORATORIO #02 DETERMINACION DE PHEsteban Lizarazo CastroAún no hay calificaciones
- Copia Traducida de D2488.18350 ASTM DESCRIPCION VISUAL SUELOSDocumento13 páginasCopia Traducida de D2488.18350 ASTM DESCRIPCION VISUAL SUELOSDaniel LópezAún no hay calificaciones
- Densidades y ConcentracionDocumento2 páginasDensidades y ConcentracionAURELIO BAZAN ROJASAún no hay calificaciones
- Problemas Propuestos de Acidos y BasesDocumento2 páginasProblemas Propuestos de Acidos y BasesWillington0% (2)
- Saponificación de Trimiristina PDFDocumento2 páginasSaponificación de Trimiristina PDFDaniel OlmosAún no hay calificaciones
- Ce83 Taller 4 Química ResueltoDocumento6 páginasCe83 Taller 4 Química ResueltoAnderson PonceAún no hay calificaciones
- Declaración de Impacto Ambiental de La Planta de Beneficio La PorfiaDocumento198 páginasDeclaración de Impacto Ambiental de La Planta de Beneficio La Porfiaguillermo cuba arteaga100% (1)
- Manual Oper y Mant Filtmaster Espaoljunio19Documento28 páginasManual Oper y Mant Filtmaster Espaoljunio19Jose Leonardo Romo CalocaAún no hay calificaciones
- Cationes de La PlataDocumento6 páginasCationes de La PlataJesus Alonso Madueno MendozaAún no hay calificaciones
- Lab 6. Determinación de Nitratos en Muestras de AguasDocumento4 páginasLab 6. Determinación de Nitratos en Muestras de AguasFernanda OrtizAún no hay calificaciones