Documentos de Académico
Documentos de Profesional
Documentos de Cultura
GARCIAMCyDB (QI) P4EQ3
Cargado por
Saul GarciaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
GARCIAMCyDB (QI) P4EQ3
Cargado por
Saul GarciaCopyright:
Formatos disponibles
REACCION DE LA
NATURALEZA DE LOS
REACTIVOS VELOCIDAD Y TIEMPO VELOCIDAD MEDIA
REACCIONES
Definición relación Ecuación de Arrhemus
Estado de agregación de reactivos Diferencia Ecuación
Definición
La relación esta entre Esta ecuación nos permite 𝑎𝐴 + 𝑏𝐵 → 𝑐𝐶 + 𝑑𝐷
El estado de agregación La velocidad de
Los cambios Físicos mayor este la comprobar la dependencia de
es en el que se encuentra reacción es la variación
pueden producirse a concentración o la constante de la velocidad
diferentes velocidades,
la materia y depende de de la concentración de Es la velocidad de un
sus características físicas superficie activa el cinética de una reacción Definición
como las reacciones los reactivos por la química con respecto a la
cuerpo que se mueve
y químicas. El estado de tiempo de reacción variación de una unidad entre dos puntos P1 y
Químicas tienen temperatura a la que se lleva Definición
agregación que presente es menor y si la de tiempo y esta P2 como el coeficiente EN DONDE: Es la representación de la
numerosas a cabo la reacción.
mayor velocidad de concentración activa depende entre el vector velocidad de reacción en
aplicaciones, la También nos permite
reacción es el gaseoso, es menor el tiempo fundamentalmente por Vm=Vector de función del reactivo
velocidad con la que relacionar el tiempo de desplazamiento y el
seguido de las de reacción será la naturaleza de los velocidad media
transcurren es muy reacción a diferentes intervalo de tiempo en
disoluciones y por ultimo mayor. reactivos y su
importante y esta temperaturas. el que transcurre el Ecuación Representación de
los sólidos. temperatura. T=Tiempo empleado
constituye la cinética desplazamiento. velocidad de reacción para
Química. El tiempo en la reacción
un producto se anota como
es lo que tardan los RV=Vector
t=tiempo.
Adición de catalizadores reactivos en desplazamiento
transformarse en EN DONDE:
productos r=Vectores de posición
A=Constante llamada factor .
Concentración de frecuencia t1 y t2=tiempo inicial y
El catalizador aumenta la E’=Energía de activación final
velocidad de la reacción Unidades R=Constante de los gases
química al reducir la ideales
energía del estado de T=Temperatura absoluta
A mayor concentración CATALIZADOR
transición y así poder
en los productos el
disminuir la energía de
equilibrio tiende a
activación y/o cambiando el
desplazarse hacia los
mecanismo de reacción. Concepto
reactivos para Las unidades que se presentan
compensar la reacción en la velocidad y el tiempo para
(el equilibrio se va hacia las reacciones químicas son: APLICACIÓN EN LA INDUSTRIA
la izquierda). A mayor
concentración en los (𝐶𝑎𝑛𝑡𝑖𝑑𝑎𝑑 𝑑𝑒 𝑚𝑎𝑡𝑒𝑟𝑖𝑎)(𝑣𝑜𝑙𝑢𝑚𝑒𝑛) En la práctica se utilizó
reactivos, el equilibrio 𝑡𝑖𝑒𝑚𝑝𝑜
como catalizador el
tiende a Desplazarse Sulfato de manganeso
hacia los productos (el (𝑚𝑜𝑙)(𝐿) Concepto ((𝐻2 𝑆𝑂𝐴 ).
equilibrio se va hacia la 𝑆
derecha). Como ejemplos:
Para la concentración Temperatura En la industria
utilizamos la Molaridad o farmacéutica es muy *Derivados del flúor,
La Normal. común, ya que nos
𝑛 que se encarga de
𝑀= ayuda a determinar la acelerar la
𝑉
𝑒𝑞 velocidad de reacción descomposición del
𝑁= La temperatura afecta a la
𝐿 velocidad de reacción, Una en el organismo, ozono
mayor temperatura implica cuando ya está cocido *Titanio, mezclado con
una mayor energía cinética un elemento para Aluminio es
de las moléculas, por lo que consumo. considerado un
aumentara la probabilidad proceso de
de que las colisiones sean polimerización de
productivas Ziegier-Nalta para
acelerar la obtención
de polietileno de alta
densidad.
BIBLIOGRAFIA O CIBERGRAFIA
1.- Mira, E. R. (s. f.). Ecuación de Arrhenius (I) | Cinética química.
https://proyectodescartes.org/ingenieria/materiales_didacticos/cinetica_quimica_descartes-JS/ecuacin_de_arrhenius_i.html
2.- https://www.uv.es/tunon/Master_Ing_Bio/tema_6.pdf
3.- Cinemática. Movimiento rectilíneo. (s. f.). http://www.sc.ehu.es/sbweb/fisica3/cinematica/rectilineo/rectilineo_1.html
UNIDAD PROFESIONAL INTERDISCIPLINARIA DE INGENIERIA Y CIENCIAS SOCIALESY ADMINISTRATIVAS
MATERIA: LABORATORIO DE QUIMICA INDUSTRIAL SECUENCIA: 2IM37 EQUIPO: 3
ALUMNO: GARCIA VAZQUEZ SAUL ALEJANDRO HORARIO: LUNES DE 8:00-10:00 AM
NUM.DE PRACTICA: 04 TITULO DE LA PRACTICA: CINETICA QUIMICA
FECHA DE ENTREGA: LUNES 28 DE NOVIEMBRE DEL 2022
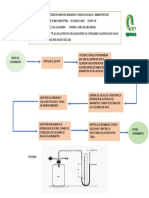
Adicionar al vaso
NO.1, una tableta
INICIO DEL Numerar tres vasos Agregar 50 mL de
efervescente entera y
EXPERIMENTO de precipitado de agua destilada en cada
Anotar en la tabla
NO.1 100 mL cada uno. uno de ellos.
NO,1, el tiempo que
tarda en disolverse.
.
. Triturar la tercera Fraccionar otra
tableta. Adicionar tableta en dos
FIN DEL
el polvo al vaso partes, Agregar los
EXPERIMENTO
NO.1 No.3 y Registrar el pedazos al mismo
tiempo que tarda vaso NO.2 y tome el
en disolverse. tiempo que tardan
en disolverse.
Colocar un vaso Medir con una
INICIO DEL
de precipitado probeta, 10 mL de la
EXPERIMENTO Agregar este
sobre una hoja solución de yodato
NO.2 volumen de solución
de papel blanco. de potasio (KIO3) de
la concentración que de KIO3 al vaso..
le haya sido
asignada.
Registrar en la tabla
NO.2 el tiempo que Enjuagar con agua
tarda en aparecer Adicionar la solución
de NaHSO3 al vaso , destilada la probeta
una coloración azul, que se utilizo
lo cual indica la simultáneamente
Poner en marcha el anteriormente y
formación de yedo. . Medir 10 mL de Medir con una pipeta,
cronometro y Agitar
continuamente. solución de bisulfuro 1 mL de solución de
de sodio (NaHSO3 1% de almidón y
0.01 M). Adicionar al vaso.
.
FIN DEL
EXPERIMENTO
NO.2
Adicionar el tubo NO.1, 2
mL de solución 0.0025 M de
Utilizar el vaso de 500 KMnO4 Y 1 mL de solución
mL como baño Maria, 0.25 M de H2SO4.
INICIO DEL
con 400 mL de agua de Numerar
EXPERIMENTO
la llave a la temperatura dos tubos
NO.3
que le haya sido de ensayo.. .
asignada para calcular
el experimento.. .
Verter rápidamente pero Introducir los dos
con precaución, el acido tubos al baño Maria Agregar en el tubo
por espacio de tres NO.2, 2.9 mL de
oxálico en el tubo NO,1 que
minutos. . solución de 0.0025 M
contiene la solución de
de C2H2O4..
permanganato de potasio. Al
mismo tiempo Poner en
marcha el cronometro.
Dejar el tubo con la mezcla
de reacción dentro del
Anotar en la tabla FIN DEL
baño y Agitar su contenido
NO.3 el tiempo que EXPERIMENTO
con la varilla de vidrio hasta .
que la coloración violeta tarda en efectuarse la no.3
desaparezca. reacción. .
. INICIO DEL
. EXPERIMENTO
NO.4
Repetir el
procedimiento
Anotar en la tabla
Agitar con anterior a 30´C y una
FIN DEL NO.4 el tiempo
la varilla. vez preparada la
EXPERIMENTO que tarda en
mezcla de reacción,
NO.4 desaparecer la
Agregar cinco gotas
coloración.
de solución 0.045 M
de sulfato de
manganeso (MnSO4).
También podría gustarte
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Tarea JorgeDocumento1 páginaTarea JorgeJonathan HernándezAún no hay calificaciones
- Fisico Quimica InfografiasDocumento2 páginasFisico Quimica InfografiasMA JhojanAún no hay calificaciones
- Cinetica Quimica-Equilibrio Quimico-1 PDFDocumento8 páginasCinetica Quimica-Equilibrio Quimico-1 PDFAlejandrix Bn LOkaAún no hay calificaciones
- Cinética Química y Equilibrio QuímicoDocumento2 páginasCinética Química y Equilibrio QuímicoLaura PeñalozaAún no hay calificaciones
- Cinetica de ReacciónDocumento9 páginasCinetica de ReacciónFiorela ApolinarioAún no hay calificaciones
- Semana 08. Cinetica Química, Electroquímica, TermoquímicaDocumento4 páginasSemana 08. Cinetica Química, Electroquímica, TermoquímicaGabrielita RengoAún no hay calificaciones
- Mapa Conceptual Practica 1Documento1 páginaMapa Conceptual Practica 1Saul GarciaAún no hay calificaciones
- Mapa MentalDocumento1 páginaMapa MentaljaqueAún no hay calificaciones
- Ley de Acción de MasasDocumento3 páginasLey de Acción de MasasAlvaro De La Roca GutarraAún no hay calificaciones
- Velocidad de Las Reacciones Quimicas y Teoria de Las ColisionesDocumento2 páginasVelocidad de Las Reacciones Quimicas y Teoria de Las ColisionessabrinaAún no hay calificaciones
- Mapa Mental Cinetica QuimicaDocumento1 páginaMapa Mental Cinetica QuimicaALVARO HENRRY CUQUI GOMEZ100% (1)
- Velocidad de ReaccionDocumento1 páginaVelocidad de ReaccionDiego LoopAún no hay calificaciones
- BDM Con Reaccion Jesus Eduardo 4G PDFDocumento1 páginaBDM Con Reaccion Jesus Eduardo 4G PDFJesus Eduardo Muñoz IsidoroAún no hay calificaciones
- Velocidad de ReaccionDocumento13 páginasVelocidad de Reaccionyohanna ponceAún no hay calificaciones
- Practica 4 Cinética y Reactores HomogéneosDocumento11 páginasPractica 4 Cinética y Reactores HomogéneosAngell Glez SalgadoAún no hay calificaciones
- Triptico Cinética QuímicaDocumento2 páginasTriptico Cinética QuímicaAilyn LjAún no hay calificaciones
- Organizador Gráfico Cinética y Equilibrio Químico Carlos OchoaDocumento1 páginaOrganizador Gráfico Cinética y Equilibrio Químico Carlos OchoaCarlos Ochoa SánchezAún no hay calificaciones
- Informe (Factores Que Afectan La Velocidad de Reaccion)Documento7 páginasInforme (Factores Que Afectan La Velocidad de Reaccion)Andrea PerezAún no hay calificaciones
- Practica 4 Cinética y Reactorés ESIQIEDocumento11 páginasPractica 4 Cinética y Reactorés ESIQIEAngell Glez Salgado100% (1)
- Cinetica QuímicaDocumento1 páginaCinetica QuímicaFernando GuzmanAún no hay calificaciones
- Cinética de La Saponificación de Un EsterDocumento4 páginasCinética de La Saponificación de Un EsterJosé Enrique GamarraAún no hay calificaciones
- Cinetica Quimica: La Cinética QuímicaDocumento1 páginaCinetica Quimica: La Cinética QuímicaJasmin araceli Hernández MeridaAún no hay calificaciones
- Mapa ConceptualDocumento2 páginasMapa ConceptualHeber Enrique Dominguez MayoAún no hay calificaciones
- Marrufo Sánchez Jorge Carlos - Mapa Mental 2 - U2 - QADocumento1 páginaMarrufo Sánchez Jorge Carlos - Mapa Mental 2 - U2 - QAJorge Carlos Marrufo SánchezAún no hay calificaciones
- Cinetica - Quimica-Poster PDFDocumento1 páginaCinetica - Quimica-Poster PDFVictoria Vizcaíno GarcíaAún no hay calificaciones
- Cinética y Equilibrio QuimicoDocumento18 páginasCinética y Equilibrio QuimicoRamos Aguilar Wilbert100% (1)
- Bfiq U3 A2 Algo.Documento5 páginasBfiq U3 A2 Algo.Alexis OlveraAún no hay calificaciones
- Infgrafia de Cinetica QuimicaDocumento1 páginaInfgrafia de Cinetica QuimicaMaju Areli ApazaAún no hay calificaciones
- Cinética Química PDFDocumento30 páginasCinética Química PDFbrenda nuñezAún no hay calificaciones
- P.I. Act.1Documento3 páginasP.I. Act.1Bubu ReyesAún no hay calificaciones
- Mapa MentalDocumento1 páginaMapa MentalYaritza MendozaAún no hay calificaciones
- Factores Que Afectan La Velocidad de ReacciónDocumento2 páginasFactores Que Afectan La Velocidad de ReacciónJulian AcostaAún no hay calificaciones
- Posible Teria Cinetica U2Documento3 páginasPosible Teria Cinetica U2luis antonio pascual lozanoAún no hay calificaciones
- Los Factores Que Modifican e Intervienen La Rapidez de Una ReacciónDocumento2 páginasLos Factores Que Modifican e Intervienen La Rapidez de Una ReacciónCarlos DanielAún no hay calificaciones
- Mapa Conceptual Del TEMA 4.8Documento2 páginasMapa Conceptual Del TEMA 4.8Jesus PereaAún no hay calificaciones
- Resumen qgIIDocumento95 páginasResumen qgIIMarcos Alejandro SaraviaAún no hay calificaciones
- Libro - 2 - U5 - Cinética QuímicaDocumento18 páginasLibro - 2 - U5 - Cinética QuímicaSergio Luis RodriguezAún no hay calificaciones
- Infografía de La Cinética Química y Su Aplicación A La Biologia y BiotecnologiaDocumento2 páginasInfografía de La Cinética Química y Su Aplicación A La Biologia y BiotecnologiarosaAún no hay calificaciones
- Actividad 3 - Cuadro Sinoptico de Los Factores Que Influyen en La Velocidad de Una Reacción QuímicaDocumento6 páginasActividad 3 - Cuadro Sinoptico de Los Factores Que Influyen en La Velocidad de Una Reacción QuímicaJes HernandezAún no hay calificaciones
- Diseño de Reactores HomogeneosDocumento32 páginasDiseño de Reactores HomogeneosGabriel RochaAún no hay calificaciones
- Reactores Quimicos y Su ClasificaciónDocumento7 páginasReactores Quimicos y Su ClasificaciónMarcos PérezAún no hay calificaciones
- Cuadro SinopticoDocumento4 páginasCuadro SinopticoAline liraAún no hay calificaciones
- Ingeniería Bioquímica - 202134 - 916Documento2 páginasIngeniería Bioquímica - 202134 - 916Kelly Johana Caicedo ZamoraAún no hay calificaciones
- Cinética QuímicaDocumento3 páginasCinética QuímicaFrancisca QuintanaAún no hay calificaciones
- Indagación 1. FuerzaDocumento5 páginasIndagación 1. FuerzalilianaleijaaAún no hay calificaciones
- Previo 9Documento1 páginaPrevio 9ZOE DOMINIC CHAVEZ CORDOVAAún no hay calificaciones
- Folleto Cinética QuímicaDocumento2 páginasFolleto Cinética QuímicaLucas Hernández Karla BereniceAún no hay calificaciones
- Cinética QuímicaDocumento1 páginaCinética Químicaambarmendoza2003Aún no hay calificaciones
- Te Dqui 1036 s2 - 2021 EstudiantesDocumento2 páginasTe Dqui 1036 s2 - 2021 EstudiantesJuan Ignacio Almonacid USSAún no hay calificaciones
- Quimica 1Documento8 páginasQuimica 1Luis Ángel Pérez XicotencatlAún no hay calificaciones
- Consigna 4Documento4 páginasConsigna 4api-259248541Aún no hay calificaciones
- Quimica U9Documento3 páginasQuimica U9Valentino MorosiniAún no hay calificaciones
- Quimica U9Documento3 páginasQuimica U9Paul Mijael Perez DiazAún no hay calificaciones
- Clase 1. Cinetica QuímicaDocumento48 páginasClase 1. Cinetica Químicajerc1324Aún no hay calificaciones
- CINETICA QUIMICA. InformeDocumento5 páginasCINETICA QUIMICA. InformeFernanda MartinezAún no hay calificaciones
- Mapa Conceptual - Equilibrio Químico - DANIELA ESTRADA SEVERIANODocumento5 páginasMapa Conceptual - Equilibrio Químico - DANIELA ESTRADA SEVERIANODaniela Estrada Severiano100% (1)
- Pre 7 FerricianuroDocumento5 páginasPre 7 Ferricianuroavril velazquez domoinguezAún no hay calificaciones
- Química - Ciclo Uni 2022 - Semana-08Documento23 páginasQuímica - Ciclo Uni 2022 - Semana-08Ronald FgAún no hay calificaciones
- Tarea 1Documento2 páginasTarea 1Saul GarciaAún no hay calificaciones
- Conceptos Unidad IIDocumento7 páginasConceptos Unidad IISaul GarciaAún no hay calificaciones
- Mapa Practica 3Documento1 páginaMapa Practica 3Saul GarciaAún no hay calificaciones
- Codigo Deontologico de Los Ingenieros IndustrialesDocumento2 páginasCodigo Deontologico de Los Ingenieros IndustrialesSaul GarciaAún no hay calificaciones
- ACTIVIDADnnConceptosnbnnsicosndenprobabilidad 3861f988ce5a82a PDFDocumento12 páginasACTIVIDADnnConceptosnbnnsicosndenprobabilidad 3861f988ce5a82a PDFSaul GarciaAún no hay calificaciones
- Diagrama de Bloques Practica 1Documento1 páginaDiagrama de Bloques Practica 1Saul GarciaAún no hay calificaciones
- CalorimetroDocumento1 páginaCalorimetroSaul GarciaAún no hay calificaciones
- GARCIAMCyDB (QI) P3EQ3Documento2 páginasGARCIAMCyDB (QI) P3EQ3Saul GarciaAún no hay calificaciones
- Diagrama P4Documento1 páginaDiagrama P4Saul GarciaAún no hay calificaciones
- Mapa Conceptual Practica 1Documento1 páginaMapa Conceptual Practica 1Saul GarciaAún no hay calificaciones
- Garciamcydb (Q1) P1eq3 PDFDocumento2 páginasGarciamcydb (Q1) P1eq3 PDFSaul GarciaAún no hay calificaciones
- Diagrama de Bloques Practica 1Documento1 páginaDiagrama de Bloques Practica 1Saul GarciaAún no hay calificaciones
- Equilibrio IonicoDocumento12 páginasEquilibrio IonicoZayetzi Martínez RomeroAún no hay calificaciones
- Análisis de PuestoDocumento3 páginasAnálisis de PuestoSaul GarciaAún no hay calificaciones
- 2.2 Factores Que Influyen en El Comportamiento Del ConsumidorDocumento2 páginas2.2 Factores Que Influyen en El Comportamiento Del ConsumidorSaul GarciaAún no hay calificaciones
- Concepto e ImportanciaDocumento3 páginasConcepto e ImportanciaSaul GarciaAún no hay calificaciones
- Variables Controlables y No ControlablesDocumento3 páginasVariables Controlables y No ControlablesSaul GarciaAún no hay calificaciones
- La Mercadotecnia en Las EmpresasDocumento3 páginasLa Mercadotecnia en Las EmpresasSaul GarciaAún no hay calificaciones
- 2.1 Concepto, Importancia y Tipos de ConsumidoresDocumento3 páginas2.1 Concepto, Importancia y Tipos de ConsumidoresSaul GarciaAún no hay calificaciones
- Unidad 4Documento16 páginasUnidad 4Saul GarciaAún no hay calificaciones
- 2.3 Teorias Del ConsumidorDocumento2 páginas2.3 Teorias Del ConsumidorSaul GarciaAún no hay calificaciones
- 2.4 Proceso en La Decision de CompraDocumento3 páginas2.4 Proceso en La Decision de CompraSaul GarciaAún no hay calificaciones
- Portales de Luz SCKDocumento10 páginasPortales de Luz SCKAngelica Maria Saenz Sotomonte100% (1)
- Laboratorio 4 de Dinámica AplicadaDocumento14 páginasLaboratorio 4 de Dinámica AplicadaEdgardoEnriqueConteAún no hay calificaciones
- Análisis de Datos de Fallas. Curso Tutorial. M 16.DRSMDocumento335 páginasAnálisis de Datos de Fallas. Curso Tutorial. M 16.DRSMLuis Alfonso Vizcaya SebastianiAún no hay calificaciones
- Concepto de SueroterapiaDocumento10 páginasConcepto de SueroterapiaKatherine DubóAún no hay calificaciones
- Module 9 Pillar GridingDocumento4 páginasModule 9 Pillar GridingEdgar A Villegas AAún no hay calificaciones
- Diagrama de Árbol de Decisión - PsicologiaDocumento4 páginasDiagrama de Árbol de Decisión - PsicologiaElizabeth DiazAún no hay calificaciones
- RRCDocumento13 páginasRRCCésar AugustoAún no hay calificaciones
- Tríptico de Medios de CultivoDocumento2 páginasTríptico de Medios de CultivoJKAún no hay calificaciones
- Fracciones Decimales LexDocumento15 páginasFracciones Decimales LexFredy CastilloAún no hay calificaciones
- Movimiento ParabolicoDocumento5 páginasMovimiento ParabolicoDafne Lázaro AquinoAún no hay calificaciones
- Evaluación Porcentajes OficialDocumento4 páginasEvaluación Porcentajes OficialPamela Katherine Palma CastroAún no hay calificaciones
- Latitud y LongitudDocumento7 páginasLatitud y LongitudNorma Melanny Velasquez VizcarraAún no hay calificaciones
- 00 Mi A Medologia de Estudio RVGDocumento45 páginas00 Mi A Medologia de Estudio RVGCelia CáceresAún no hay calificaciones
- FT 950-EsDocumento132 páginasFT 950-Es10sd156Aún no hay calificaciones
- Msds Cantesco p101s A Penetrante - Removible Por Solvente EsDocumento9 páginasMsds Cantesco p101s A Penetrante - Removible Por Solvente EsAngel LR0% (1)
- Elaboracion de Vino A Partir de Uva IsabellaDocumento19 páginasElaboracion de Vino A Partir de Uva Isabellapitustereo100% (1)
- AutoCAD 2D Referencias ExternasDocumento6 páginasAutoCAD 2D Referencias ExternasMaría BadilloAún no hay calificaciones
- Separata Ie 2010 1era ParteDocumento12 páginasSeparata Ie 2010 1era ParteJC VeraAún no hay calificaciones
- Tercer Examen de FísicaDocumento9 páginasTercer Examen de FísicaDayana ArqueAún no hay calificaciones
- Antología Del Curso de Matemáticas IDocumento50 páginasAntología Del Curso de Matemáticas IMarcos Efraín López OrtizAún no hay calificaciones
- 06-TEST DEL PARCIAL N°2 INFORMÁTICA LegalDocumento15 páginas06-TEST DEL PARCIAL N°2 INFORMÁTICA Legallopezvictor01100% (1)
- Arranque de MotoresDocumento25 páginasArranque de Motoresjorge nuñezAún no hay calificaciones
- Torres de EnfriamientoDocumento7 páginasTorres de EnfriamientoMaaryloveBlaasAún no hay calificaciones
- Tipos de Marcos Resistentes OMF, IMF, SMFDocumento22 páginasTipos de Marcos Resistentes OMF, IMF, SMFJose García Herrero100% (4)
- Diapositivas MetodosDocumento85 páginasDiapositivas MetodosEfren Jose Carrillo MorgadoAún no hay calificaciones
- PCM, DPCM, DM, AdmDocumento2 páginasPCM, DPCM, DM, AdmDavidAún no hay calificaciones
- Diodos Termoiónicos y de Estado GaseosoDocumento4 páginasDiodos Termoiónicos y de Estado Gaseosofelix danielAún no hay calificaciones
- T. Practico N°01 NatacionDocumento5 páginasT. Practico N°01 NatacionDadi DSAún no hay calificaciones
- Proyecciones-Financieras 1Documento28 páginasProyecciones-Financieras 1Jose Luis DelgadoAún no hay calificaciones
- 2 DoDocumento4 páginas2 DoCamila Nelida BernabeAún no hay calificaciones
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (201)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Proyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadDe EverandProyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadCalificación: 5 de 5 estrellas5/5 (1)
- La causa raiz de los accidentes: Historias de accidentes en la industriaDe EverandLa causa raiz de los accidentes: Historias de accidentes en la industriaCalificación: 5 de 5 estrellas5/5 (1)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Manual técnico para la interpretación de análisis de suelos y fertilización de cultivosDe EverandManual técnico para la interpretación de análisis de suelos y fertilización de cultivosCalificación: 4 de 5 estrellas4/5 (1)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- Guía de cálculo y diseño de conductos para ventilación y climatizaciónDe EverandGuía de cálculo y diseño de conductos para ventilación y climatizaciónCalificación: 5 de 5 estrellas5/5 (1)
- La vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizDe EverandLa vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizCalificación: 5 de 5 estrellas5/5 (7)
- Cardiología y enfermedades cardiovascularesDe EverandCardiología y enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)