Documentos de Académico
Documentos de Profesional
Documentos de Cultura
El Cambio de Energía Libre de Una Reacción Determina Si Puede Ocurrir 18
Cargado por
hachiko_japonTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
El Cambio de Energía Libre de Una Reacción Determina Si Puede Ocurrir 18
Cargado por
hachiko_japonCopyright:
Formatos disponibles
El cambio de energa libre de una reaccin determina si puede ocurrir 18
Although enzymes speed up energetically favorable reactions, they cannot force energetically unfavorable reactions to occur. Aunque las enzimas aceleran las reacciones favorables energticamente, no puede obligar a las reacciones desfavorables energa que se produzca. In terms of a water analogy, enzymes by themselves cannot make water run uphill. En trminos de una analoga del agua, las enzimas por s solas no pueden hacer correr el agua hacia arriba. Cells, however, must do just that in order to grow and divide; they must build highly ordered and energy-rich molecules from small and simple ones. Las clulas, sin embargo, debe hacer exactamente eso con el fin de crecer y dividirse, sino que debe construir muy ordenado y rico en molculas de energa de los pequeos y simples. We have seen that, in a general way, this is done through enzymes that directly couple energetically favorable reactions, which consume energy (derived ultimately from the sun) and produce heat, to energetically unfavorable reactions, which produce biological order. Hemos visto que, de una manera general, esto se hace a travs de las enzimas que directamente par enrgicamente las reacciones favorables, que consumen energa (derivada en ltima instancia del sol) y producir calor, a las reacciones desfavorables energticamente, que producen orden biolgico. Let us examine in greater detail how such coupling is achieved. Vamos a examinar con mayor detalle cmo se alcanza ese acoplamiento. First, we must consider more carefully the term "energetically favorable," which we have so far used loosely without giving it a definition. En primer lugar, debemos considerar ms cuidadosamente el trmino "energticamente favorable", que hasta ahora hemos utilizado libremente sin darle una definicin. As explained earlier, a chemical reaction can proceed spontaneously only if it results in a net increase in the disorder of the universe. Como se explic anteriormente, una reaccin qumica puede proceder espontneamente slo si resulta en un aumento neto en el desorden del universo. Disorder increases when useful energy (energy that could be harnessed to do work) is dissipated as heat; and the criterion for an increase of disorder can be expressed conveniently in terms of a quantity called the free energy, G . Trastorno aumenta cuando la energa til (energa que se podra aprovechar para hacer el trabajo) se disipa en forma de calor, y el criterio de un aumento del desorden puede expresarse convenientemente en trminos de una cantidad llamada la energa libre, G. This is defined in such a way that changes in its value, denoted by delta- G , measure the amount of disorder created in the universe when a reaction takes place. Energetically favorable reactions , by definition, are those that release a large quantity of free energy, or, in other words, have a large negative delta- G and create much disorder. Esto se define de tal manera que los cambios en su valor, denotado por el delta-G, mida la cantidad de desorden creado en el universo cuando tiene lugar una reaccin. Energticamente las reacciones favorables, por definicin, son aquellas que liberan una gran cantidad de libres energa, o, en otras palabras, tienen un gran delta negativo-G y crear mucho desorden. A familiar example on a macroscopic scale would be the "reaction" by which a compressed spring relaxes to an expanded state, releasing
its stored elastic energy as heat to its surroundings. Un ejemplo familiar a escala macroscpica podra ser la "reaccin" por el que se relaja un resorte comprimido a un estado ampliado, liberando su energa elstica almacenada en forma de calor con su entorno. Energetically favorable reactions, with delta- G < O, have a strong tendency to occur spontaneously, although their rate will depend on other factors, such as the availability of specific enzymes (discussed below). reacciones favorables energticamente, con delta-G <O, tienen una fuerte tendencia a ocurrir de manera espontnea, aunque su tasa depender de otros factores, tales como la disponibilidad de enzimas especficas (vase ms adelante). Conversely, energetically unfavorable reactions , with a positive delta- G, such as those in which two amino acids are joined together to form a peptide bond, by themselves create order in the universe and therefore do not occur spontaneously. Por el contrario, las reacciones desfavorables con energa, con un resultado positivo de la delta-G, como aquellos en los que dos aminocidos se unen entre s para formar un enlace peptdico, por s mismas crear orden en el universo y por lo tanto no se producen espontneamente. Reactions of this kind can take place only if they are coupled to a second reaction with a negative delta- G so large that the delta- G of the entire process is negative. Las reacciones de este tipo slo puede tener lugar si se juntan a una segunda reaccin con un negativo delta G negativo tan grande que el delta-G, de todo el proceso. The course of most reactions can be predicted quantitatively. El curso de la mayora de las reacciones se pueden predecir cuantitativamente. A large body of thermodynamic data has been collected that makes it possible to calculate the change in free energy for most of the important metabolic reactions of the cell. Una gran cantidad de datos termodinmicos que se ha recogido que hace que sea posible calcular la variacin de energa libre para la mayora de las reacciones metablicas importantes de la clula. The overall free-energy change for a pathway is then simply the sum of the free-energy changes in each of its component steps. El cambio de energa libre global de una va es simplemente la suma de los cambios de energa libre en cada una de sus etapas que lo componen. Consider, for example, two reactions Consideremos, por ejemplo, dos reacciones X -> YandC -> D X -> YandC -> D where the delta- G values are +1 and -13 kcal/mole, respectively. donde los valores de G-delta son una y -13 kcal / mol, respectivamente. (Recall that a mole is 6 x 10 23 molecules of a substance.) If these two reactions can be coupled together, the delta- G for the coupled reaction will be -12 kcal/mole. (Recordemos que un lunar es de 6 x 10 23 molculas de una sustancia.) Si estas dos reacciones pueden ser acoplados entre s, el delta-G para la reaccin acoplada ser -12 kcal / mol. Thus, the unfavorable reaction X -> Y, which will not occur spontaneously, can be driven by the favorable reaction C -> D, provided that a mechanism exists by which the two reactions can be coupled together. As, la desfavorable reaccin X > Y, que no se produzca de forma espontnea, puede ser impulsada por la favorable reaccin de C -> D, siempre que exista un mecanismo por el cual las dos reacciones pueden ser acoplados entre s. seccin
Prigogine, I.; Stengers, I.Order out of Chaos: Man's New Dialogue with Nature. Prigogine, I., Stengers, I. Orden del Caos: la del hombre nuevo dilogo con la naturaleza. New York: Bantam Books, 1984. Nueva York: Bantam Books, 1984.
References Referencias
Eisenberg, D.; Crothers, D.Physical Chemistry with Applications to the Life Sciences. Eisenberg, D.; Crothers, D. Qumica Fsica con aplicaciones a las ciencias de la vida. Menlo Park, CA: BenjaminCummings, 1979. Menlo Park, CA: Benjamin Cummings, 1979. Kauzmann, W.Thermodynamics and Statistics: With Applications to Gases. , W. Termodinmica Kauzmann y Estadstica: con aplicaciones de gases. New York: Benjamin, 1967. Nueva York: Benjamin, 1967.
Pgina 1 11 Chapter 18: Reaction Rates and Equilibrium Captulo 18: "Las tasas de reaccin y equilibrio" PPT Study Guide PPT Gua de Estudio Rates of Reaction Las tasas de reaccin Collision Theory Teora de la colisin Reactions can occur: Las reacciones pueden ocurrir: Very fast such as a firecracker Muy rpido - como un petardo Very slow such as the time it took for dead plants to make coal Muy lento - como el tiempo necesario para que las plantas muertas para hacer carbn A rate is a measure of the speed of any change that occurs within an interval of time Un "tipo" es una medida de la velocidad de cualquier cambio que se produce en un intervalo de tiempo In chemistry, reaction rate is expressed as the amount of reactant changing per unit time En qumica, la velocidad de reaccin se expresa como la cantidad de reactivo cambia por unidad de tiempo
Collision Model Colisin de modelo Key Idea: Molecules must collide to react. Idea clave: las molculas deben chocar para reaccionar. However, only a small fraction of collisions produces a reaction. Sin embargo, slo una pequea fraccin de las colisiones produce una reaccin. Why? Por qu? Particles lacking the necessary kinetic energy to react bounce apart unchanged when they collide Las partculas que carecen de la energa cintica necesaria para reaccionar rebote aparte sin cambios cuando chocan Collisions must have enough energy to produce the reaction (must equal or exceed the activation Colisiones debe tener suficiente energa para producir la reaccin (debe ser igual o superior a la activacin energy the minimum energy needed to react). la energa - la energa mnima necesaria para reaccionar). Think of clay clumps thrown together gently they don't stick, but if thrown together forcefully, Piense en montones de arcilla lanzados juntos con cuidado - no se peguen, pero si lanzado junto con fuerza, they stick tightly to each other. se adhieren firmemente el uno al otro. An activated complex is an unstable arrangement of atoms that forms momentarily (typically Un "complejo activado" es un arreglo de los tomos inestables que se forma un momento (por lo general about 10-13 seconds) at the peak of the activation-energy barrier. cerca de 10-13 segundos) en la cima de la barrera de energa de activacin. This is sometimes called the transition state A veces se denomina el estado de transicin Results in either a) forming products, or b) reformation of reactants Los resultados en cualquiera de los) productos que formen, o b) la reforma de los reactivos Both outcomes are equally likely Ambos resultados son igualmente probables The collision theory explains why some naturally occurring reactions are very slow La teora de las colisiones explica por qu algunas reacciones que ocurren naturalmente son muy lentos Carbon and oxygen react when charcoal burns, but this has a very high activation energy De carbono y el oxgeno reaccionan cuando se quema carbn, pero esto tiene una energa de activacin muy alta At room temperature, the collisions between carbon and oxygen are not enough to cause A temperatura ambiente, las colisiones entre el carbono y el oxgeno no son suficientes para causar
a reaction una reaccin Factors Affecting Rate Factores que afectan la tasa 1) Temperature 1) Temperatura Increasing temperature always El aumento de la temperatura siempre increases the rate of a reaction. aumenta la velocidad de una reaccin. 2) 2) Surface Area Superficie Increasing surface area increases El aumento de rea de superficie aumenta the rate of a reaction la velocidad de una reaccin 3) 3) Concentration Concentracin Increasing concentration USUALLY El aumento de la concentracin GENERALMENTE increases the rate of a reaction aumenta la velocidad de una reaccin 4) 4) Presence of Catalysts La presencia de catalizadores Page 2 Pgina 2 22 Catalysts Catalizadores Catalyst: A substance that speeds up a reaction, without being consumed itself in the reaction Catalizador: Sustancia que acelera una reaccin, sin que se consume en la reaccin Enzyme: A large molecule (usually a protein) that catalyzes biological reactions. Enzima: Una molcula de gran tamao (por lo general una protena) que cataliza las reacciones biolgicas. Human body temperature = 37 Humanos temperatura corporal = 37 oo C, much too low for digestion reactions without catalysts. C, demasiado baja para las reacciones de la digestin sin catalizadores. Inhibitors interfere with the action of a catalyst; reactions slow or even stop Inhibidores interferir con la accin de un catalizador; reacciones lentas o incluso detener Reversible Reactions and Equilibrium Reacciones reversibles y equilibrio Reversible Reactions Reacciones reversibles Some reactions do not go to completion as we have assumed Algunas reacciones no van a la conclusin que hemos asumido They may be reversible a reaction in which the conversion of reactants to products and Pueden ser reversibles - una reaccin en la que la conversin de los reactivos a los productos y the conversion of products to reactants occur simultaneously la conversin de los productos a los reactivos se producen simultneamente Forward: 2SO Adelante: 2SO 22 (g) + O (G) + O 22 (g) 2SO (G) 2SO 33 (g) (G)
Reverse: 2SO Reverso: 2SO 22 (g) + O (G) + O 22 (g) 2SO (G) 2SO 33 (g) (G) The two equations can be combined into one, by using a double arrow, which tells us that it is a Las dos ecuaciones se pueden combinar en uno solo, utilizando una flecha doble, lo que nos dice que es un reversible reaction: reaccin reversible: 2SO 2SO 22 (g) + O (G) + O 22 (g) 2SO (G) 2SO 33 (g) (G) A chemical equilibrium occurs, and no net change occurs in the actual amounts of the components Un equilibrio qumico se produce y se produce ningn cambio neto en las cantidades reales de los componentes of the system. del sistema. Even though the rates of the forward and reverse are equal, the concentrations of components on A pesar de que los tipos de las de avance y retroceso son iguales, las concentraciones de los componentes de both sides may not be equal ambas partes no puede ser igual An equlibrium position may be shown: Una posicin equlibrium se puede demostrar: A Un BB or o A Un BB 1% 1% 99% 99% 99% 99% 1% 1% It depends on which side is favored; almost all reactions are reversible to some extent Depende de qu lado se ve favorecida, casi todas las reacciones son reversibles en cierta medida Le Chatelier's Principle Principio de Le Chatelier The French chemist Henri Le Chatelier (1850-1936) studied how the equilibrium position shifts as El qumico francs Henri Le Chatelier (1850-1936) estudi cmo los cambios de posicin de equilibrio como a result of changing conditions resultado de cambios en las condiciones Le Chatelier's principle: If stress is applied to a system in equilibrium, the system changes in a Le Chatelier principio: Si el estrs se aplica a un sistema en equilibrio, los cambios en el sistema en un
way that relieves the stress manera que alivia el estrs What items did he consider to be stress on the equilibrium: Qu elementos se consideran como la tensin en el equilibrio: 1) Concentration 1) Concentracin 2) Temperature 2) la temperatura 3) Pressure 3) Presin Concentration adding more reactant produces more product, and removing the product as it Concentracin - aadiendo ms reactivo produce ms producto, y retirar el producto, ya que forms will produce more product formas se producen ms productos Page 3 Pgina 3 33 Temperature increasing the temperature causes the equilibrium position to shift in the direction Temperatura - aumento de la temperatura hace que la posicin de equilibrio de cambio en la direccin that absorbs heat que absorbe el calor If heat is one of the products (just like a chemical), it is part of the equilibrium Si el calor es uno de los productos (al igual que una sustancia qumica), es parte del equilibrio so cooling an exothermic reaction will produce more product, and heating it would shift refrigeracin para una reaccin exotrmica se producen ms productos, y la calefaccin que se desplazara the reaction to the reactant side of the equilibrium la reaccin a la lado de los reactivos del equilibrio Pressure changes in pressure will only effect gaseous equilibria Presin - cambios en la presin slo afectar a los equilibrios gaseosos Increasing the pressure will usually favor the direction that has fewer molecules El aumento de la presin por lo general a favor de la direccin que tiene menos molculas NN 22 (g) + 3H (G) + 3H 22 (g) 2NH (G) 2NH 33 (g) (G) For every two molecules of ammonia made, four molecules of reactant are used up the Por cada dos molculas de amonaco hecho, cuatro molculas de reactivos se utilizan para arriba - el
equilibrium shifts to the right with an increase in pressure equilibrio se desplaza hacia la derecha con un aumento de la presin Equilibrium Constants Constantes de equilibrio Chemists generally express the position of equilibrium in terms of numerical values Los qumicos suelen expresar la posicin de equilibrio en trminos de valores numricos These values relate to the amounts of reactants and products at equilibrium Estos valores se refieren a las cantidades de reactivos y productos en el equilibrio This is called the equilibrium constant, and abbreviated Keq Esto se conoce como la constante de equilibrio, y abreviado Keq consider this reaction: considerar esta reaccin: aA + bB _____ cC + dD AA BB + _____ cC + dD The equilibrium constant (Keq) is the ratio of product concentration to the reactant La constante de equilibrio (Keq) es la relacin entre la concentracin del producto para el reactivo concentration at equilibrium, with each concentration raised to a power (= the balancing concentracin en el equilibrio, con cada concentracin elevada a una potencia (= el equilibrio coefficient) coeficiente) consider this reaction: considerar esta reaccin: aA + bB ______ cC + dD AA BB + ______ cC + dD Thus, the equilibrium constant expression has the general form: As, la "constante expresin de equilibrio" tiene la forma general: [C]cx [D]d [C] cx [D] d __________ __________ _______________ _______________ [A]ax [B]b [A] ax [B] b (brackets: [ ] = molarity concentration) (Entre parntesis: [] = concentracin de molaridad) the equilibrium constants provide valuable information, such as whether products or reactants are las constantes de equilibrio proporcionar informacin valiosa, como si los productos o reactivos se favored: favorecidos: Keq > 1, products favored at equilibrium Keq> 1, los productos favorecidos en el equilibrio Keq < 1, reactants favored at equilibrium Keq <1, reactivos favorecida en el equilibrio Solubility Equilibrium Solubilidad en equilibrio Page 4 Pgina 4 44 Solubility Product Constant Solubilidad constante del producto Ionic compounds (salts) differ in their solubilities Los compuestos inicos (sales) difieren en su solubilidad Table 18.1, page 561 Tabla 18.1, pgina 561
Most insoluble salts will actually dissolve to some extent in water La mayora de "insolubles" sales en realidad se disuelve en cierta medida en el agua Better said to be slightly, or sparingly, soluble in water Mejor dicho a ser un poco, o escasamente solubles en agua Consider: AgCl(s) Ag+(aq) + Cl-(aq) Considere lo siguiente: AgCl (s) Ag + (aq) + Cl(aq) The equilibrium expression is: La "expresin de equilibrio" es: [ Ag+ ] x [ Cl- ] [Ag +] x [Cl-] Keq = Keq = [ AgCl ] [AgCl] What was the physical state of the AgCl? Cul fue el estado fsico del AgCl? Solubility Product Constant Solubilidad constante del producto AgCl existed as a solid material, and was not in dissolved in solution AgCl existido como un material slido, y no estaba en disuelto en la solucin the [ AgCl ] is constant as long as some undissolved solid is present el [AgCl] es constante mientras algunos slido no disuelto est presente By multiplying the two constants, a new constant is developed, and is called the solubility Multiplicando las dos constantes, una nueva constante se desarrolla, y se llama la solubilidad " product constant (Ksp): constante del producto "(KSP): Keq x [ AgCl ] = Keq x [AgCl] = Values of solubility product constants are given for some common slightly soluble salts Los valores de las constantes de producto de solubilidad se dan para algunos poco soluble sales comunes Ksp = [Ag Kps = [Ag 1+ 1 + ] x [Cl ] X [Cl 1- 1 ]] Ksp = 1.8 x 10 Kps = 1,8 x 10 -10 -10 The smaller the numerical value of Ksp, the lower the solubility of the compound Cuanto menor sea el valor numrico de Kps, menor es la solubilidad de los compuestos AgCl is usually considered insoluble because of its low value AgCl se considera generalmente insolubles debido a su bajo valor To solve problems: Para resolver los problemas: a) write the balanced equation, which splits the chemical into its ions a) escribir la ecuacin balanceada, que se divide el producto qumico en sus iones b) write the equilibrium expression, and b) escribe el "equilibrio de expresin", y c) fill in the values known; calculate answer c) introducir en los valores conocidos; calcular respuesta Common Ion Effect Efecto del ion comn A common ion is an ion that is found in both salts in a solution Un "ion comn" es un ion que se encuentra tanto en las sales en una solucin example: You have a solution of lead (II) chromate. ejemplo: Usted tiene una solucin de plomo (II) cromato. You now add some lead (II) nitrate Ahora aadir un poco de plomo (II) el nitrato de
to the solution. a la solucin. The lead is a common ion El plomo es un ion comn Page 5 Pgina 5 55 This causes a shift in equilibrium (due to Le Chatelier's principle regarding Esto provoca un cambio en el equilibrio (por el principio de Le Chatelier sobre concentration), and is called the common ion effect concentracin), y se llama el efecto del ion comn The solubility product constant (Ksp) can also be used to predict whether a precipitate will form or El producto de solubilidad constante (Kps) tambin se puede utilizar para predecir si un precipitado se forma o not: no: if the calculated ion-product concentration is greater than the allowed Ksp, then a si el producto inico concentracin calculada es mayor que el permitido Kps, entonces una precipitate will form se formar un precipitado Entropy and Free Energy Entropa y Energa Libre Free Energy and Spontaneous Reactions Energa libre y reacciones espontneas Many chemical and physical processes release energy, and that can be used to bring about other Muchos qumicos y los procesos de liberacin de energa fsica, y que puede ser utilizado para producir otros changes cambios The energy in a chemical reaction can be harnessed to do work, such as moving the La energa en una reaccin qumica se puede aprovechar para hacer el trabajo, tales como mover el pistons in your car's engine pistones en el motor de su coche Free energy is energy that is available to do work La energa libre es la energa que est disponible para hacer el trabajo That does not mean it can be used efficiently Eso no quiere decir que se puede utilizar de manera eficiente Your car's engine is only about 30 % efficient, and this is used to propel it El motor de su coche es slo un 30% de eficiencia, y esto se utiliza para propulsar The remaining 70 % is lost as friction and waste heat El restante 70% se pierde en la friccin y el calor residual No process can be made 100 % efficient Ningn proceso puede ser eficaz al 100% Even living things, which are among the most efficient users of free energy, are seldom Incluso los seres vivos, que estn entre los usuarios ms eficiente de la energa libre, son rara vez more than 70 % efficient ms del 70% de eficiencia We can only get energy from a reaction that actually occurs, not just theoretically: Slo podemos obtener energa de una reaccin que ocurre en realidad, no slo tericamente: CO2(g) C(s) + O2(g) De CO2 (g) C (s) + O2 (g) this is a balanced equation, and is the reverse of combustion se trata de una ecuacin equilibrada, y es la inversa de la combustin Experience tells us this does not tend to occur, but instead happens in the reverse La experiencia nos dice que esto no tienden a ocurrir, sino que sucede en el reverso
direction direccin The world of balanced chemical equations is divided into two groups: El mundo de las ecuaciones qumicas balanceadas se divide en dos grupos: Equations representing reactions that actually occur Ecuaciones que representan las reacciones que ocurren realmente Equations representing reactions that do not tend to occur, or at least not efficiently Ecuaciones que representan las reacciones que no tienden a ocurrir, o al menos no de manera eficiente The first, (those that actually occur) and more important group involves processes that are La primera, (los que realmente se producen) y ms importante grupo de procesos que implica se spontaneous espontnea A spontaneous reaction occurs naturally, and favors the formation of products at the Una reaccin espontnea se produce naturalmente, y favorece la formacin de productos en el specified conditions condiciones que se especifican They produce substantial amounts of product at equilibrium, and release free energy Que producen grandes cantidades de producto en el equilibrio, y la liberacin de energa libre In contrast, a nonspontaneous reaction is a reaction that does not favor the formation of products at Por el contrario, una reaccin no espontnea es una reaccin que no favorece la formacin de productos en the specified conditions las condiciones especificadas These do not give substantial amounts of product at equilibrium Estos no dan grandes cantidades de producto en el equilibrio Page 6 Pgina 6 66 Think of soda pop bubbling the CO Piense de soda pop burbujeante de CO 22 out: this is spontaneous, whereas the CO salida: esto es espontnea, mientras que las emisiones de CO 22 going back into va de nuevo en solution happens very little, and is nonspontaneous solucin pasa muy poco, y es no espontnea Spontaneous Reactions Las reacciones espontneas Do not confuse the words spontaneous and instantaneous. No hay que confundir las palabras espontnea e instantnea. Spontaneous just simply means that it Espontnea simplemente significa que will work by itself, but does not say anything about how fast the reaction will take place it may trabajar por s mismo, pero no dice nada acerca de la rapidez con la reaccin tendr lugar - puede take 20 years to react, but it will eventually react. necesarios 20 aos para reaccionar, pero reacciona con el tiempo. Some spontaneous reactions are very slow: Algunas reacciones espontneas son muy lentos: sugar + oxygen carbon dioxide azcar + oxgeno de dixido de carbono
and water, but a bowl of sugar appears to be doing nothing (it is reacting, but would y el agua, pero un tazn de azcar parece ser no hacer nada (es reaccionar, sino que take thousands of years) tener miles de aos) At room temperature, it is very slow; apply heat and the reaction is fast; thus changing A temperatura ambiente, es muy lento, aplique calor y la reaccin es rpida, por lo que el cambio the conditions (temp. or pressure) may determine whether or not it is spontaneous las condiciones (temperatura o presin) puede determinar si es o no es espontnea Entropy Entropa Entropy is a measure of disorder, and is measured in units of J/mol.K; there are no negative values La entropa es una medida del desorden, y se mide en unidades de J / mol.K, no hay valores negativos of entropy de la entropa The law of disorder states the natural tendency is for systems to move to the direction of La ley del trastorno estados la tendencia natural es que los sistemas para pasar a la direccin de maximum disorder, not vice-versa mximo desorden, no al revs Your room NEVER cleans itself (disorder to order?) Su habitacin NUNCA se limpia (desorden al orden?) An increase in entropy favors the spontaneous chemical reaction Un aumento en la entropa favorece la reaccin qumica espontnea A decrease in entropy favors the nonspontaneous reaction Una disminucin de la entropa favorece la reaccin no espontnea Enthalpy and Entropy Entalpa y entropa 1) Reactions tend to proceed in the direction that lowers the energy of the system (H, enthalpy). 1) Las reacciones tienden a proceder de la direccin en que disminuye la energa del sistema (H, entalpa). and y 2) Reactions tend to proceed in the direction that increases the disorder of the system (S, entropy). 2) Las reacciones tienden a proceder de la direccin en que aumenta el desorden del sistema (S, la entropa). 3) These are the two drivers to every equation. 3) Estos son los dos "drivers" para cada ecuacin. 1) If they both AGREE the reaction should be spontaneous, IT WILL be spontaneous at all 1) Si ambos estn de acuerdo que la reaccin debe ser espontneo, SERA espontnea en todos temperatures, and you will not be able to stop the reaction without separating the temperaturas, y no ser capaz de detener la reaccin sin separacin de los reactants reactivos 2) If they both AGREE that the reaction should NOT be spontaneous, it will NOT work at 2) Si ambos estn de acuerdo que la reaccin no debe ser espontnea, que no van a funcionar ANY temperature, no matter how much you heat it, add pressure, or anything else! Cualquier temperatura, no importa cunto lo fuego, aadir la presin, o cualquier otra cosa! 4) The size and direction of enthalpy and entropy changes together determine whether a reaction is 4) El tamao y la direccin de los cambios de entalpa y entropa en conjunto, determinan si una reaccin es spontaneous espontnea
5) If the two drivers disagree on whether or not it should be spontaneous, a third party (Gibb's free 5) Si los dos pilotos estn en desacuerdo sobre si es o no debe ser espontnea, un tercero (Gibb es gratis energy) is called in to act as the judge about what temperatures it will be spontaneous, and what energa) es llamado para actuar como "juez" de lo que la temperatura ser espontneo, y lo que the temp. la temperatura. is. es. Page 7 Pgina 7 77 1) But, it WILL work and be spontaneous at some temperature! 1) Sin embargo, va a trabajar y ser espontneo en una cierta temperatura! Spontaneity of Reactions La espontaneidad de las reacciones Reactions proceed spontaneously in the direction that lowers their Gibb's free energy, G. Reacciones proceden espontneamente en la direccin en que disminuye su energa libre de Gibbs, G. G = H - TS DELTA.G = DELTA.H - T S (T is kelvin temp.) (T es la temperatura Kelvin.) If G is negative, the reaction is spontaneous. Si DELTA.G es negativo, la reaccin es espontnea. (system loses free energy) (Sistema pierde energa libre) If G is positive, the reaction is NOT spontaneous. Si DELTA.G es positivo, la reaccin no es espontnea. (requires work be expended) (Requiere un trabajo de ser gastados) Therefore, if the enthalpy and entropy do not agree with each other as to what should happen: Por lo tanto, si la entalpa y la entropa no est de acuerdo entre s sobre lo que debera suceder: Gibbs free-energy says that they are both correct, the reaction will occur Gibbs energa libre, dice que ambos son correctos, la reaccin se producir But the Gibbs free-energy will decide the conditions of temperature that it will happen Pero la energa libre de Gibbs-decidir las condiciones de temperatura que va a pasar The Progress of Chemical Reactions El Progreso de las Reacciones Qumicas Rate Laws Tasa de Leyes For the equation: A B, the rate at which A forms B can be expressed as the change in A (or Para la ecuacin: A B, la velocidad a la que se forma una B se puede expresar como el cambio de A (o A) with time, where the beginning concentration A1 is at time t1, and concentration A2 is at a ) Con el tiempo, donde el principio A1 concentracin es en el tiempo t1, y la concentracin de A2 DELTA.A se encuentra en una later time t2 ms tarde el tiempo t2 Rate = A = -concentration A Velocidad = DELTA.A = concentracin de un 22 concentration A - Una concentracin 11 t Dt tt 22 t-T
11 Since A is decreasing, its concentration is smaller at a later time than initially, so A is negative Puesto que A est disminuyendo, su concentracin es menor en un rato ms de lo inicialmente, por lo que es negativo DELTA.A The negative sign is needed to make the rate positive, as all rates must be. El signo negativo es necesario para que la tasa de positivos, ya que todos los precios se. The rate of disappearance of A is proportional to concentration of A: La tasa de desaparicin de A es proporcional a la concentracin de A: - A - DELTA.A [A] [A] t Dt Rate = A = kx [A] Velocidad = DELTA.A = kx [A] t Dt This equation, called a rate law, is an expression for the rate of a reaction in terms of the Esta ecuacin, llamada ecuacin de velocidad, es una expresin para la velocidad de una reaccin en trminos de la concentration of reactants. concentracin de los reactivos. The specific rate constant (k) for a reaction is a proportionality constant relating the concentrations La constante de velocidad especfica (k) para una reaccin es una constante de proporcionalidad que relaciona la concentracin of reactants to the rate of reaction de los reactivos a la velocidad de reaccin The value of the specific rate constant, k, is large if the products form quickly El valor de la constante de velocidad especfica, k, es grande cuando los productos de forma rpida The value of k is small if the products form slowly El valor de k es pequeo si los productos de forma lenta The order of a reaction is the power to which the concentration of a reactant must be raised to La "orden de una reaccin" es el poder para que de un reactivo debe ser elevado a la concentracin give the experimentally observed relationship between concentration and rate dar a los observados experimentalmente la relacin entre la concentracin y la tasa de For the equation: aA + bB cC + dD, Para la ecuacin: aA + bB cC + dD, Rate = k[A] Tasa de k = [A] a una [B] [B] bb Rate = k[A] Tasa de k = [A] a una [B] [B] bb Page 8 Pgina 8
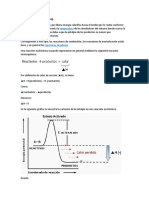
88 Notice that the rate law which governs the speed of a reaction is based on THREE things: Tenga en cuenta que la ley de velocidad que rige la velocidad de una reaccin se basa en tres cosas: 1) The concentration (molarity) of each of the reactants 1) La concentracin (molaridad) de cada uno de los reactivos 2) The power to which each of these reactants is raised 2) La facultad de que cada uno de estos reactivos se levanta 3) The value of k or the rate constant (which is different for every different equation.) 3) El valor de k, o la constante de velocidad (que es diferente para cada ecuacin diferente.) 4) Rate = k[A]a[B]b 4) Tasa de k = [A] a [B] b 5) The powers to which the concentrations are raised are calculated from experimental data, and the 5) La competencia para que las concentraciones se elevan se calculan a partir de datos experimentales, y la rate constant is also calculated. constante de velocidad tambin se calcula. These powers are called ORDERS. Estos poderes se llaman PEDIDOS. 6) For example, if the exponent of A was 2, we would say the reaction is 2nd order in A; if the 6) Por ejemplo, si el exponente de una era de 2, se dira que la reaccin es de 2 orden en A, si el exponent of B was 3, we would say the reaction is 3rd order in B. exponente de B fue de 3, se dira que la reaccin es tercera orden en B. 7) The overall reaction order is the SUM of all the orders of reactants. 7) El orden de reaccin total es la suma de todas las rdenes de los reactivos. If the order of A was 2, and B Si la orden de A fue de 2, y B was 3, the overall reaction order is 5. fue de 3, el orden de reaccin general es de 5. Reaction Mechanisms Mecanismos de reaccin a peak for each elementary reaction un mximo para cada "reaccin elemental" An elementary reaction is a reaction in which the reactants are converted to products in a Una reaccin elemental es una reaccin en la que los reactivos se convierten en productos en una single step solo paso Only has one activation-energy peak between reactants and products Slo tiene un pico de energa de activacin entre reactivos y productos Peaks are energies of activated complexes, and valleys are the energy of an intermediate Los picos son las energas de los complejos activados, y los valles son la energa de un intermedio An intermediate is a product of one of the steps in the reaction mechanism Un intermediario es un producto de uno de los pasos en el mecanismo de reaccin Remember how Hess's law of summation was the total of individual reactions added Recuerda cmo la ley de Hess de la suma fue el total de las reacciones individuales agreg together to give one equation? juntos para dar una ecuacin
También podría gustarte
- Energía Libre1Documento37 páginasEnergía Libre1hachiko_japonAún no hay calificaciones
- Presentación 1Documento8 páginasPresentación 1hachiko_japonAún no hay calificaciones
- Energía LibreDocumento22 páginasEnergía Librehachiko_japonAún no hay calificaciones
- Via de EmbdenDocumento3 páginasVia de EmbdenDanny G Ramirez100% (1)
- Energia LibreDocumento10 páginasEnergia Librehachiko_japonAún no hay calificaciones
- Tipo de SentimientoDocumento2 páginasTipo de Sentimientohachiko_japonAún no hay calificaciones
- El Cambio de Energía Libre de Una Reacción Determina Si Puede Ocurrir 18Documento15 páginasEl Cambio de Energía Libre de Una Reacción Determina Si Puede Ocurrir 18hachiko_japonAún no hay calificaciones
- Efecto Del Detergente BiodegradableDocumento6 páginasEfecto Del Detergente Biodegradablehachiko_japonAún no hay calificaciones
- El Detegente Es Parte de Nuestra Vida DiariaDocumento17 páginasEl Detegente Es Parte de Nuestra Vida Diariahachiko_japonAún no hay calificaciones
- Los Detergentes Biodegradables Los Cuales Cuentan Con Las Siguientes Características y VentajasDocumento3 páginasLos Detergentes Biodegradables Los Cuales Cuentan Con Las Siguientes Características y Ventajashachiko_japon100% (3)
- Las Enzimas Rompen Las Moléculas de Las Manchas ProteínicasDocumento2 páginasLas Enzimas Rompen Las Moléculas de Las Manchas Proteínicashachiko_japon100% (1)
- TITULODocumento3 páginasTITULOhachiko_japonAún no hay calificaciones
- Detergentes BiodegradablesDocumento10 páginasDetergentes Biodegradableshachiko_japon80% (5)
- Cursos Climatizacion y Refrigeracion 2017-2018 de NIK INGENIEROSDocumento6 páginasCursos Climatizacion y Refrigeracion 2017-2018 de NIK INGENIEROSalberto jayaAún no hay calificaciones
- Pro Sem 12 Ses 1 GasesidealesDocumento2 páginasPro Sem 12 Ses 1 GasesidealesAngel GutierrezAún no hay calificaciones
- La Capasidad CalorificaDocumento7 páginasLa Capasidad CalorificaElias Niquin Castillo0% (1)
- Semana 1.Documento33 páginasSemana 1.Gonzalo SanchezAún no hay calificaciones
- PRACTICA LABORATORIO Intercambiador de Tubo y CorazaDocumento13 páginasPRACTICA LABORATORIO Intercambiador de Tubo y CorazayuzuamayaAún no hay calificaciones
- TP 1 Calibración de Un Termómetro PDFDocumento14 páginasTP 1 Calibración de Un Termómetro PDFDeb iiAún no hay calificaciones
- Presion de VaporDocumento2 páginasPresion de VaporJOSELIN MILAGROS RAMOS HUANCAAún no hay calificaciones
- Glosario de Terminos EcologicosDocumento23 páginasGlosario de Terminos EcologicosMariangelesAún no hay calificaciones
- Analisis de Parametros ConcentradosDocumento9 páginasAnalisis de Parametros ConcentradosDavid WicabAún no hay calificaciones
- Turbina de AvionDocumento19 páginasTurbina de AvionJhismer G. Carbajal100% (2)
- GUIA QUIMICA ONCE GRADO NEUMATICOS TEMPERATURADocumento2 páginasGUIA QUIMICA ONCE GRADO NEUMATICOS TEMPERATURASebastian GuevaraAún no hay calificaciones
- Determinacion de La Constante Del CalorimetroDocumento6 páginasDeterminacion de La Constante Del CalorimetroArenas Cardozo Luis NicolasAún no hay calificaciones
- 505am 5f7c4f65a2755Documento16 páginas505am 5f7c4f65a2755Humberto C. BustosAún no hay calificaciones
- Proceso de Tostado de GranosDocumento8 páginasProceso de Tostado de GranosYefer Salazar ValdiviaAún no hay calificaciones
- CalorEspCuerpoSólidoDocumento3 páginasCalorEspCuerpoSólidoNas LizcanoAún no hay calificaciones
- Reacción ExotérmicaDocumento12 páginasReacción ExotérmicaRYUMASUAún no hay calificaciones
- Determinacion de GammaDocumento14 páginasDeterminacion de Gammamartin riojaAún no hay calificaciones
- Actividades Ficha 2Documento11 páginasActividades Ficha 2Heliana Llantén100% (1)
- ALQ 4.en - ESPAÑOLDocumento10 páginasALQ 4.en - ESPAÑOLMusa PASIÓNAún no hay calificaciones
- Balances en Procesos ReactivosDocumento12 páginasBalances en Procesos ReactivosEsme Vidal100% (1)
- Diagnóstico TermográficoDocumento31 páginasDiagnóstico TermográficoVictor HenAún no hay calificaciones
- Conceptos Cap 3Documento9 páginasConceptos Cap 3Ruben Mejía AlmeidaAún no hay calificaciones
- Configurar Parametros de Temperatura CamaraDocumento10 páginasConfigurar Parametros de Temperatura CamaraalexmongoyAún no hay calificaciones
- Análisis temperaturas extremasDocumento7 páginasAnálisis temperaturas extremasMilenita GonzalezAún no hay calificaciones
- TD3-2019.2 Tarea Corta 03 PDFDocumento3 páginasTD3-2019.2 Tarea Corta 03 PDFDiego LópezAún no hay calificaciones
- Ciclo Del AguaDocumento2 páginasCiclo Del AguaPaul Andres Campoverde TorresAún no hay calificaciones
- Fisica 2022-2Documento6 páginasFisica 2022-2Alex UsurinAún no hay calificaciones
- Presentacion Gratis Salud Medico Ilustracion CelesteDocumento44 páginasPresentacion Gratis Salud Medico Ilustracion Celestemafer ramirezAún no hay calificaciones
- Aires AcondicionadosDocumento50 páginasAires Acondicionadosadrianaclm_Aún no hay calificaciones