Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Quimica - R1 - Átomo - Números Cuánticos - Configuración Electrónica
Cargado por
Enrique PuenteTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Quimica - R1 - Átomo - Números Cuánticos - Configuración Electrónica
Cargado por
Enrique PuenteCopyright:
Formatos disponibles
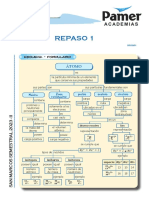
Átomo - Números cuánticos -
REPASO 1
Configuración electrónica
ESQUEMA - FORMULARIO
ÁTOMO
Es una partícula que representa la mínima porción de un elemento que mantiene
sus propiedades de este.
sus partes son sus partículas subatómicas fundamentales son
NÚCLEO
PROTÓN NEUTRÓN
Contiene protones y
neutrones principalmente Carga positiva Carga nula
es compacta, determina la
ubicados en el núcleo en ubicados en el núcleo
masa del átomo.
Posee carga positiva. un núclido (átomo). en un núclido (átomo)
ZONA EXTRANUCLEAR Tipos de núclidos Representación
A
ZE
Isótopos
Se cumple que:
Contiene solamente a los #p+ = #e– = Z
electrones es casi vacío,
determina el volumen Poseen igual número
atómico. atómico. ELECTRÓN
Posee carga negativa. Ejemplo:
12 14
6C 6C
Carga negativa
Isóbaros
ubicado en zona extranu-
Isótonos clear en un ion.
Poseen igual número de
masa. Representación
Ejemplo: Poseen igual número de
A q+ A q–
ZE ZE
40 40 electrones.
20 Ca 18 Ar Ejemplo:
11 12
Se cumple que:
5B 6C #p+ = Z ≠ #e–
especie Denominación #p+ #e– #n especie Denominación #p+ #e– #n
33 2– Ion binegativo o 27 3+ Ion tripositivo o
16 18 17 13 10 14
16 S Anión divalente 13 Al catión trivalente
QUÍMICA SAN MARCOS REPASO 2022 - I 1
Átomo - Números cuánticos - Configuración electrónica
NÚMEROS CUÁNTICOS
REPASO 1
Número Determina para el
Valores permitidos
cuántico electrón orbital
n = 1, 2, 3, 4, 5, 6 ... ∞
el nivel principal el tamaño o
Principal (n) ↓ ↓ ↓ ↓ ↓ ↓
de energía volumen capa K L M N O P ...
Secundario o el subnivel de la forma l = 0, 1, 2, 3, ... (n–1)
↓ ↓ ↓ ↓
azimutal (l) energía geométrica s p d f
Magnético el orbital o su orientación
ml = –l, ..., 0, ..., +l
(ml) REEMPE espacial
Spín antihorario horario
el sentido de no tiene
magnético ↑ ↓
rotación significado
(ms) ms = + 1/2 ms = – 1/2
CONFIGURACIÓN ELECTRÓNICA
Es el ordenamiento sistemático de los electrones en la zona extranuclear.
se basa en
PRINCIPIO DE AUFBAU PRINCIPIO DE MÁXIMA MULTIPLICIDAD (REGLA DE HUND)
Permite distribuir a través de los Permite distribuir a través de los orbitales de
subniveles según el orden creciente un subnivel para ello a todos los orbitales se
de la energía relativa (ER). les deja a medio llenar antes de llenarlo.
Ejemplo:
Ejemplo: ↑↓ ↑↓ ↑↓ ↑ ↑
9F:1s22s22p5 8O:
1s 2s 2px 2py 2pz
↓ ↓ ↓
Er: 1 2 3 ↑↓ ↑↓ ↑ ↑
16S: [Ne]
3s 3px 3py 3pz
Otros
2 2 6 2 4 Si posee:
16S = 1s 2s 2p 3s 3p
2 2 6 2 6 2
23V = 1s 2s 2p 3s 3p 4s 3d3 • Todos sus electrones apareados será
diamagnético.
Según Kernel:
2 4
• Uno o más electrones desapareados será
16S = [Ne]3s 3p
2 3 paramagnético.
23V = [Ar]4s 3d
2 SAN MARCOS REPASO 2022 - I QUÍMICA
Átomo - Números cuánticos - Configuración electrónica
PRINCIPIO DE EXCLUSIÓN DE PAULI
REPASO 1
Permite distribuir a través de un orbital estableciendo que en un átomo dos electrones no
pueden tener sus 4 números cuánticos iguales.
Ejemplo:
↑↓
2He:
1s
electrón n l ml ms
↑ 1 0 0 +1/2
↓ 1 0 0 –1/2
PRINCIPIO DE AUFBAU
1 2 3 3 4 8
E.R. = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
KERNEL 2He 10Ne 18Ar 36Kr 54Xe 86Rn
PROBLEMAS PROPUESTOS
1. El átomo es la mínima partícula representa- D) Al ganar o perder electrones se forman
tiva de un elemento químico que conserva los iones respectivos.
su identidad y sus propiedades, su estruc-
tura está formada por el núcleo atómico y 2. La representación de los iones y átomos
la envoltura electrónica. Con respecto al neutros se denomina núclido, en el cual
átomo y las partículas que lo constituyen, el número de masa indica la cantidad de
indique la alternativa INCORRECTA. nucleones y el número atómico la cantidad
UNMSM-CENTRO PREUNIVERSITARIO de protones. Al respecto, seleccione el
Ciclo 2020-I valor de verdad (V o F) de las siguientes
A) El núcleo representa su masa y la en- proposiciones.
voltura electrónica su volumen. I. El 20E40, representa al átomo de un
B) Las partículas que se encuentran en el elemento que tiene 20 protones y 20
núcleo se denominan nucleones. neutrones en el núcleo.
C) Según el modelo actual los electrones II. El 6E12 es isótopo del 6E14 porque ambos
giran en órbitas definidas. tienen el mismo número de nucleones.
QUÍMICA SAN MARCOS REPASO 2022 - I 3
Átomo - Números cuánticos - Configuración electrónica
56
III. El 26Fe+3 tiene 26 protones, 30 neutro- positiva (protones), y por una parte externa
(zona extranuclear), provista por partículas
REPASO 1
nes y 29 electrones.
con carga negativa (electrones). Al respecto
UNMSM-CENTRO PREUNIVERSITARIO
halle la secuencia correcta del valor de
Ciclo 2020-I
verdad (V o F) de las proposiciones.
A) VVF B) VFF
C) VFV D) FVF I. El núcleo solo contiene protones.
II. Protones y electrones son eléctricamen-
3. El selenio (Se) ayuda a nuestro cuerpo a te opuestos, pero de masa casi iguales.
producir proteínas. Uno de los isótopos es III. En todo átomo eléctricamente neutro
78
34Se . Al respecto, señale las proposiciones se cumple que el número de protones
correctas. es igual al número de electrones.
I. Presenta 34 protones. A) VVF
II. En la zona extranuclear hay 34 partí- B) VFV
culas.
C) FFV
III. En el núcleo hay 78 partículas funda-
D) FVF
mentales neutras.
A) I y II
B) II y III 6. Cuando se hace referencia a un tipo con-
C) I, II y III creto de núcleo (o átomo) de un elemento
químico determinado, suele emplearse
D) solo I
el término núclido o nucleído, como por
ejemplo 20Ca44.
4. El ion fosfuro P3−, se encuentra formando
parte del fosfuro de zinc, el cual es un in- Respecto al núclido representado, indique
grediente utilizado en algunos venenos para las proposiciones correctas.
ratas y también es utilizado para el control I. Contiene 24 nucleones fundamentales
de plagas. Si se sabe que el fósforo posee eléctricamente neutros.
carga nuclear 15, indique las proposiciones II. La cantidad de carga eléctrica del nú-
incorrectas. cleo es +3,2 × 10–19 C.
I. En la formación del fosfuro de zinc, el III. Contiene 44 partículas subatómicas
átomo se fósforo se reduce. fundamentales.
II. El ion fosfuro posee 18 electrones. A) solo I
III. El átomo neutro del fósforo (15P), puede
B) I y II
reemplazar al fosfuro de zinc para el
C) II y III
control de plagas.
A) solo I B) solo II D) I y III
C) solo III D) II y III
7. En un texto de química se analiza la infor-
5. Las investigaciones sobre el átomo con- mación de los elementos químicos: fósforo
cluyen que la estructura del átomo está y azufre. Considerando solo los siguientes
31 32 32
formada por una parte central (núcleo), nucleídos: 15P , 16S , 15P determine la
siempre provista de partículas con carga secuencia correcta del valor de verdad (V
o F) de las proposiciones.
4 SAN MARCOS REPASO 2022 - I QUÍMICA
Átomo - Números cuánticos - Configuración electrónica
31 32
I. 15P y 16S presentan propiedades B) Los núcleos participantes son isóbaros.
diferentes, pero son isótonos. C) El cambio del carbono-14 es un fenó-
REPASO 1
II. 32 32
16S y 15P son isobaros, por lo tanto,
meno químico.
tienen igual masa. D) Se puede determinar la antigüedad de
III. 15P 31
y 15P 32
son isótopos, por lo tanto, la ciudad de Caral.
manifiestan las mismas propiedades
químicas. 10. Los átomos involucrados en los fenómenos
A) FFV B) VFF químicos pueden sufrir una alteración en
la composición de la zona extranuclear,
C) VVV D) VFV
ionizándose tal como.
3+ 2–
13Al + 34Se → 13Al + 34Se
8. El agua de mar es una mezcla que com-
Al respecto, indique las proposiciones co-
pone los mares y océanos. Además, el
rrectas.
1– 2+ 1+
agua contiene iones 17Cl , 38Sr , 19K ,
1– 2+
I. El aluminio se oxida, ganando 3 elec-
9F , 20Ca , etc., que le permite conducir
trones por átomo.
la corriente eléctrica.
II. El selenio se reduce.
Al respecto, indique lo incorrecto.
III. El ion divalente posee 36 electrones y
A) El de menor número de electrones es
34 protones.
un anión.
A) solo I
B) Los cationes son divalentes.
B) I y II
C) Los aniones son monovalentes.
C) II y III
D) Si por desalinización térmica se separan
D) I y III
los iones, entonces el agua no conduce
corriente eléctrica.
11. Para la mecánica cuántica son necesarios
cuatro números cuánticos (n, l, ml, ms)
9. La datación por radiocarbono es un método
para determinar el comportamiento de los
de datación radiométrica que utiliza el isóto-
electrones en los diferentes átomos. Al res-
po carbono–14 (14C) para determinar la
pecto, indique las proposiciones correctas.
edad de materiales que contienen carbono
I. El valor del número cuántico espín
de hasta unos 50 000 años.
magnético (ms) no está en función de
El cambio que sufre el carbono–14 se re-
los otros números cuánticos.
presenta con la siguiente ecuación nuclear:
II. El número cuántico azimutal (l) define
14 0 14
6C –1b
+ 7N
el subnivel de energía del electrón y su
núcleo partícula núcleo valor está en función de ml.
emisor emitida resultante III. La cantidad de valores que asume el
carbono-14 partícula nitrógeno-14
beta número cuántico magnético (ml) es
Al respecto, indique la proposición inco- 2(l) + 1, es decir, está en función de l.
rrecta. A) solo II
A) El núcleo constituido por 6p+ y 8n0 es B) I y II
inestable, es decir, el C-14 es radioi- C) II y III
sótopo. D) I y III
QUÍMICA SAN MARCOS REPASO 2022 - I 5
Átomo - Números cuánticos - Configuración electrónica
12. Según la mecánica cuántica, a cada electrón le corresponde cuatro números cuánticos. En la
siguiente tabla se resalta los números cuánticos secundario (l) y magnético (ml):
REPASO 1
Número de Número máximo
Subnivel (l) Orbitales llenos de valores de ml
orbitales de electrones
↑↓
s(l = 0) 1 2
0
↑↓ ↑↓ ↑↓
p(l = 1) 3 6
–1 0 +1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
d(l = 2) 5 10
–2 –1 0 +1 +2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
f(l = 3) 7 14
–3 –2 –1 0 +1 +2 +3
Al respecto, indique la alternativa incorrecta.
A) 10 electrones poseen l = 2.
B) 2 electrones poseen l = 3 y ml = 0.
C) Solo 1 electrón posee l = 1, ml = +1 y ms = +1/2.
D) 32 electrones poseen ms = +1/2.
13. Las tierras raras no son realmente “tierras”, z z
y y
conforman un grupo de 17 elementos
químico s, uno de lo s c u a le s e s e l x x
lutecio (Z = 71). Para el átomo de este
elemento, se analiza teóricamente la zona s Px
extranuclear, específicamente la cantidad de z z
y y
electrones por subniveles u orbitales en la
capa N. Indique la representación incorrecta x x
al reportar el análisis.
Py Pz
A) 4s2 B) 4f14
Según la información, halle la secuencia
C) 4px6 D) 4d10
correcta del valor de verdad (V o F) de las
proposiciones.
14. En los átomos polielectrónicos, la energía de I. A los electrones contenidos les corres-
un electrón depende del número cuántico ponde necesariamente el número cuán-
principal y el número cuántico secundario. tico principal 2 y el número cuántico
Indique el electrón de menor energía, es secundario 1.
decir, el electrón de mayor estabilidad en II. El orbital esférico como máximo con-
el átomo polielectrónico. tiene 2 electrones, mientras que un
A) 5s1 B) 2p1 orbital dilobular puede tener más de 2
1
C) 3d D) 5f1 electrones.
III. Los orbitales degenerados pueden estar
15. Se muestran la forma y orientación de los semillenos.
orbitales atómicos del segundo nivel de A) FFV B) FVV
energía de un átomo polielectrónico. C) FVF D) VFV
6 SAN MARCOS REPASO 2022 - I QUÍMICA
Átomo - Números cuánticos - Configuración electrónica
16. En el átomo de hierro (Z = 26), el último A) VVV B) FVV
electrón con rotación horaria, probablemen- C) VVF D) VFV
REPASO 1
te, se encuentra en el orbital tetralobular
dxy cuya forma y orientación es: 19. Considerando la zona extranuclear de un
z átomo polielectrónico eléctricamente neu-
tro, señale la alternativa incorrecta.
y
A) La capa N contiene como máximo 16
x orbitales.
B) El nivel 3 contiene como máximo 18
Indique los probables números para el electrones.
electrón indicado. C) El subnivel difuso está constituido de 5
A) 3, 3, +1, +1/2 orbitales degenerados.
B) 4, 1, –1, –1/2 D) El nivel 2 contiene 4 orbitales idénticos.
C) 3, 2, –2, –1/2
D) 3, 2, –2, +1/2 20. En un átomo polielectrónico como el fósforo
(Z = 15), los números cuánticos magnéti-
17. Respecto al orbital atómico, indique la cos y secundarios indican para el electrón,
proposición incorrecta. respectivamente,
A) Es una región espacial que se encuentra A) subnivel y nivel de energía.
en la zona extranuclear. B) orbital y subnivel de energía.
B) Contiene como máximo 2 electrones. C) subnivel y masa.
C) Presenta diferentes formas geomé- D) nivel y subnivel de energía.
tricas.
D) Dentro de él, los electrones se mueven 21. El rubidio se puede ionizar con facilidad por
en trayectorias definidas. lo que se ha estudiado su uso en motores
iónicos para naves espaciales, antes de
18. La zona extranuclear del átomo neutro basal ionizar el último electrón se describe con
(estado cuántico de menor energía) de litio n = 5 y l = 0, indique la configuración
está constituido de 2 orbitales no idénticos, electrónica y el número atómico.
que se muestran a continuación: A) [Ar] 5s2 y 20
z
B) [Ne] 5s2 y 12
z
C) [Ar] 5s1 y 19
y D) [Kr] 5s1 y 37
y
x
1s 2s 22. En la naturaleza, los elementos químicos se
Considerando esta información, halle la distribuyen en forma libre o formando com-
secuencia correcta del valor de verdad (V puestos químicos o simplemente mezclado.
o F) de las proposiciones. En los componentes químicos, sus átomos
I. Los orbitales son esféricos. pueden estar ionizados.
II. Los orbitales tienen igual tamaño. Si analizamos al óxido férrico, Fe 2 O 3 ,
III. Si el primer orbital está lleno, entonces encontramos al Fe3+ y O2–, indique la con-
los electrones están apareados. figuración electrónica, respectivamente.
QUÍMICA SAN MARCOS REPASO 2022 - I 7
Átomo - Números cuánticos - Configuración electrónica
Número atómico (Z): O = 8 y Fe = 26. 26. La configuración electrónica simplificada
A) [Ar]4s23d6 y 1s22s22p4 o Kernel utiliza a los gases nobles para
REPASO 1
B) [Ar]4s23d3 y 1s22s22p6 realizar la configuración electrónica de los
C) [Ar]4s03d5 y 1s22s22p6 átomos neutros o de los iones. A un átomo
D) [Ar]4s03d6 y 1s22p22p6 neutro le corresponde la siguiente configu-
ración electrónica simplificada.
23. El aluminio (Z = 13) es un elemento químico [Ar]4s23d3
polielectrónico, cuyos átomos pueden estar ¿Qué proposiciones son incorrectas?
oxidados y otros no oxidado. Con respecto a I. La estructura electrónica del átomo
un átomo no oxidado, indique la secuencia presenta 7 subniveles de energía.
correcta del valor de verdad (V o F) de las II. Tanto el átomo neutro como el argón
siguientes proposiciones: poseen 2 subniveles principales llenos.
I. En el mayor nivel, sus orbitales princi- III. Presenta 4 niveles de energía llenos.
pales, dos están llenos y uno semilleno. A) II y III
II. Sus electrones cumplen con el principio B) solo III
de exclusión de Pauli. C) I y II
III. Al oxidarse el átomo cambia la configu- D) I y III
ración electrónica.
A) VVV B) FVV 27. El arsénico (Z = 33) y sus compuestos son
C) FVF D) VFV tóxicos, está presente de forma natural en
niveles altos en las aguas subterráneas,
24. La fórmula química del óxido de níquel es decir, es un contaminante natural. La
(III) es Ni2O3. Analizando la estructura se absorción puede ser digestiva, cutánea
determinó que cada átomo de níquel es un y pulmonar, depende de su composición
catión trivalente. Determine la configura- química: As3+, As5+, entre otros. Indique
ción electrónica del catión. (Níquel: Z = 28) la distribución electrónica del catión con
A) [Ar]4s23d8 menor carga eléctrica.
B) [Ar]4s03d7 A) [Ar]4s23d104p3
C) [Ne]4s03d7 B) [Ar]4s23d10
D) [Ar] 4s23d5 C) [Ne]4s03d10
D) [Ar]4s23d8
25. Los aniones se generan por reducción del
átomo. Si la configuración electrónica de 28. La configuración electrónica de un átomo,
un anión trivalente es 1s22s22p6 indique la eléctricamente neutro, termina en el sub-
secuencia correcta del valor de verdad (V nivel principal semilleno del tercer nivel
o F) de las siguientes proposiciones: de energía. Indique el número atómico
I. El número atómico es 10. del elemento químico al cual pertenece el
II. Tiene 5 orbitales llenos. átomo.
III. La configuración del átomo neutro A) 33
termina en 2p3. B) 32
A) VVV B) VVF C) 18
C) FVF D) FVV D) 15
8 SAN MARCOS REPASO 2022 - I QUÍMICA
Átomo - Números cuánticos - Configuración electrónica
29. El manganeso (Z = 25) es un metal de color A) FVV B) FVF
blanco plateado, brillante, duro y resistente
REPASO 1
C) VVF D) VFV
al fuego. Se usa en aleaciones de hierro
para fabricar aceros, donde lentamente se 30. Luego de la electrólisis de una sal fundida
oxida; antes de la oxidación se le denomina en el cátodo se depositan isótopos libres y
manganeso metálico. Con respecto a su puros de configuración electrónica terminal
estructura electrónica, indique la secuencia
4s2. Si en uno de los isótopos el número de
correcta del valor de verdad (V o F) de las
neutrones excede al número de protones en
siguientes proposiciones:
dos unidades, indique al isótopo descrito.
I. Sus electrones están distribuidos en 7
A) calcio - 40
subniveles energéticos llenos.
B) calcio - 41
II. En el mayor nivel tiene 2 electrones.
III. Al oxidarse altera su configuración C) calcio - 42
electrónica, pero el núcleo se conserva. D) calcio - 43
QUÍMICA SAN MARCOS REPASO 2022 - I 9
También podría gustarte
- Estructura atómica y números cuánticosDocumento5 páginasEstructura atómica y números cuánticosMilu guevarasanchezAún no hay calificaciones
- Q - Sem - 5 - Estructura Atómica y Números CuánticosDocumento4 páginasQ - Sem - 5 - Estructura Atómica y Números Cuánticoseo salaAún no hay calificaciones
- C - SMS - Qui - B - Átomo IIDocumento4 páginasC - SMS - Qui - B - Átomo IIYENY LIZBETH PEREZ HUILLCAAún no hay calificaciones
- Ceprevi 1-2-3 FormularioDocumento24 páginasCeprevi 1-2-3 FormularioJulianaOréAún no hay calificaciones
- Quimica - Sem 1 - Atomo Numeros CuanticosDocumento4 páginasQuimica - Sem 1 - Atomo Numeros CuanticosDarwin da silva riveraAún no hay calificaciones
- SEMANA 1 Clase - S1 - Quim ESTUDIO DEL ATOMODocumento3 páginasSEMANA 1 Clase - S1 - Quim ESTUDIO DEL ATOMODarwin da silva riveraAún no hay calificaciones
- Química Semana 1Documento2 páginasQuímica Semana 1Danny Toledo CornelioAún no hay calificaciones
- Quimica - Sem 1 - Atomo Numeros Cuanticos PDFDocumento4 páginasQuimica - Sem 1 - Atomo Numeros Cuanticos PDFsteven medinaAún no hay calificaciones
- EL ÁTOMO para La Clase de Hoy 31 01 23Documento3 páginasEL ÁTOMO para La Clase de Hoy 31 01 23janAún no hay calificaciones
- 11 - Quimica 2024-IDocumento18 páginas11 - Quimica 2024-ISergio PoloAún no hay calificaciones
- Material Abner de QuímicaDocumento18 páginasMaterial Abner de QuímicaJaime PeñaAún no hay calificaciones
- Modelos Atomicos para Segundo Grado de Secundaria PDFDocumento6 páginasModelos Atomicos para Segundo Grado de Secundaria PDFDYLAN ALLIN NÚÑEZ GUEVARAAún no hay calificaciones
- 11 - Quimica 2023-IiDocumento4 páginas11 - Quimica 2023-IiJorge Alexander Aguilar CastilloAún no hay calificaciones
- C Sem R1 Química Repaso 1Documento7 páginasC Sem R1 Química Repaso 1Adair GómezAún no hay calificaciones
- 11 Química 2022 IiDocumento24 páginas11 Química 2022 IiWENDY ANGELA MALLQUI BUSTAMANTEAún no hay calificaciones
- Repaso Estrutura Atomica, Conf. Elect, Num Cuanticos TeoriaDocumento4 páginasRepaso Estrutura Atomica, Conf. Elect, Num Cuanticos Teoriaangie luciana yauli acostaAún no hay calificaciones
- El Átomo T - 3Documento2 páginasEl Átomo T - 3Jan End Liam Parlov RGAún no hay calificaciones
- Estructura atómica: partículas fundamentales y composición del átomoDocumento5 páginasEstructura atómica: partículas fundamentales y composición del átomoAntonio Montalvo CorreaAún no hay calificaciones
- Presentación Propuesta de Negocio Empresa Corporativo Azul y VerdeDocumento11 páginasPresentación Propuesta de Negocio Empresa Corporativo Azul y VerdeVincent Marcelo Villafuerte HuancaAún no hay calificaciones
- 11 - Química 2019-I - L1Documento18 páginas11 - Química 2019-I - L1James fernando Arteaga MedinaAún no hay calificaciones
- Cuarto de Secundaria Repaso Química FRIEDMAN PDFDocumento4 páginasCuarto de Secundaria Repaso Química FRIEDMAN PDFJosue Carlos Ramos MenendezAún no hay calificaciones
- Semana 2Documento8 páginasSemana 2Condor Anaya EzequiasAún no hay calificaciones
- Quimica General I Volumen 2007Documento21 páginasQuimica General I Volumen 2007Vidal BarbozaAún no hay calificaciones
- Química 2doDocumento90 páginasQuímica 2doAlexanderAún no hay calificaciones
- Quimica 3ro Secundaria 3Documento39 páginasQuimica 3ro Secundaria 3JEFFERSON HERNANDEZ CARDENASAún no hay calificaciones
- 000 FORMULARIO 1er Examen Parcial 2020 - ATOMOS Y MOLECULAS Y ESTRUCTURA PDFDocumento2 páginas000 FORMULARIO 1er Examen Parcial 2020 - ATOMOS Y MOLECULAS Y ESTRUCTURA PDFDeyna ArAún no hay calificaciones
- Ficha # 01 - Estructura Atómica - 1ºsec-QuímicaDocumento5 páginasFicha # 01 - Estructura Atómica - 1ºsec-QuímicaRafael Vega100% (1)
- RESUMEN QUIMICADocumento4 páginasRESUMEN QUIMICAtiniAún no hay calificaciones
- Semana 1 Estructura AtómicaDocumento2 páginasSemana 1 Estructura AtómicaJORGE LUIS VALDEZ CONDENAAún no hay calificaciones
- SI1-QU-T02-ESTUDIO DEL ÁTOMO (Estructura Atómica)Documento22 páginasSI1-QU-T02-ESTUDIO DEL ÁTOMO (Estructura Atómica)Jorge GuarnízAún no hay calificaciones
- 1 2Documento76 páginas1 2edcarchvAún no hay calificaciones
- Estructura Basica Del Atomo EstudianteDocumento4 páginasEstructura Basica Del Atomo EstudianteKARINAAún no hay calificaciones
- Estructura AtómicaDocumento31 páginasEstructura AtómicaJacobo MartinAún no hay calificaciones
- Modelos-de-Estructura-Atomica-para-Cuarto-de-SecundariaDocumento4 páginasModelos-de-Estructura-Atomica-para-Cuarto-de-Secundariashamira12345uwuAún no hay calificaciones
- Átomos, moléculas e iones: estructura atómica y partículas subatómicasDocumento5 páginasÁtomos, moléculas e iones: estructura atómica y partículas subatómicasManuela De Los SantosAún no hay calificaciones
- Tema n2 IzotoposDocumento6 páginasTema n2 IzotoposAnonymous uHYn00arAún no hay calificaciones
- Química: DOCENTE: Paul Condor R. Semana: 10Documento37 páginasQuímica: DOCENTE: Paul Condor R. Semana: 10Estela VivianaAún no hay calificaciones
- 3ro SecDocumento39 páginas3ro SecLena Bautista CastilloAún no hay calificaciones
- Rreforzamiento 02-Teoría y PrácticaDocumento5 páginasRreforzamiento 02-Teoría y PrácticaSegundo FernandezAún no hay calificaciones
- Química - Semana 02 - Ciclo Semianual - Estudio Del ÁtomoDocumento21 páginasQuímica - Semana 02 - Ciclo Semianual - Estudio Del Átomocarmen fuertesAún no hay calificaciones
- ATOMODocumento3 páginasATOMO71576500Aún no hay calificaciones
- S2-El ÁtomoDocumento34 páginasS2-El ÁtomomemessAún no hay calificaciones
- Clase 3 Atomo y Elementos QuímicosDocumento30 páginasClase 3 Atomo y Elementos QuímicosCarlos Enrique Arias SánchezAún no hay calificaciones
- NUCLIDOS PRIMDocumento4 páginasNUCLIDOS PRIMReynaldo Mamani mamaniAún no hay calificaciones
- Sem 04A Atomo Moderno II - Numeros Cuanticos) EA - C4Documento7 páginasSem 04A Atomo Moderno II - Numeros Cuanticos) EA - C4Pool Posada100% (1)
- 3.1 Diapositivas ESTRUCTURA ELECTRÓNICA I ALEDocumento22 páginas3.1 Diapositivas ESTRUCTURA ELECTRÓNICA I ALEAnyhella Raquel Alexandra Sauñe PeralesAún no hay calificaciones
- HOLADocumento5 páginasHOLASilvia Paola Méndez SánchezAún no hay calificaciones
- 03-Química Ciclo Intensivo 2023Documento33 páginas03-Química Ciclo Intensivo 2023FernandaAún no hay calificaciones
- Clase 1 Estructura AtómicaDocumento19 páginasClase 1 Estructura AtómicaAlexia Ayelén Durán ManzanelliAún no hay calificaciones
- Guía de Exploración Propiedades Atomicas Quimica 1,2Documento3 páginasGuía de Exploración Propiedades Atomicas Quimica 1,2Anonymous gSWfC8a5Aún no hay calificaciones
- Filemd8109-2024-01-06 13-49-42Documento34 páginasFilemd8109-2024-01-06 13-49-42GretelAún no hay calificaciones
- Quimica 3roDocumento3 páginasQuimica 3roTaehyung KimAún no hay calificaciones
- Modelos Atómicos y TeoríasDocumento1 páginaModelos Atómicos y TeoríasDaniel MartelAún no hay calificaciones
- TEORIA Y MODELO ATÓMICO - Rev PDFDocumento1 páginaTEORIA Y MODELO ATÓMICO - Rev PDFAngeles LaraAún no hay calificaciones
- Mapa Conceptual Química. Plan Común PSUDocumento7 páginasMapa Conceptual Química. Plan Común PSUDaniel BurtonAún no hay calificaciones
- Quimica - Semana 3 AtomoDocumento2 páginasQuimica - Semana 3 AtomoFelix Paolo Valladolid ZetaAún no hay calificaciones
- Particulas SubatomicasDocumento2 páginasParticulas SubatomicasAnthony Martinez MendozaAún no hay calificaciones
- ÁTOMODocumento17 páginasÁTOMOgamarratizaalexAún no hay calificaciones
- Átomo: partículas subatómicas, núcleo atómico, carga del átomoDocumento26 páginasÁtomo: partículas subatómicas, núcleo atómico, carga del átomoJorge TorresAún no hay calificaciones
- Filosofía - Repaso 4 - Filosofía Peruana y LatinoamericanaDocumento6 páginasFilosofía - Repaso 4 - Filosofía Peruana y LatinoamericanaEnrique PuenteAún no hay calificaciones
- Geom - R4 - Relaciones Métricas en La Circunferencia, Triángulos, Rectángulos y Triángulos Oblicuángulos - Tarea.....Documento2 páginasGeom - R4 - Relaciones Métricas en La Circunferencia, Triángulos, Rectángulos y Triángulos Oblicuángulos - Tarea.....Enrique PuenteAún no hay calificaciones
- Geometría - Repaso Intro - Segmento de Recta y ÁngulosDocumento7 páginasGeometría - Repaso Intro - Segmento de Recta y ÁngulosKattyAún no hay calificaciones
- Geometria - Intro 2..Documento5 páginasGeometria - Intro 2..Enrique PuenteAún no hay calificaciones
- Psicologia R6 Desarrollo Humano I TareaDocumento3 páginasPsicologia R6 Desarrollo Humano I TareaAnaly Vida Cabezas BautistaAún no hay calificaciones
- Geometria - R1 - Triángulo y Congruencia de TriángulosDocumento9 páginasGeometria - R1 - Triángulo y Congruencia de TriángulosEnrique PuenteAún no hay calificaciones
- Geom - R4 - Relaciones Métricas en La Circunferencia, Triángulos, Rectángulos y Triángulos OblicuángulosDocumento7 páginasGeom - R4 - Relaciones Métricas en La Circunferencia, Triángulos, Rectángulos y Triángulos OblicuángulosEnrique PuenteAún no hay calificaciones
- Biologia - R1 - Fotosíntesis y Respiración Celular - TareaDocumento3 páginasBiologia - R1 - Fotosíntesis y Respiración Celular - TareaEnrique PuenteAún no hay calificaciones
- Biología - Repaso 4 - Sistema Digestivo y Circulatorio HumanoDocumento7 páginasBiología - Repaso 4 - Sistema Digestivo y Circulatorio HumanoEnrique PuenteAún no hay calificaciones
- Biologia - Repaso 2 - Ciclo Celular, Mitosis y MeiosisDocumento6 páginasBiologia - Repaso 2 - Ciclo Celular, Mitosis y MeiosisEnrique PuenteAún no hay calificaciones
- Biología - R4 - Sistema Digestivo y Circulatorio Humano - TareaDocumento3 páginasBiología - R4 - Sistema Digestivo y Circulatorio Humano - TareaNayla chuquipomaAún no hay calificaciones
- Biologia - Repaso 2 - Ciclo Celular, Mitosis y Meiosis - TareaDocumento3 páginasBiologia - Repaso 2 - Ciclo Celular, Mitosis y Meiosis - TareaEnrique PuenteAún no hay calificaciones
- Geometria - Rep Intro - Segmento de Recta y Ángulos - TareaDocumento2 páginasGeometria - Rep Intro - Segmento de Recta y Ángulos - TareaEnrique PuenteAún no hay calificaciones
- EVA IntroductorioDocumento3 páginasEVA IntroductorioKenny LopezAún no hay calificaciones
- EndocrinoDocumento18 páginasEndocrinoEnrique PuenteAún no hay calificaciones
- Biologia - Repaso 5 - Sistema Nervioso y Endocrino HumanoDocumento8 páginasBiologia - Repaso 5 - Sistema Nervioso y Endocrino HumanoEnrique PuenteAún no hay calificaciones
- PPT BotánicaDocumento49 páginasPPT BotánicaEnrique PuenteAún no hay calificaciones
- Biologia - Intro 2Documento11 páginasBiologia - Intro 2Enrique PuenteAún no hay calificaciones
- Literatura - R1 - Teoría LiterariaDocumento6 páginasLiteratura - R1 - Teoría LiterariaEnrique PuenteAún no hay calificaciones
- Biologia - Rep - Introductorio - Bioquímica y Expresión Génica - TareaDocumento3 páginasBiologia - Rep - Introductorio - Bioquímica y Expresión Génica - TareaEnrique PuenteAún no hay calificaciones
- Lit - R2 - Conceptos Narrativos BásicosDocumento8 páginasLit - R2 - Conceptos Narrativos BásicosEnrique PuenteAún no hay calificaciones
- Repaso económicoDocumento3 páginasRepaso económicoEnrique PuenteAún no hay calificaciones
- Semana 13 EQUILIBRIO QUIMICO E IONICO OkDocumento52 páginasSemana 13 EQUILIBRIO QUIMICO E IONICO OkEnrique PuenteAún no hay calificaciones
- Ejercicios de RepasoDocumento4 páginasEjercicios de RepasoEnrique PuenteAún no hay calificaciones
- 2da Tarea CBQDocumento26 páginas2da Tarea CBQEnrique PuenteAún no hay calificaciones
- Leyes de los gases idealesDocumento18 páginasLeyes de los gases idealesEnrique PuenteAún no hay calificaciones
- Evaluación Semana Intro 2Documento4 páginasEvaluación Semana Intro 2Enrique PuenteAún no hay calificaciones
- Universidad Nacional Mayor de San Marcos: Cálculos Básicos en QuímicaDocumento11 páginasUniversidad Nacional Mayor de San Marcos: Cálculos Básicos en QuímicaEnrique PuenteAún no hay calificaciones
- E - R3 - La Circulación - El Mercado y Clases - Economía InformalDocumento8 páginasE - R3 - La Circulación - El Mercado y Clases - Economía InformalEnrique PuenteAún no hay calificaciones
- Cálculos básicos de concentraciones químicasDocumento27 páginasCálculos básicos de concentraciones químicasEnrique PuenteAún no hay calificaciones
- Actividad de Puntos Evaluables - Escenario 2 - SEGUNDO BLOQUE-CIENCIAS BASICAS - FUNDAMENTOS DE QUIMICA - (GRUPO10)Documento4 páginasActividad de Puntos Evaluables - Escenario 2 - SEGUNDO BLOQUE-CIENCIAS BASICAS - FUNDAMENTOS DE QUIMICA - (GRUPO10)Yesica TatianaAún no hay calificaciones
- WolframioDocumento13 páginasWolframioRoDney Yefry LimachiAún no hay calificaciones
- Informe Laboratorio 5Documento14 páginasInforme Laboratorio 5juancito bonitoAún no hay calificaciones
- Qué Son Los Metales y Los No MetalesDocumento17 páginasQué Son Los Metales y Los No Metalesjanet palmaAún no hay calificaciones
- HierroFundidoGrisDocumento50 páginasHierroFundidoGrisDavid EstradaAún no hay calificaciones
- Estructura atómica y partículas subatómicasDocumento9 páginasEstructura atómica y partículas subatómicasJennifer PinalesAún no hay calificaciones
- 228 Cotizacion Reparacion Maquina de Envasado AmpóllasDocumento4 páginas228 Cotizacion Reparacion Maquina de Envasado AmpóllasKamila ZarateAún no hay calificaciones
- Impri MirDocumento2 páginasImpri Mir3m david VillasanteAún no hay calificaciones
- Propulsores de CohetesDocumento72 páginasPropulsores de Cohetesjoel141Aún no hay calificaciones
- Oxidacion de ClavoDocumento7 páginasOxidacion de ClavoRoy Amaro KF50% (2)
- Aniones CompletoDocumento16 páginasAniones Completojavier calleAún no hay calificaciones
- Determinacion de Alcalinidad, Dureza y ClorurosDocumento15 páginasDeterminacion de Alcalinidad, Dureza y ClorurosMariana GSAún no hay calificaciones
- 3 Evaluación DistanciaDocumento6 páginas3 Evaluación DistanciaHelena LayuntaAún no hay calificaciones
- Tds FX Rivet HG Ext - Recorgraph - Rev01 (Es)Documento2 páginasTds FX Rivet HG Ext - Recorgraph - Rev01 (Es)Victor MaldonadoAún no hay calificaciones
- SGS MN Me 106R03Documento6 páginasSGS MN Me 106R03Erick Garcia RiosAún no hay calificaciones
- Ecuaciones de reacciones químicas y propiedades del acetilenoDocumento2 páginasEcuaciones de reacciones químicas y propiedades del acetilenoFredy GomezAún no hay calificaciones
- Leyes de Faraday-CobreadoDocumento7 páginasLeyes de Faraday-Cobreadoanon_934226868Aún no hay calificaciones
- Ingenieria de Procesos - Palacios C. Severo - 1ra EdicionDocumento151 páginasIngenieria de Procesos - Palacios C. Severo - 1ra EdicionsirercksAún no hay calificaciones
- 10 Egb QuímicaDocumento8 páginas10 Egb QuímicaPaola PaucarimaAún no hay calificaciones
- Química Aritmética: Unidades, Mol, FórmulasDocumento56 páginasQuímica Aritmética: Unidades, Mol, FórmulasJorge Gavino Alomía100% (1)
- Química 2o Bachillerato: Ejercicios de Equilibrio QuímicoDocumento7 páginasQuímica 2o Bachillerato: Ejercicios de Equilibrio QuímicoLeticiaGonzálezAún no hay calificaciones
- Reconocimiento de Acidos y EsteresDocumento14 páginasReconocimiento de Acidos y EstereschabeliAún no hay calificaciones
- HELICOCIENCIADocumento2 páginasHELICOCIENCIARosario Sanchez ArceAún no hay calificaciones
- Unidad de Masa AtomicaDocumento7 páginasUnidad de Masa Atomicaalmenar24Aún no hay calificaciones
- Taller Número 2Documento2 páginasTaller Número 2Francisco EstebanAún no hay calificaciones
- FormulasDocumento12 páginasFormulasOswaldo Baquero RubioAún no hay calificaciones
- 19.10.2023 Practica Calificada Quimica 3ero - Redox Iv BimestreDocumento3 páginas19.10.2023 Practica Calificada Quimica 3ero - Redox Iv BimestreRomulo FranciscoAún no hay calificaciones
- Materia SimpleDocumento8 páginasMateria SimpleSebastián HernándezAún no hay calificaciones
- Organometalica PDFDocumento191 páginasOrganometalica PDFSebastian BachvAún no hay calificaciones
- Formato Inspección Areas 2011Documento11 páginasFormato Inspección Areas 2011maac1987Aún no hay calificaciones