Documentos de Académico
Documentos de Profesional
Documentos de Cultura
DESARROLLO
Cargado por
Sempiterno ARose0 calificaciones0% encontró este documento útil (0 votos)
4 vistas2 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
4 vistas2 páginasDESARROLLO
Cargado por
Sempiterno ARoseCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
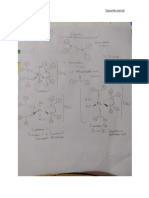
Para llevar a cabo el desarrollo de los siguientes experimentos, esto se dividieron
en dos secciones dependiendo del tipo de reactivos a utilizar.
Parte 1: Neutralización de un ácido fuerte con una base fuerte.
Para la construcción de nuestro sistema, colocamos la bureta graduada de 25 mL
en el soporte universal sujetada por unas pinzas a una altura cercana a la de un
matraz que se utilizaran para la titulación de soluciones.
Primeramente, se vacío el hidróxido de sodio (sustancia que fue almacenada de la
practica anterior) en uno de los vasos de precipitado; con ayuda del embudo de
vidrio se vertió dentro de la bureta hasta que esta estuviera aforada a cero. En
esta primera medida, no se presentó un exceso de solución; en caso de ser si,
colocar el mismo vaso de precipitad por debajo de la llave, abrir esta lentamente
hasta alcanzar el valor de cero. Ahora bien, haciendo uso de la pipeta volumétrica,
medimos 5 mL de ácido clorhídrico (disolución igualmente preparada en la practica
anterior) y se vertió dentro de un matraz Erlenmeyer para finalmente, agregar 45
ml de agua destilada proveniente de la peseta, medida con ayuda de la probeta de
50 mL.
A diferencia de la cantidad sugerida a agregar en el HCl de fenolftaleína
(C20H14O4), para este primer experimento se añadieron 5 gotas al HCl; notando a
simple vista como está aún mantiene una apariencia incolora.
Una vez concluido este paso, colocamos el matraz debajo de la bureta e iniciamos
la titulación con el NaOH abriendo con la mano izquierda la llave de este
instrumento, dejando caer gota a gota la disolución que contiene; la mano derecha
agitara el matraz con movimientos circulares y constantes, siempre que se siga
agregando NaOH al HCl. Tras el pasar de unos minutos, notamos como el HCl
vira hacia una tonalidad rosa pálido, una vez que se le añadió 6 mL de hidróxido
de sodio.
Una vez concluido este paso y registrado el volumen que se utilizó; volvemos a
aforar la bureta hasta cero con NaOH. Repetimos el procedimiento de la disolución
de HCl en los 45 mL de agua; agregamos 2 gotas del indicador de anaranjado de
metileno, tomando de forma inmediata, una coloración rojiza.
Colocamos el matraz Erlenmeyer debajo de la bureta y comenzamos la titulación
con NaOH mantenido la postura y movimientos señalados con anterioridad. A
diferencia del apartado anterior, se necesitó de 5.4 mL de hidróxido de sodio para
que el HCl vire hacia un color amarillo.
Parte 2: Neutralización de un ácido débil con una base fuerte.
El primer experimento se hará a partir de un acido débil, el acido cítrico presente
en los refrescos. Este es un ácido orgánico tricarboxílico que está presente en la
mayoría de las frutas, sobre todo en cítricos como el limón y la naranja.
Antes de comenzar a hacer las medidas correspondientes, vaciamos una pequeña
cantidad del refresco dentro de un vaso de precipitado con el fin de liberar el gas
de ácido carbónico que contiene. Ahora, con ayuda de la pipeta volumétrica,
medimos 5 mL de refresco de limón; verter esto dentro de un matraz Erlenmeyer
al igual que 45 mL de agua destilada calculados con ayuda de una probeta.
Después, se agregaron dos gotas de fenolftaleína. Antes de comenzar la
titulación, revisamos que la bureta se encuentre aforada a cero con el NaOH. Una
vea concluido este paso, colocaos el matraz de Erlenmeyer por debajo de la
bureta, abrimos la llave de tal forma que solo salgan gotas de forma periódica
mientras agitamos con nuestra mano derecha el matraz. Detener una vez que la
disolución haya cambiado a una coloración pálida. En este caso, ara que el
refresco vire a un rosa pálido, se requirieron 2.4 mL de NaOH.
Repetimos el mismo procedimiento de preparación tanto del refresco (tomando la
cantidad necesaria a partir del vaso de precipitado que contiene el refresco sin
gas) y la bureta (aforar hasta cero); con la excepción de que, en vez de agregar 2
gotas de fenolftaleína, se vertieron la misma cantidad ahora con el indicador de
anaranjado de metileno (tomando, inmediatamente, una tonalidad rojiza).
Comenzamos la titulación agregando gotas de NaOH al refresco que contiene el
matraz Erlenmeyer. En este caso, para que esta disolución presentara su primer
cambio de coloración, a una tonalidad amarilla, se requirieron 0.8 mL de NaOH.
Por último, repetimos este procedimiento solo que, nuestro acido débil es el acido
acético del vinagre. Para ello, con ayuda de una pipeta volumétrica medimos 1 mL
de vinagre agregándola a un matraz Erlenmeyer al igual que 29 mL de agua
destilada de la pizeta, medidos a partir de una probeta. Finalmente, agregamos 5
gotas de fenolftaleína a la disolución. Antes de iniciar con la titulación, revisamos
que la bureta se encuentre aforada a cero. Colocamos el matraz Erlenmeyer por
debajo de la bureta, abrimos la llave y dejamos caer gota a gota hasta que esta
comience a tomar una coloración rosa pálido, para ello, se requirieron 9 mL de
NaOH.
Una vez terminado este experimento; repetimos los pasos anteriores con respecto
a la preparación de la disolución del vinagre y la medida de hidróxido de sodio en
la bureta; solamente que, en vez de agrega la fenolftaleína, agregamos 2 gotas de
anaranjado de metileno (la cual, toma una coloración rojiza) y comenzaos con la
titulación. Para que esta disolución vire hacia el naranja, se requieren 1.5 mL de
NaOH
También podría gustarte
- Práctica 7 - InformaciónDocumento12 páginasPráctica 7 - InformaciónSempiterno ARoseAún no hay calificaciones
- Problemas Ciclos (Termodinámica) PDFDocumento28 páginasProblemas Ciclos (Termodinámica) PDFSempiterno ARoseAún no hay calificaciones
- Orbitales Atomicos, Nodos Radiales o Angulares y Numeros Cuanticos - Lic. QuimicaDocumento16 páginasOrbitales Atomicos, Nodos Radiales o Angulares y Numeros Cuanticos - Lic. QuimicaSempiterno ARoseAún no hay calificaciones
- Tafel y CineticaDocumento9 páginasTafel y CineticaAlex RiosAún no hay calificaciones
- Prácticas de Reacciones OrgánicasDocumento8 páginasPrácticas de Reacciones OrgánicasSempiterno ARoseAún no hay calificaciones
- Prácticas de Reacciones OrgánicasDocumento8 páginasPrácticas de Reacciones OrgánicasSempiterno ARoseAún no hay calificaciones
- Problemas Ciclos (Termodinamica)Documento28 páginasProblemas Ciclos (Termodinamica)Sempiterno ARoseAún no hay calificaciones
- Modelo de La Mecanica Cuantica - Introducción A La QuimicaDocumento3 páginasModelo de La Mecanica Cuantica - Introducción A La QuimicaSempiterno ARoseAún no hay calificaciones
- 03 Tablas de Combinación y Asignación de GSP - RVBADocumento6 páginas03 Tablas de Combinación y Asignación de GSP - RVBASempiterno ARoseAún no hay calificaciones
- Mol - Introduccion A La QuimicaDocumento3 páginasMol - Introduccion A La QuimicaSempiterno ARoseAún no hay calificaciones
- Pregunta 1: Rocha Villegas: 398156Documento2 páginasPregunta 1: Rocha Villegas: 398156Sempiterno ARoseAún no hay calificaciones
- Tipos de Materia - Introduccion A La QuimicaDocumento3 páginasTipos de Materia - Introduccion A La QuimicaSempiterno ARoseAún no hay calificaciones
- Ley de Dalton (Termodinamica) - Problemas y SolucionesDocumento4 páginasLey de Dalton (Termodinamica) - Problemas y SolucionesSempiterno ARoseAún no hay calificaciones
- Nomenclatura de Compuestos Inorganicos - Lic en QuimicaDocumento14 páginasNomenclatura de Compuestos Inorganicos - Lic en QuimicaSempiterno ARoseAún no hay calificaciones
- UntitledDocumento4 páginasUntitledSempiterno ARoseAún no hay calificaciones
- Pregunta 7: Rocha Villegas: 398156Documento2 páginasPregunta 7: Rocha Villegas: 398156Sempiterno ARoseAún no hay calificaciones
- Estequiometria y Composicion Porcentual - Lic QuimicaDocumento14 páginasEstequiometria y Composicion Porcentual - Lic QuimicaSempiterno ARoseAún no hay calificaciones
- Actividad 3.8 Cuenta 398156Documento9 páginasActividad 3.8 Cuenta 398156Sempiterno ARoseAún no hay calificaciones
- Hojas de Seguridad - ReaccionesDocumento4 páginasHojas de Seguridad - ReaccionesSempiterno ARoseAún no hay calificaciones
- Actividad 3.8: No. Cuenta: 398156Documento9 páginasActividad 3.8: No. Cuenta: 398156Sempiterno ARoseAún no hay calificaciones
- UntitledDocumento4 páginasUntitledSempiterno ARoseAún no hay calificaciones
- Pregunta 7Documento1 páginaPregunta 7Sempiterno ARoseAún no hay calificaciones
- Look A LikeDocumento1 páginaLook A LikeSempiterno ARoseAún no hay calificaciones
- Mapa 1 BARVDocumento3 páginasMapa 1 BARVSempiterno ARoseAún no hay calificaciones
- Hojas de Seguridad - OrgánicaDocumento6 páginasHojas de Seguridad - OrgánicaSempiterno ARoseAún no hay calificaciones
- Mapa 3 BARVDocumento4 páginasMapa 3 BARVSempiterno ARoseAún no hay calificaciones
- Survivor's ResolveDocumento139 páginasSurvivor's ResolveSempiterno ARoseAún no hay calificaciones
- Hojas de Seguridad Práctica DosDocumento10 páginasHojas de Seguridad Práctica DosSempiterno ARoseAún no hay calificaciones
- Propiedades Alcohol EtílicoDocumento7 páginasPropiedades Alcohol EtílicoSempiterno ARoseAún no hay calificaciones
- Hoja de Seguridad FisicoquimicaDocumento5 páginasHoja de Seguridad FisicoquimicaSempiterno ARoseAún no hay calificaciones
- FrutaDocumento3 páginasFrutaGemaAún no hay calificaciones
- Gloria Ampliación en Sentido Ascendente, Ampliación en Dos Sentidos, Completar La Linea de Productos.Documento4 páginasGloria Ampliación en Sentido Ascendente, Ampliación en Dos Sentidos, Completar La Linea de Productos.Josué Pérez MejíaAún no hay calificaciones
- Bienestarina FresaDocumento4 páginasBienestarina FresaGisela DiazAún no hay calificaciones
- Guia # 1 Control de Calidad Ficha 2143740 - 2143785 - 2183282Documento8 páginasGuia # 1 Control de Calidad Ficha 2143740 - 2143785 - 2183282Control De Calidad De Alimentos MICROBIOLOGIAAún no hay calificaciones
- 4a.cultivo de Caña de AzúcarDocumento94 páginas4a.cultivo de Caña de AzúcarLuiggui Rojas NavarroAún no hay calificaciones
- Las OvejasDocumento2 páginasLas Ovejasquemasda quemasdaAún no hay calificaciones
- NutriReto 21 Receta 15Documento4 páginasNutriReto 21 Receta 15Dilan PerezAún no hay calificaciones
- Proyectos Realizados A Nivel InternacionalDocumento2 páginasProyectos Realizados A Nivel InternacionalcarinaAún no hay calificaciones
- Definiciones Sobre El Contrabando y Otros Delitos AduanerosDocumento192 páginasDefiniciones Sobre El Contrabando y Otros Delitos Aduanerosmanuoca29Aún no hay calificaciones
- Había Una Vez Un Rey Que Tenía Tres HijosDocumento5 páginasHabía Una Vez Un Rey Que Tenía Tres HijosLibanielGuzmanZAún no hay calificaciones
- Taller S. AureusDocumento6 páginasTaller S. AureusGeraldíne CapachoAún no hay calificaciones
- TRABAJO GASTRONOMIA - EntregaDocumento22 páginasTRABAJO GASTRONOMIA - EntregaRoberto Cedano SerranoAún no hay calificaciones
- FUENTE: Servicio de Información Agroalimentaria y Pesquera (SIAP-SADER)Documento8 páginasFUENTE: Servicio de Información Agroalimentaria y Pesquera (SIAP-SADER)Pasaportes MxAún no hay calificaciones
- Arquitectura y Agricuktura de ChavinDocumento1 páginaArquitectura y Agricuktura de ChavinPilar AuccacusiAún no hay calificaciones
- Sesión de Aprendizaje Ciencia - Los AlimentosDocumento5 páginasSesión de Aprendizaje Ciencia - Los Alimentosmonicaa.t2608Aún no hay calificaciones
- Cafe de QuinuaDocumento12 páginasCafe de QuinuaLaura Violeta Vilcherrez ViteAún no hay calificaciones
- Macronutrientes y Micronutrientes Del Suelo y Su Influencia en El Desarrollo de Las Plantas (GUÍA Y PRÁCTICO N 6) 3ro 3raDocumento4 páginasMacronutrientes y Micronutrientes Del Suelo y Su Influencia en El Desarrollo de Las Plantas (GUÍA Y PRÁCTICO N 6) 3ro 3raNoelia Sanchez100% (2)
- Catalogo Totis Edicion 3Documento13 páginasCatalogo Totis Edicion 3Lupita García RiveraAún no hay calificaciones
- Inspección sanitaria mercadosDocumento5 páginasInspección sanitaria mercadosAna Carolina Rojano BuelvasAún no hay calificaciones
- Antecedente Nacional 02Documento170 páginasAntecedente Nacional 02Sandy Viali Yauricasa TorneroAún no hay calificaciones
- Guía Final Fantasy XV PDFDocumento54 páginasGuía Final Fantasy XV PDFgiselle0% (1)
- ProporcionalidadDocumento16 páginasProporcionalidadAdriano Neumann TempleAún no hay calificaciones
- Aporte Individual Marolin HernandezDocumento9 páginasAporte Individual Marolin HernandezCristian Camilo SanchezAún no hay calificaciones
- Elaboración de Una Bebida Rehidratante A Base de Suero LacteoDocumento88 páginasElaboración de Una Bebida Rehidratante A Base de Suero Lacteoluis medina mAún no hay calificaciones
- Triptico Selva Central 2023Documento4 páginasTriptico Selva Central 2023Ricardo Brañes ChachiAún no hay calificaciones
- Mise en PlaceDocumento5 páginasMise en PlaceANA GISELA GALLEGOS CORDOVAAún no hay calificaciones
- Constitución de CompañíasDocumento7 páginasConstitución de Compañíasthailydayana gonzalezAún no hay calificaciones
- Perfil Competencia Administrador de CasinosDocumento9 páginasPerfil Competencia Administrador de CasinosCate Lopez TapiaAún no hay calificaciones
- Ejercicio Perdidos en La Luna Con Tabla AdjuntaDocumento2 páginasEjercicio Perdidos en La Luna Con Tabla AdjuntaJosé ManuelAún no hay calificaciones
- ArangoDocumento3 páginasArangoHUGUES RAFAEL HUGUES RAFAELAún no hay calificaciones