Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Temperatura Crítica y Presión Crítica
Cargado por
Jessica ReguerinDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Temperatura Crítica y Presión Crítica
Cargado por
Jessica ReguerinCopyright:
Formatos disponibles
next up previous contents
Next: Tensión superficial Up: Notas de Físico-Química Estados Previous: Punto ebullición
Contents
Temperatura crítica y presión crítica
La manera obvia de cambiar a un gas en un líquido es enfriarlo a una temperatura por
debajo de su punto de ebullición. Hay otra manera de condensar un gas para formar un
líquido, sin embargo, implica aumentar la presión en el gas. Los líquidos hierven a la
temperatura a la cual la presión del vapor es igual a la presión del líquido con sus
alrededores. Elevar la presión en un gas por lo tanto aumenta con eficacia el punto de
ebullición del líquido.
Suponga que tenemos vapor de agua (o vapor) en un envase cerrado a 120 y 1 atmósfera
de presión. Puesto que la temperatura del sistema está sobre el punto de ebullición del agua,
no hay razón para que el vapor condense para formar un líquido. Nada sucede hasta que
comprimimos lentamente el envase de tal modo que se eleva la presión del gas hasta que la
presión alcanza 2 atmósferas. En este punto, el sistema está en el punto de ebullición en el
que hierve el agua y algo del gas se condensará para formar un líquido. Tan pronto como la
presión en el gas exceda 2 atmósferas, la presión del vapor del agua a 120 no es lo
bastante grande para que el líquido hierva. El gas por lo tanto condensa para formar un
líquido, como se indica en la figura [*] .
Figure: Mezcla saturada líquido-vapor
En teoría, deberíamos poder predecir la presión a la cual un gas condensa a una temperatura
dada consultando un diagrama de presión del vapor contra temperatura . En la práctica, cada
compuesto tiene una temperatura crítica ( ). Si la temperatura del gas está sobre la
temperatura crítica, el gas no se puede condensar, sin importar la presión aplicada.
La existencia de una temperatura crítica fue descubierta por Thomas Andrews en 1869
mientras que estudiaba el efecto de la temperatura y de la presión en el comportamiento del
bióxido de carbono. Andrews encontró que él podría condensar el gas del CO en un líquido
elevando la presión en el gas, mientras él mantuvo la temperatura por debajo de 31.0 A
esta temperatura se requiere de una presión de 72.85 atmósferas para licuefacer el gas de
CO . Andrews encontró que era imposible convertir gas de CO en líquido por encima de
esta temperatura, no importaba que tanta presión se aplicara.
Los gases no se pueden licuefacer a temperaturas por encima de la temperatura crítica
porque en este punto las características de los gases y de los líquidos son las mismas, y no
hay base sobre la cual distinguir entre los gases y los líquidos. La presión del vapor de un
líquido a la temperatura crítica se llama la presión crítica ( ). La presión del vapor de un
líquido nunca es más grande que esta presión crítica.
Las temperaturas críticas, las presiones críticas, y los puntos ebullición de varios gases se
escriben en la tabla [*] . Hay una correlación obvia entre la temperatura crítica y el punto de
ebullición de estos gases. Estas propiedades están relacionadas porque ambas son medidas
indirectas de la fuerza de atracción entre las partículas en la fase gaseosa.
Table: Temperatura y presión crítica y punto de
ebullició de gases comunes.
Gas ( ) ( ) P. de Ebullición ( )
He -267.96 2.261 -268.94
H -240.17 12.77 -252.76
Ne -228.71 26.86 -246.1
N -146.89 33.54 -195.81
CO -140.23 34.53 -191.49
Ar -122.44 48.00 -185.87
O -118.38 50.14 -182.96
CH -82.6 45.44 -161.49
CO 31.04 72.85 -78.44
NH 132.4 111.3 -33.42
Cl 144.0 78.1 -34.03
Los valores experimentales de la temperatura y de la presión críticas de una sustancia se
pueden calcular al utilizar las constantes de a y de b en la ecuación de van der Waals.
(2)
donde las constantes y se pueden calcular a partir de sus puntos críticos de temperatura y
presión (ver problema 2):
(3)
(4)
next up previous contents
Next: Tensión superficial Up: Notas de Físico-Química Estados Previous: Punto ebullición
Contents
Oscar Jaramillo 2007-04-25
También podría gustarte
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Apuntes QuimicaDocumento13 páginasApuntes QuimicaJAZMIN DIMASAún no hay calificaciones
- Temperatura Crítica y Presión CríticaDocumento3 páginasTemperatura Crítica y Presión CríticaAlejandra CampuzanoAún no hay calificaciones
- Capitulo Nro. 1 - Clasificacion de Los Fluidos en El Reservorio PDFDocumento34 páginasCapitulo Nro. 1 - Clasificacion de Los Fluidos en El Reservorio PDFjesusAún no hay calificaciones
- Propiedades ColigativasDocumento28 páginasPropiedades ColigativasrereAún no hay calificaciones
- Equilibrio de Fases en Sustancias PurasDocumento17 páginasEquilibrio de Fases en Sustancias PurasJacson Rios OjanamaAún no hay calificaciones
- Gas RealDocumento23 páginasGas RealAlejandra Adrian TejadaAún no hay calificaciones
- Tarea 2Documento7 páginasTarea 2clafequisaAún no hay calificaciones
- Tarea 2Documento5 páginasTarea 2Maria Jose Lagos GutierrezAún no hay calificaciones
- Presion de Vapor1Documento15 páginasPresion de Vapor1Carolina UrazánAún no hay calificaciones
- T1sem2002 04Documento15 páginasT1sem2002 04andyandy888Aún no hay calificaciones
- Taller n3 Punto 3Documento9 páginasTaller n3 Punto 3Andrey LopezAún no hay calificaciones
- Práctica 3 FQ Ago-Dic-13Documento6 páginasPráctica 3 FQ Ago-Dic-13Roberto MatehualaAún no hay calificaciones
- Determinacion Peso Molecular Esime ZacDocumento11 páginasDeterminacion Peso Molecular Esime ZacMondragón AbelAún no hay calificaciones
- Capitulo Nro. 1 - Clasificacion de Los Fluidos en El ReservorioDocumento37 páginasCapitulo Nro. 1 - Clasificacion de Los Fluidos en El Reservoriocanva cuentaAún no hay calificaciones
- Ecuación de Estado + Tablas TermodinámicasDocumento2 páginasEcuación de Estado + Tablas TermodinámicasBetsabe AlmeidaAún no hay calificaciones
- Tarea Semana 2 - Alexis - Baeza-Rev HM 9Documento6 páginasTarea Semana 2 - Alexis - Baeza-Rev HM 9ale artysAún no hay calificaciones
- Guia de Lab - Ley de CharlesDocumento7 páginasGuia de Lab - Ley de CharlesMaria JoseAún no hay calificaciones
- Informe 4Documento8 páginasInforme 4Paola MenendezAún no hay calificaciones
- Termo 3Documento36 páginasTermo 3José Emilio GuardiaAún no hay calificaciones
- Cap.2 Clasificacion de Los Fluidos en El Reservorio-1Documento20 páginasCap.2 Clasificacion de Los Fluidos en El Reservorio-1juan carlosAún no hay calificaciones
- Diagramas PVDocumento16 páginasDiagramas PVSoledad Rubio GadaletaAún no hay calificaciones
- Informe N°1 (Equilibrio Liquido-Vapor para Sustancias Puras) Grupo 4Documento19 páginasInforme N°1 (Equilibrio Liquido-Vapor para Sustancias Puras) Grupo 4Frank BustosAún no hay calificaciones
- Presion de Vapor de Liquidos PurosDocumento12 páginasPresion de Vapor de Liquidos PurosLeslyAún no hay calificaciones
- INFORME Lab. 2 Fisico Quimica Presion de VaporDocumento4 páginasINFORME Lab. 2 Fisico Quimica Presion de VaporpablodanielarandaAún no hay calificaciones
- Sistemas MultifásicosDocumento66 páginasSistemas MultifásicosRene Josue Reyna TovarAún no hay calificaciones
- Act. Eva. 2.1 - Karla Paola Curiel MontufarDocumento7 páginasAct. Eva. 2.1 - Karla Paola Curiel MontufarPaola MontufarAún no hay calificaciones
- Ecuación de Estado para Gases RealesDocumento13 páginasEcuación de Estado para Gases RealesCristian Ccaso MamaniAún no hay calificaciones
- Taller 3 - Practica Calificada - Calculos Básicos en Química GeneralDocumento39 páginasTaller 3 - Practica Calificada - Calculos Básicos en Química GeneralHermes BravoAún no hay calificaciones
- Informe de Gases IdealesDocumento8 páginasInforme de Gases IdealesJulio Cesar CancioAún no hay calificaciones
- S2 Interactivo Microactividad Profundizacion Acc Termo1202Documento9 páginasS2 Interactivo Microactividad Profundizacion Acc Termo1202angelo AguileraAún no hay calificaciones
- S2.sesión1-Gases RealesDocumento31 páginasS2.sesión1-Gases RealesVictor Angel Vasquez RetamozoAún no hay calificaciones
- PRESION de VAPOR-falta CuestionarioDocumento13 páginasPRESION de VAPOR-falta CuestionarioGiancarlo Gloria MarcatincoAún no hay calificaciones
- Curso de Quimica Aplicada Civil 1Documento22 páginasCurso de Quimica Aplicada Civil 1NICOLE EULALIA FLORES PACHECOAún no hay calificaciones
- Conceptos Básicos de Física y Química Relacionados Con El FuegoDocumento25 páginasConceptos Básicos de Física y Química Relacionados Con El FuegoJose MinoAún no hay calificaciones
- Taller FasesDocumento3 páginasTaller Faseslaura100% (1)
- Trabajo Corro Segundo GrupoDocumento17 páginasTrabajo Corro Segundo GrupoBryan Hermoza VizcarraAún no hay calificaciones
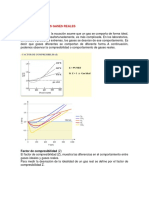
- Ecuaciones de Estado y Factor de CompresibilidadDocumento4 páginasEcuaciones de Estado y Factor de CompresibilidadJesusEduardoPerezPerezAún no hay calificaciones
- Ley de HenryDocumento7 páginasLey de HenryJuan Luis Ramírez AgudeloAún no hay calificaciones
- Capacidad Calorifica de Los GasesDocumento11 páginasCapacidad Calorifica de Los GasesDiego PalomequeAún no hay calificaciones
- Segundo Trabajo de TermodinamicaDocumento18 páginasSegundo Trabajo de TermodinamicaAlfonzo Antonio Natera OrtegaAún no hay calificaciones
- Termodinamica - Gas Ideal PDFDocumento49 páginasTermodinamica - Gas Ideal PDFAndrés David Rodríguez JineteAún no hay calificaciones
- Presentacion Tema3 TemperaturaDocumento29 páginasPresentacion Tema3 TemperaturalordjiAún no hay calificaciones
- Correlaciones de Standing Vazquez y Oistein - CompressDocumento5 páginasCorrelaciones de Standing Vazquez y Oistein - CompressAlma YeseniaAún no hay calificaciones
- Tarea Virtual Fisicoquímica 1Documento24 páginasTarea Virtual Fisicoquímica 1cesar acostaAún no hay calificaciones
- Taller de Los GasesDocumento6 páginasTaller de Los GasesLeon JulianAún no hay calificaciones
- 14 TermodDocumento49 páginas14 TermodAndrea OrtizAún no hay calificaciones
- Correlaciones de Standing Vazquez y OisteinDocumento5 páginasCorrelaciones de Standing Vazquez y OisteinSANABRIA GALICIA DANIELA GISETH100% (1)
- Informe-Diagrama-De-Fases (2) (Reparado)Documento20 páginasInforme-Diagrama-De-Fases (2) (Reparado)HQ MadelyAún no hay calificaciones
- Gases Reales y Ecuación de Van Der WaalsDocumento9 páginasGases Reales y Ecuación de Van Der WaalsCamila PachecoAún no hay calificaciones
- LAY DE Gay Lussac FISICOQUIMICADocumento16 páginasLAY DE Gay Lussac FISICOQUIMICAjhoniAún no hay calificaciones
- 3 Bloque de EjerciciosDocumento6 páginas3 Bloque de EjerciciosSamuel FelipeAún no hay calificaciones
- Practica 1 Quimica IndustrialDocumento20 páginasPractica 1 Quimica IndustrialcecilioAún no hay calificaciones
- Eter1 U1 A2 JommDocumento18 páginasEter1 U1 A2 JommArmando Muñoz MorenoAún no hay calificaciones
- Practica 1 QuimicaDocumento17 páginasPractica 1 QuimicaLuis Miguel Juarez MunguiaAún no hay calificaciones
- Instituto Tecnológico Nacional de México Campus Villahermosa Alumno: Catedratica: Asignatura: Carrera: Semestre: FechaDocumento23 páginasInstituto Tecnológico Nacional de México Campus Villahermosa Alumno: Catedratica: Asignatura: Carrera: Semestre: FechaEduardo NiñoAún no hay calificaciones
- Presión de VaporDocumento11 páginasPresión de VaporDavor Mora MioAún no hay calificaciones
- Presentacion Sustancias PurasDocumento66 páginasPresentacion Sustancias PurasAnyela CaceresAún no hay calificaciones
- Laboratorio #4 TermoDocumento11 páginasLaboratorio #4 TermoRaelee Isabel0% (1)
- Mano RoboticaDocumento13 páginasMano RoboticaDaniel LugoAún no hay calificaciones
- Que Es La PirometalúrgiaDocumento8 páginasQue Es La PirometalúrgiaJean Paul Villa RealAún no hay calificaciones
- Practica 3 Determinacion Simultanea de Mezclas BinariasDocumento10 páginasPractica 3 Determinacion Simultanea de Mezclas BinariasBenjamin CastilloAún no hay calificaciones
- Laboratorio N°12 Sintonización Cohen-Coon y Lambda - AvanceeDocumento8 páginasLaboratorio N°12 Sintonización Cohen-Coon y Lambda - AvanceeUlfer Flores100% (1)
- Perfilado de Textura de Los Arándanos (Vaccinium SPP.) Durante El Desarrollo, Maduración y Almacenamiento Del Fruto PDFDocumento11 páginasPerfilado de Textura de Los Arándanos (Vaccinium SPP.) Durante El Desarrollo, Maduración y Almacenamiento Del Fruto PDFIosef LeyvaAún no hay calificaciones
- Planeamiento Ciencias 8-3 - Repaso Enero - Melany Mora MoraDocumento10 páginasPlaneamiento Ciencias 8-3 - Repaso Enero - Melany Mora MoraLuygui GutiAún no hay calificaciones
- Acondicionamiento de SeñalesDocumento26 páginasAcondicionamiento de SeñalesYIMY JUSSEPPY ZAMBRANO ZAMBRANOAún no hay calificaciones
- Guía de Problemas Repaso y Unidad 1 CORREGIDODocumento5 páginasGuía de Problemas Repaso y Unidad 1 CORREGIDOGladys GimenezAún no hay calificaciones
- Informe Ejemplo 5.4.1 AISC EBFDocumento24 páginasInforme Ejemplo 5.4.1 AISC EBFJoseph MendozaAún no hay calificaciones
- Teoría Físicoquímica C.i2 Ley de La TermodinamicaDocumento220 páginasTeoría Físicoquímica C.i2 Ley de La TermodinamicaErika AndrangoAún no hay calificaciones
- 01 Introducción Procesos de Fabricación 15-16Documento43 páginas01 Introducción Procesos de Fabricación 15-16Julio AtanceAún no hay calificaciones
- Simbologia Planta ExternaDocumento11 páginasSimbologia Planta ExternaEdwin TonatoAún no hay calificaciones
- Sistema Tetragonal FDocumento33 páginasSistema Tetragonal FMiguel Alejandro Jara ChavezAún no hay calificaciones
- Informe 4 Lab Fisicoquímica II - Grupo 6Documento4 páginasInforme 4 Lab Fisicoquímica II - Grupo 6Tania Ocampo AlzateAún no hay calificaciones
- Sistemas DispersosDocumento9 páginasSistemas DispersosJéssica Gabriela ChiquitoAún no hay calificaciones
- Alumbre de AluminioDocumento11 páginasAlumbre de AluminioANIAAún no hay calificaciones
- Propuesta Cuadernillo de PLANEA 2020Documento52 páginasPropuesta Cuadernillo de PLANEA 2020José Luis García ContrerasAún no hay calificaciones
- Espectro de LuzDocumento2 páginasEspectro de LuzMAU YT 戈Aún no hay calificaciones
- Ejemplo 2 - ST2.3Documento3 páginasEjemplo 2 - ST2.3Chriss Mtzz.Aún no hay calificaciones
- Ensayos Destructivos de Flexion y CortaduraDocumento2 páginasEnsayos Destructivos de Flexion y CortaduraKaren Tatiana Condori CazonAún no hay calificaciones
- Errores de MediciónDocumento2 páginasErrores de MediciónAixa BrusaAún no hay calificaciones
- Actividad 8Documento4 páginasActividad 8Luis Ignacio Figueroa RoblesAún no hay calificaciones
- Matemáticas Aplicadas A Comunicaciones Apuntes 2021Documento3 páginasMatemáticas Aplicadas A Comunicaciones Apuntes 2021Adrian GarciaAún no hay calificaciones
- Guia Postulante 2022Documento142 páginasGuia Postulante 2022Casas Alfaro TirsaAún no hay calificaciones
- Ejercicios de Viscosidad 150826032012 Lva1 App6892Documento7 páginasEjercicios de Viscosidad 150826032012 Lva1 App6892lRuth Ramos HuancaAún no hay calificaciones
- UD 4. Configuración y Cálculo de Instalaciones Fotovoltaicas Conectadas A La RedDocumento78 páginasUD 4. Configuración y Cálculo de Instalaciones Fotovoltaicas Conectadas A La RedVictor Alvarez TamayoAún no hay calificaciones
- Introducción La Olimpiada Nacional de Física (ONF) Es Un Evento Impulsado Por La Asociación de Físicos Del Paraguay (AFP) y La Facultad deDocumento9 páginasIntroducción La Olimpiada Nacional de Física (ONF) Es Un Evento Impulsado Por La Asociación de Físicos Del Paraguay (AFP) y La Facultad deJorge David Enciso MartinezAún no hay calificaciones
- Tipos de Enlace y Estructuras de Lewis I FinalDocumento18 páginasTipos de Enlace y Estructuras de Lewis I FinalJosue Gomez ToralesAún no hay calificaciones
- Método de La Rigidez en Armaduras Desplazamientos, Reacciones y Fuerzas KassimaliDocumento9 páginasMétodo de La Rigidez en Armaduras Desplazamientos, Reacciones y Fuerzas KassimaliELVIS DAVID VASQUEZ JIMENEZAún no hay calificaciones
- Apu A TrabajarDocumento20 páginasApu A TrabajarBenjamin RosasAún no hay calificaciones