Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cifras Significativas
Cifras Significativas
Cargado por
francisco amadorTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cifras Significativas
Cifras Significativas
Cargado por
francisco amadorCopyright:
Formatos disponibles
GUÍA DE EJERCICIOS CIFRAS SIGNIFICATIVAS
Área Química
Resultados de aprendizaje
Conocer y aplicar las normas en la determinación de cifras significativas en el entrega de resultados.
Contenidos
1. Conteo de número de cifras significativas en un número.
2. Cifras significativas en suma, resta, multiplicación y división.
3. Entrega de resultados según número de cifras significativas.
Números Exactos e Inciertos
Los números exactos, como su nombre lo indica, se conocen con exactitud, por ejemplo un kg
siempre corresponde a 1000 g, una docena siempre corresponde a 12 unidades, el número 1, en
cualquier factor de conversión también es un número exacto, cuando contamos objetos, el
resultado también es un número exacto, en cambio hay otros números cuyos valores tienen cierta
incertidumbre y corresponden a los números inexactos o inciertos, como por ejemplo, los números
que se obtienen como resultado de una medida.
En este caso el resultado depende tanto del instrumento que se utiliza como del operador, ya que si
ponemos a 5 estudiantes a determinar la masa de una moneda, en 5 balanzas diferentes que
puedan medir, por ejemplo hasta 5 cifras en total, se van a encontrar pequeñas diferencias entre
los resultados, que van a depender, de las condiciones de cada balanza y también de cómo el
estudiante hace la medida.
El conteo de números muy grandes de objetos por lo general conlleva también cierto error, por
ejemplo los resultados del censo de un país, o los resultados de una elección presidencial. Lo
importante de tener en cuenta es que “siempre hay incertidumbre en las magnitudes medidas”
Si determinamos la masa de un objeto en una balanza capaz de medir hasta la cuarta cifra decimal
y la balanza nos indica un valor de 4,0257, se considera que la última cifra es incierta por lo tanto
informaríamos que la masa del objeto es 4,02547 ± 0,0001 g, porque si dispusiéramos de una
balanza que permitiera determinar hasta la quinta cifra decimal el valor obtenido podría ser
4,02568 o 4,02572, por ejemplo.
En general omitimos la notación ± en el entendido que existe una incertidumbre de por lo menos
una unidad en el último dígito del valor medido. Por lo tanto “las cantidades medidas se informan
de tal manera que sólo el último dígito es incierto”.
Para graficar lo anterior consideremos un termómetro, que esté graduado de 5 en 5, si el
termómetro marca una temperatura que está entre 35º y 40º podríamos estimar que la
Servicios Académicos para el Acompañamiento y la Permanencia - PAIEP
Primera Edición - 2016 1
temperatura es 37º pero no estaríamos seguros del 2º dígito, por lo tanto sólo podríamos decir que
la temperatura es aproximadamente 37º.
Todos los dígitos de una cantidad medida, incluido el incierto, se denominan cifras significativas. Si
al determinar una masa informamos un resultado de 4,24 g lo estamos dando con 3 cifras
significativas, en cambio si el resultado es 4,2387 g lo estamos dando con cinco cifras significativas.
(Lo que indica que utilizamos una balanza con mayor precisión para determinar la masa). Cuanto
mayor es el número de cifras significativas, mayor es la exactitud de una medición.
Precisión y Exactitud
La precisión es una medida de la concordancia de mediciones individuales entre sí. (En el caso de
las balanzas se dice que una balanza es más precisa cuando nos entrega un mayor número de cifras
significativas). La exactitud se refiere a que tanto, las mediciones individuales se acercan al valor
correcto o verdadero. En el Laboratorio es frecuente hacer varias veces una medida para
asegurarse de su precisión, (para descartar errores en la operación), sin embargo, las mediciones
precisas pueden ser inexactas. Por ejemplo si una balanza está mal calibrada, las masas medidas
serán consistentemente demasiado altas o demasiado bajas. Serán inexactas aunque sean precisas.
(Desde luego lo primero que debe hacer un operador antes de utilizar una balanza es constatar
que la balanza esté bien calibrada).
Ejemplo de precisión y exactitud en una medida cualquiera.
Ejemplo 1: Indique qué diferencia hay entre 2,0 g y 2,00 g
Servicios Académicos para el Acompañamiento y la Permanencia - PAIEP
Primera Edición - 2016 2
Solución: 2,0 g tiene dos cifras significativas y la última es incierta, por lo tanto el valor real está
entre 1,9 y 2,1 lo que se indica como: 2,0 ± 0,1. La precisión de la balanza utilizada para su
determinación es de 0,1.
2,00 g tiene tres cifras significativas y la última es incierta, por lo tanto el valor real está entre 1,99 y
2,01 lo que se indica como 2,00 ± 0,01. La precisión de la balanza utilizada para su determinación
es de 0,01, por consiguiente el valor entregado por esta balanza es de mayor exactitud que el
anterior.
Ejemplo 2: Si una balanza tiene una precisión de 0,0001 g. ¿Con cuántas cifras significativas deberá
informarse la masa de una sustancia de alrededor de 15 g?
Solución: Con 5 ya que la balanza nos está indicando 4 cifras decimales. La masa podría ser 14,9997
o 15,0234 o cualquier otra cercana a 15 pero con cuatro decimales.
¿Cuándo el cero es significativo?
Dependerá de su ubicación en el número correspondiente. Se pueden dar las siguientes reglas:
1.- Los ceros que están entre dígitos distintos de cero son siempre significativos. Ejs.: 2004 L tiene
4 cifras significativas (CS), 5,40 g tiene tres CS.
2.- Los ceros al principio de un número nunca son significativos, simplemente indican la posición de
la coma decimal. Ejs. 0,24 cm tiene dos CS, 0,0005 g tiene una CS. (De aquí el dicho: “eres un cero
a la izquierda”).
3.- Los ceros que están al final de un número, después de la coma decimal, siempre son
significativos. Ejs.: 5,0 mg tiene 2 CS, 3,200 g tiene 4 CS.
4.- Cuando un número termina en ceros, pero no tiene coma decimal, los ceros podrían ser
significativos o no. Ejs.: 120 cm (2 o 3 CS), 10500 kg (3,4 o 5 CS). El empleo de notación científica
evita esa ambigüedad. Por ejemplo los 10500 kg podríamos escribirlo en notación científica con 3,
4 o 5 CS:
1,05 · 10 4 kg tres CS
1,050 · 104 kg cuatro CS
1,0500 · 104 kg cinco CS
En estos números, todos los ceros a la derecha de la coma decimal son significativos (reglas 1 y 3).
Todas las CS se colocan antes del exponente y el término exponencial no aumenta el número de CS.
Los números exactos se tratan como si tuvieran un número infinito de CS. En conversión de
unidades por ejemplo, si decimos que 1 m tiene 100 cm, tanto el 1 como el 100 son números
exactos y no debemos preocuparnos por las CS.
Servicios Académicos para el Acompañamiento y la Permanencia - PAIEP
Primera Edición - 2016 3
Ejemplo 3: ¿Cuántas CS tiene cada uno de los siguientes números: a) 7,005 b) 6,02 · 10 y c)
9000?
Solución: a) cuatro, b) tres y c) cuatro, tres, dos o una (regla 4).
Ejemplo 4: ¿Cuántas CS tiene cada una de las siguientes mediciones: a) 1,234 g b) 0,00279 g y c)
7,9 · 104cm?
Solución: a) cuatro, b) tres y c) solo dos cifras significativas (7,9)
Cifras significativas en cálculos
Al utilizar variables (masa, temperatura, etc) medidas en cálculos hay que tener presente que:
1.- La medición menos precisa empleada en un cálculo limita la precisión del resultado entregado.
2.- La respuesta final de todo cálculo debe informarse con sólo un dígito incierto.
En las multiplicaciones y divisiones, el resultado debe informarse con el mismo número de CS que
tiene la medición con menos CS. Si el resultado tiene más CS debe redondearse de acuerdo a las
reglas dadas más adelante.
Ejemplo 5: Determine el área de un rectángulo cuyos lados miden 3,427 cm y 7,1 cm
Solución: A = 3,427 cm × 7,1 cm = 24,3317 cm2 que redondeando a 2 CS 24 cm. El resultado
debe entregarse con sólo dos CS ya el dato con menor precisión tiene sólo dos CS.
Para llegar a este resultado es necesario aplicar las siguientes reglas:
1.- Si el dígito que está más a la izquierda, de los que se desea eliminar, es menor que 5, el dígito
precedente no se modifica. Por ejemplo si 6,427 se quiere expresar con 2 CS, como el 2 es menor
que 5, simplemente se elimina el 27 y queda 6,4.
2.- Si el dígito que está más a la izquierda, de los que se desea eliminar, es mayor que 4, el número
precedente se incrementa en 1. Así si 2,753 se desea expresar con 2 CS, hay que eliminar el 53 y
como el 5 (el que está más a la izquierda, de los que se desea eliminar) es mayor que 4, el número
precedente (el 7) se aumenta en 1, quedando, el resultado final en 2,8.
Al sumar y restar, el resultado no puede tener más cifras decimales que la medición que tiene
menos cifras decimales.
Ejemplo 6: Determine el resultado de la siguiente suma: 17,2 + 8,246 + 59.
Solución: 17,2 una cifra decimal
8,246 tres cifras decimales
+ 79 ninguna cifra decimal
Servicios Académicos para el Acompañamiento y la Permanencia - PAIEP
Primera Edición - 2016 4
104,446 se redondea a 104 por dos razones:
1.- La respuesta final de todo cálculo debe informarse con sólo un dígito incierto (aparecen en
negrita los dígitos inciertos en los sumandos y en el primer resultado) y
2.- El resultado no puede tener más cifras decimales que la medición que tiene menos cifras
decimales. (el 79 no tiene ninguna cifra decimal, por lo tanto el resultado final tampoco puede
tenerla, ya que no se sabe si el 79 es 78,9 o 79,1 u otro número parecido).
Cuando en un cálculo intervienen dos o más pasos y se anotan los resultados intermedios conviene
retener al menos un dígito adicional, (además de los que corresponden según las cifras
significativas). Este procedimiento impide que los errores que se cometen en el redondeo afecten
el resultado final.
Lo ideal es tratar de poner todos los pasos en una misma operación y trabajando con una
calculadora utilizar todas las cifras que van resultando y solo redondear el resultado final. Con este
procedimiento los resultados son más exactos.
Para lograr lo anterior es muy útil utilizar factores de conversión para transformar las distintas
unidades de medida.
Análisis dimensional y factores de conversión
El análisis dimensional ayuda a resolver los ejercicios y asegura que el resultado de los mismos
tenga las unidades que correspondan. Para esto todos los datos deben utilizarse con su
correspondiente unidad y las unidades pueden multiplicarse, dividirse, “cancelarse”, etc. Para
hacerlo es necesario hacer transformación de unidades, para lo cual lo más conveniente es utilizar
factores de conversión.
Un factor de conversión, o factor unitario es una fracción cuyo numerador y denominador son
equivalentes pero están expresados en distintas unidades, por lo que los números que acompañan
a estas unidades son diferentes.
Ejemplo la presión de 1 atmósfera (atm) es equivalente a la presión que ejercen 76 cm de
mercurio (Hg). Si expresamos lo anterior como factores de conversión tenemos:
1 atm → 76 cm de Hg y 76 cm de Hg → 1 atm
Utilizamos uno u otro de estos factores dependiendo de cuál es la unidad que queremos utilizar.
Servicios Académicos para el Acompañamiento y la Permanencia - PAIEP
Primera Edición - 2016 5
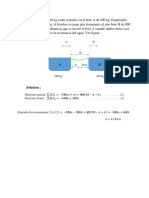
Ejemplo 7: Determine cuál es la presión, en atm, ejercida por una columna de mercurio de 1,2
metros.
Solución: Tenemos 1,2 m de Hg, pero la equivalencia de 1 atm está dada en cm, por lo tanto,
debemos utilizar otro factor de conversión para llevar primero el metro a centímetros, y después
llevar los cm a atm:
100 cm de Hg 1 atm
1,2 m de Hg × × = 1,5789 = 1,6 atm
1 m de Hg 76 cm de Hg
El metro de mercurio se cancela con el m de Hg , los cm de Hg con los cm de Hg y el resultado,
que resulta de multiplicar y/o dividir, los números correspondientes, queda en atm., con sólo dos
CS ya que 76 es el número con menos CS. Los 1 son números exactos ya que corresponden a una
equivalencia definida previamente y por consiguiente se considera que tiene todas las CS que
necesite.
En los factores de conversión el numerador es exactamente equivalente al denominador por lo
tanto multiplicar cualquier dato por un factor de conversión equivale a multiplicarlo por 1 por lo
tanto no afecta el valor intrínseco del dato, solo lo expresa en otra unidad. Por consiguiente la
presión ejercida por 1,2 m de Hg es la misma que la ejercida por 1,6 atm.
Ejemplo 8: Si una persona pesa 120 libras, ¿Cuál es su peso en g?
Solución: Tenemos que buscar en una tabla de unidades cuál es la relación existente entre libras y
g.
Encontramos que:
1 kg = 2,2046 lb y que 1 kg = 1000 g
Tenemos 120 lb y queremos eliminar lb por lo tanto ponemos, en el factor de conversión, la
lb como denominador:
120 l̸b × 1k̸ g × 1000g = 54431,64 = 5,44 × 10-2 g.
2,2046 l̸b 1̸Kg
Con tres CS que es lo que tiene el dato que tiene menos CS
Servicios Académicos para el Acompañamiento y la Permanencia - PAIEP
Primera Edición - 2016 6
Ejercicios de práctica:
1. Determine el número de cifras significativas en:
a) 3 m
b) 0,03 cm
c) 0,00005030
d) 5,689
e) 34
2. Resuelva las siguientes operaciones.
a) 1,61 + 0,3 =
b) 5,935 – 4,51=
c) 152,06m × 0,24m=
d) 58,93cm × 0,1cm=
3. Un adulto tiene en promedio 5,2 L de sangre. ¿Cuál es el volumen de sangre expresado en m3?
4. La densidad de un líquido a su punto de ebullición (77K) es 0,808 g/cm3. Convierta la densidad a
unidades de kg/m3 y la temperatura a ºC.
5. La presión atmosférica es de 1 atm. Convierta esta presión a pascales y milímetros de mercurio
(mmHg).
Responsables académicos
Corregida por comité Editorial PAIEP. Si encuentra algún error favor comunicarse a
ciencia.paiep@usach.cl
Referencias y fuentes utilizadas
Chang, R.; College, W. (2002). Química. (7a. ed). México: Mc Graw-Hill Interamericana Editores S.A.
Lilian Bouyssières Mac-Leod. Apuntes para química.
Servicios Académicos para el Acompañamiento y la Permanencia - PAIEP
Primera Edición - 2016 7
También podría gustarte
- La Guía Definitiva en Matemáticas para el Ingreso a la UniversidadDe EverandLa Guía Definitiva en Matemáticas para el Ingreso a la UniversidadCalificación: 4 de 5 estrellas4/5 (11)
- Introducción A La Teoría de Incertidumbre en Las MedicionesDocumento16 páginasIntroducción A La Teoría de Incertidumbre en Las MedicionesGuillermo Gutierrez100% (1)
- Teoría Notacion Cientifica Cifras SignificativasDocumento7 páginasTeoría Notacion Cientifica Cifras SignificativasFelicitas MassaAún no hay calificaciones
- Cifras Significativas y Conversión de UnidadesDocumento7 páginasCifras Significativas y Conversión de UnidadesLeonelAndree100% (1)
- Cifras SignificativasDocumento17 páginasCifras SignificativasCesar Augusto Gonzales BarredaAún no hay calificaciones
- Cifras SignificativasDocumento33 páginasCifras Significativasyissel flores castroAún no hay calificaciones
- Cifras Significativas y Notación Científica Vicky Mañalich AranaDocumento20 páginasCifras Significativas y Notación Científica Vicky Mañalich AranaRebeca FernandezAún no hay calificaciones
- Sesion 1Documento20 páginasSesion 1Jhoset Cristian TMoAún no hay calificaciones
- Cifras SignificativasDocumento3 páginasCifras SignificativasMHLS68Aún no hay calificaciones
- Cifras SignificativasDocumento21 páginasCifras SignificativasElias MorilloAún no hay calificaciones
- Lab QMC Nro5 - 042529Documento10 páginasLab QMC Nro5 - 042529Helen BarronAún no hay calificaciones
- Cifras Significativas - AlumnosDocumento48 páginasCifras Significativas - AlumnosAnonymous krQ5oorAún no hay calificaciones
- Cifras SignificativasDocumento6 páginasCifras SignificativasWendy MárquezAún no hay calificaciones
- Teoría de Errores y Líneas de RegresiónDocumento21 páginasTeoría de Errores y Líneas de Regresiónjosegamer50Aún no hay calificaciones
- Mediciones - Cifras SignificativasDocumento21 páginasMediciones - Cifras SignificativasCristhian Tuni CastroAún no hay calificaciones
- Teoría de Errores Alexander CanevaDocumento13 páginasTeoría de Errores Alexander CanevaAlejandro Páez CortésAún no hay calificaciones
- Reglas para Expresar Una Medida y Su ErrorDocumento6 páginasReglas para Expresar Una Medida y Su ErrorClaudia TinocoAún no hay calificaciones
- Capitulo 4Documento18 páginasCapitulo 4Andrea MedinaAún no hay calificaciones
- Cifras SignificativasDocumento5 páginasCifras SignificativasWenderson GutierrezAún no hay calificaciones
- CIFRAS SIGNIFICATIVAS - Docx111Documento14 páginasCIFRAS SIGNIFICATIVAS - Docx111Gerson IsidroAún no hay calificaciones
- Reglas Generales de Cifras SignificativasDocumento5 páginasReglas Generales de Cifras SignificativasMisael Báez MoralesAún no hay calificaciones
- Cifras SignificativasDocumento8 páginasCifras SignificativasCarlos Mario GaravitoAún no hay calificaciones
- 3, LLLLLDocumento2 páginas3, LLLLLkAún no hay calificaciones
- Cifras Significativas y RedondeoDocumento13 páginasCifras Significativas y Redondeodiego123457Aún no hay calificaciones
- CIFRAS SIGNIFICATIVAS AmplioDocumento4 páginasCIFRAS SIGNIFICATIVAS AmplioJesus GonzaloAún no hay calificaciones
- GU A 1 Cifras Significativas y Notaci N Cient Fica 3 0Documento7 páginasGU A 1 Cifras Significativas y Notaci N Cient Fica 3 0Andrés DamianAún no hay calificaciones
- Cifras Significativas-1 PDFDocumento18 páginasCifras Significativas-1 PDFDiego Julcamoro VergaraAún no hay calificaciones
- Cifras SignificativasDocumento7 páginasCifras SignificativasMarysabel SánchezAún no hay calificaciones
- Cifras SignificativasDocumento42 páginasCifras SignificativasCarlos Alberto Echeverri LondoñoAún no hay calificaciones
- 1.4 Cifras SignificativasDocumento4 páginas1.4 Cifras SignificativasgloriaAún no hay calificaciones
- Las Cifras SignificativasDocumento4 páginasLas Cifras SignificativasPaulina TorressAún no hay calificaciones
- Cifras SignificativasDocumento16 páginasCifras SignificativasOsmarGrooveAún no hay calificaciones
- Cifras Significativas en Resultados de Medición y CálculosDocumento9 páginasCifras Significativas en Resultados de Medición y CálculospedroAún no hay calificaciones
- Análisis de Cifras SignificativasDocumento3 páginasAnálisis de Cifras SignificativasConstanza Jessica TraipeAún no hay calificaciones
- Cifras Significativas y RedondeoDocumento10 páginasCifras Significativas y RedondeoJuan Pablo Fonseca SanchezAún no hay calificaciones
- Trabajo N°1 Cifras SignificativasDocumento5 páginasTrabajo N°1 Cifras SignificativasAna ChuintAún no hay calificaciones
- Quimica Monografia MañanaDocumento12 páginasQuimica Monografia MañanaFrank LopezAún no hay calificaciones
- Cifras SignificativasDocumento8 páginasCifras SignificativasJhoan CabreraAún no hay calificaciones
- Cifras Significativas.Documento6 páginasCifras Significativas.Reyes EsmeraldaAún no hay calificaciones
- Cifras SignificativasDocumento3 páginasCifras SignificativasCreaciones CCAún no hay calificaciones
- Taller 1 - Versión ExtendidaDocumento10 páginasTaller 1 - Versión Extendidaandyval23Aún no hay calificaciones
- Cifras SignificativasDocumento6 páginasCifras Significativasjose luisAún no hay calificaciones
- 1 MedicionesDocumento7 páginas1 MedicionesMario Alexis Quispe GutierrezAún no hay calificaciones
- 2-Mediciones y Unidades 2Documento22 páginas2-Mediciones y Unidades 2Claudia VarelaAún no hay calificaciones
- Quimica AnaliticaDocumento27 páginasQuimica AnaliticaRiikardo RamirezAún no hay calificaciones
- Incertidumbre en Las MedicionesDocumento16 páginasIncertidumbre en Las MedicionesRichar Manuel Simanca FontalvoAún no hay calificaciones
- Introducción A La Teoría de Incertidumbre en Las MedicionesDocumento16 páginasIntroducción A La Teoría de Incertidumbre en Las MedicionesAdrian FujikiAún no hay calificaciones
- Hoja Informativa 4 Cs Redondeo NúmerosDocumento4 páginasHoja Informativa 4 Cs Redondeo NúmerosOmar CruzAún no hay calificaciones
- Cifras Significativas Reglas y Ejercicios ResueltosDocumento13 páginasCifras Significativas Reglas y Ejercicios ResueltosDavid Albres PabloAún no hay calificaciones
- 3 NotacionCientificaDocumento9 páginas3 NotacionCientificaasle16049Aún no hay calificaciones
- Cifras Significativas y Cifras DecimalesDocumento14 páginasCifras Significativas y Cifras DecimalessindirdekAún no hay calificaciones
- Cifras-Significativas (Documento Confiable)Documento3 páginasCifras-Significativas (Documento Confiable)material deestudioAún no hay calificaciones
- Investigacion Cifras Significativas - RedondeoDocumento4 páginasInvestigacion Cifras Significativas - RedondeoJoao CruzAún no hay calificaciones
- LAB. No1. B) Cifras Significativas, EtcDocumento24 páginasLAB. No1. B) Cifras Significativas, EtcCAMILA SILVA MOLINAAún no hay calificaciones
- Mediciones en QuimicaDocumento24 páginasMediciones en QuimicaRBKAMORAún no hay calificaciones
- Cifras SignificativasDocumento4 páginasCifras SignificativasFelipe ChuquimarcaAún no hay calificaciones
- Cifras SignificativasDocumento5 páginasCifras SignificativasNeruso91Aún no hay calificaciones
- Cifras SignificativasDocumento5 páginasCifras SignificativasraacquimicaAún no hay calificaciones
- Cifras Significativas y RedondeoDocumento12 páginasCifras Significativas y RedondeoBrayan Jossep Huajalsaico CespedesAún no hay calificaciones
- Incertidumbre en La Medida y Cifras significativas2-ESPAÑOLDocumento21 páginasIncertidumbre en La Medida y Cifras significativas2-ESPAÑOLtatiana marrugo pitaluaAún no hay calificaciones
- Semana 7 - DinámicaDocumento21 páginasSemana 7 - Dinámicaz.s.Aún no hay calificaciones
- Informe de Laboratorio 2Documento16 páginasInforme de Laboratorio 2Jorge Guerrero MoriAún no hay calificaciones
- Aplicaciones A Ecuaciones de Primer OrdenDocumento4 páginasAplicaciones A Ecuaciones de Primer OrdenDavidAlexanderGarridoRodriguezAún no hay calificaciones
- PRÁCTICA DIRIGIDA ElectromagnetismoDocumento14 páginasPRÁCTICA DIRIGIDA ElectromagnetismoJosé L. Matos VargasAún no hay calificaciones
- Matriz JacobianaDocumento30 páginasMatriz JacobianaEmmanuel Marin VicenteAún no hay calificaciones
- Movimiento Rectilineo UniformeDocumento6 páginasMovimiento Rectilineo UniformeDeibyAún no hay calificaciones
- FISICADocumento129 páginasFISICASaroff Yataco Irrazábal100% (1)
- Ley de Coulomb y MorinDocumento4 páginasLey de Coulomb y MorinAlfredo Estrada33% (3)
- Física 1Documento13 páginasFísica 1olinares1977Aún no hay calificaciones
- Datos de ConcretoDocumento387 páginasDatos de ConcretoJames HuamánAún no hay calificaciones
- Física 8va Olimpiada 2da Etapa TodosDocumento7 páginasFísica 8va Olimpiada 2da Etapa TodosAnonymous PWLcxxQ0% (1)
- Laboratio 04Documento11 páginasLaboratio 04Edhu Neil BraunAún no hay calificaciones
- Formulario Física 1 - Rev - CDocumento3 páginasFormulario Física 1 - Rev - Cmaster2377@hotmail.comAún no hay calificaciones
- Peso Especifico y Absorción en AgregadosDocumento11 páginasPeso Especifico y Absorción en AgregadosFrank MauricioAún no hay calificaciones
- Sesión1 - Skateboarding y Las Leyes Del MovimientoDocumento7 páginasSesión1 - Skateboarding y Las Leyes Del MovimientoSantiago OrtizAún no hay calificaciones
- CINEMÁTICADocumento4 páginasCINEMÁTICAMoisesAún no hay calificaciones
- Humedad GravimetricaDocumento6 páginasHumedad GravimetricaGreys HernandezAún no hay calificaciones
- Aplicaciones Ecuaciones Diferenciales MecanicaDocumento7 páginasAplicaciones Ecuaciones Diferenciales MecanicaalbujasebastianAún no hay calificaciones
- Vibraciones Mecanicas 4Documento19 páginasVibraciones Mecanicas 4Erick Donovan Becerra MoralesAún no hay calificaciones
- Clase 5 Principio Arquimedes 2016 1 PDFDocumento15 páginasClase 5 Principio Arquimedes 2016 1 PDFEduardo Alvarado100% (1)
- Bimestral Física Grado 11Documento4 páginasBimestral Física Grado 11Ananias Villamizar GallardoAún no hay calificaciones
- Tablas de Mecanica de FluidosDocumento14 páginasTablas de Mecanica de FluidosleonelreymoAún no hay calificaciones
- Centro de GravedadDocumento96 páginasCentro de GravedadRafael VictoriaAún no hay calificaciones
- Solucionario Dina Prac 2Documento5 páginasSolucionario Dina Prac 2Yhan GomezAún no hay calificaciones
- Rios Texta U7 T12Documento20 páginasRios Texta U7 T12Victor RiosAún no hay calificaciones
- Evaluaciön Acumulativa I 11°Documento2 páginasEvaluaciön Acumulativa I 11°guata2603gmailcomAún no hay calificaciones
- 3 Potencial EléctricoDocumento41 páginas3 Potencial EléctricoEddy Frank CoronadoAún no hay calificaciones
- Laboratorio TorqueDocumento6 páginasLaboratorio Torquerecordar123100% (1)
- Examen de Mru Mruv Caida LibreDocumento1 páginaExamen de Mru Mruv Caida LibreOscar AguilarAún no hay calificaciones
- Caracterizacion de HarinasDocumento10 páginasCaracterizacion de HarinasMariané ChávezAún no hay calificaciones