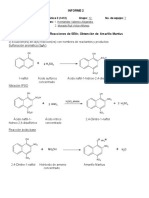
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
2020 Integrados Estequiometria y Redox II
Cargado por
FernándezRaquelDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
2020 Integrados Estequiometria y Redox II
Cargado por
FernándezRaquelCopyright:
Formatos disponibles
2ºDB-2ºDC LABORATORIO DE QUÍMICA
Liceo Bauzá
Repartido ejercicios integrados: ESTEQUIOMETRIA Y REDOX
1-El circonio es un metal que se utiliza como aditivo en aceros obteniéndose materiales muy
resistentes. También se emplean aleaciones con otros metales en la industria química por su
resistencia frente a sustancias corrosivas. Para la
reacción: Zr(s) + H2O(L) ZrO2(ac) + H2(g)
a) Iguale la ecuación por el método
del número de oxidación.
b) Identifique qué especie se oxidó e indique el agente oxidante.
c) Si se hacen reaccionar 550g de Zr al 88,0% de pureza con suficiente agua, ¿qué masa
de óxido de circonio se produce? R: 654g
d) ¿Cuántos moles y cuántas moléculas de di hidrógeno se libera? R: 10,6 mol
2- El di yodo se obtiene a partir de los yoduros presentes en el agua de mar y en algas. En el laboratorio
puede producirse por la reacción:
H2SO4(ac) + HI(ac) H2S(ac) + I2(s) + H2O(L)
a- Igualar la ecuación redox, indicando agente reductor y oxidante.
b- Calcular la masa de I2 formada a partir de 2,5 x 10-3 moles de HI y H2SO4
en exceso, si el rendimiento es del 80%. R: 0,26 g
3- Para detectar el envenenamiento por óxido de arsénico se utiliza una prueba en la cual se lo hace
reaccionar con dihidrógeno según la siguiente ecuación redox:
H2 (g) + As2O3 (s) → AsH3 (g) + H2O (l)
El compuesto AsH3 se descompone al calor formando arsénico el que se reconoce por su
brillo metálico.
a- Si se ponen a reaccionar 0,10 mol de As2O3 con 3,0 g de H2 ¿Cuál es el reactivo limitante?
b- ¿Cuántos gramos de AsH3 se obtienen con un rendimiento de 85%?
c- Indique agenta oxidante y agente reductor. R: 14g
4-Las monedas antiguas de cobre se pueden limpiar con ácido nítrico diluido para pulirlas, recobrando
su color y brillo. Pero se debe hacer con cuidado pues el cobre reacciona con el ácido nítrico y las
monedas se corroen al producirse la siguiente reacción redox :
Cu (s) + HNO3(ac) → Cu(NO3)2(ac) + NO(g) + H2O(l)
a) Iguale la ecuación indicando las semi-reacciones de oxidación y reducción.
b) Indique agente oxidante y reductor.
c) Calcular la masa de monóxido de nitrógeno (NO) que se libera con 50,0 g de Cu al
90% de pureza y 20,0g de HNO3. R: 2,4g
También podría gustarte
- Guía de Ingeniería en Operaciones MinerasDocumento351 páginasGuía de Ingeniería en Operaciones MinerasCristian Torres Olivares94% (18)
- Caracterización química, morfológica y estructural de materialesDe EverandCaracterización química, morfológica y estructural de materialesAún no hay calificaciones
- ElectroquimicaDocumento14 páginasElectroquimicaKETEVAN BOKERIYAAún no hay calificaciones
- Doe Run PeruDocumento10 páginasDoe Run PerudanielAún no hay calificaciones
- Lab N°12Documento26 páginasLab N°12Alejandra Gutierrez ʚïɞ100% (1)
- Informe Lab HidrometalurgiaDocumento15 páginasInforme Lab HidrometalurgiaAngelo Ramirez RojasAún no hay calificaciones
- Todas Las PreguntasDocumento42 páginasTodas Las PreguntasPablo GonzalezAún no hay calificaciones
- Informe de Laboratorio Reacciones Quimicas 1Documento6 páginasInforme de Laboratorio Reacciones Quimicas 1Dianelis Sanchez100% (2)
- Problemas de Pirometalurgia IIDocumento8 páginasProblemas de Pirometalurgia IITacachiri Chocamani Jaime0% (1)
- Guía N°2 Cinética QuímicaDocumento2 páginasGuía N°2 Cinética Químicaguilver75% (4)
- Exercicios Repaso Exame - 23-24Documento2 páginasExercicios Repaso Exame - 23-24Viqui R.Aún no hay calificaciones
- Ej 05 SolDocumento13 páginasEj 05 Soljrb7590Aún no hay calificaciones
- Ficha de Trabajo 1 - Estequiometria Con Redox PDFDocumento2 páginasFicha de Trabajo 1 - Estequiometria Con Redox PDFErick NavarroAún no hay calificaciones
- TP-reacciones QuimicasDocumento4 páginasTP-reacciones QuimicasdelfinaAún no hay calificaciones
- Ficha de Trabajo 1 - Estequiometria Con Redox PDFDocumento2 páginasFicha de Trabajo 1 - Estequiometria Con Redox PDFErick NavarroAún no hay calificaciones
- Ficha de Trabajo 1 - Estequiometria Con RedoxDocumento2 páginasFicha de Trabajo 1 - Estequiometria Con RedoxM Anuel Pc PorrasAún no hay calificaciones
- Ficha de Trabajo 1 - Estequiometria Con RedoxDocumento2 páginasFicha de Trabajo 1 - Estequiometria Con RedoxM Anuel Pc PorrasAún no hay calificaciones
- Ficha de Trabajo 1 - Estequiometria Con RedoxDocumento2 páginasFicha de Trabajo 1 - Estequiometria Con RedoxM Anuel Pc PorrasAún no hay calificaciones
- Ficha de Trabajo 1 - Estequiometria Con Redox PDFDocumento2 páginasFicha de Trabajo 1 - Estequiometria Con Redox PDFYeison Lujan RamosAún no hay calificaciones
- QG Ejercios Redox PDFDocumento2 páginasQG Ejercios Redox PDFAnonymous dtgDb5o3HgAún no hay calificaciones
- Reacciones Redox 2020Documento16 páginasReacciones Redox 2020carlosgp060299Aún no hay calificaciones
- Redox EjerciciosDocumento13 páginasRedox EjerciciosSoyAdaG GAún no hay calificaciones
- Ejercicios Reacciones QuímicasDocumento2 páginasEjercicios Reacciones QuímicascarlarodriguezgomezzzzAún no hay calificaciones
- Ejer Evau Redox PDFDocumento11 páginasEjer Evau Redox PDFCristian RozoAún no hay calificaciones
- Refuerzo 4 de Química SM 2019 IDocumento4 páginasRefuerzo 4 de Química SM 2019 IJu Daniel D. VillanuevaAún no hay calificaciones
- TAREA1Documento6 páginasTAREA1Christian Reyes GarciaAún no hay calificaciones
- Q7 PAU ElectroquímicaDocumento23 páginasQ7 PAU Electroquímicaalexandra28092005larisadavidAún no hay calificaciones
- S01.s1 - Problemas Micro Taller 01 REDOX PDFDocumento2 páginasS01.s1 - Problemas Micro Taller 01 REDOX PDFOmar Alfaro MamaniAún no hay calificaciones
- Q7 PAU ElectroquímicaDocumento16 páginasQ7 PAU Electroquímicaisabelsu1Aún no hay calificaciones
- Electroquimica IIDocumento7 páginasElectroquimica IIAlba CanseAún no hay calificaciones
- Boletín RedoxDocumento4 páginasBoletín RedoxBlanca Collado TorañoAún no hay calificaciones
- Redox. Ejercicios EvAUDocumento8 páginasRedox. Ejercicios EvAUmartaAún no hay calificaciones
- S01 Ficha de Trabajo 1 - Estequiometria Con RedoxDocumento2 páginasS01 Ficha de Trabajo 1 - Estequiometria Con RedoxEltio MackAún no hay calificaciones
- Evau RedoxDocumento14 páginasEvau RedoxIsabelMontillaArteagaAún no hay calificaciones
- Cálculos QuímicosDocumento2 páginasCálculos Químicosmariasgo2008Aún no hay calificaciones
- Redox BatDocumento4 páginasRedox BatYOAún no hay calificaciones
- S03.s1 - Material ComplementarioDocumento9 páginasS03.s1 - Material ComplementariojuancitoAún no hay calificaciones
- EQA-Serie 6Documento4 páginasEQA-Serie 6Maria Laura PamparatoAún no hay calificaciones
- Ejercicios Redox Evau 2020Documento6 páginasEjercicios Redox Evau 2020joe STALLAún no hay calificaciones
- RedoxDocumento8 páginasRedoxAcademia SanRoqueAún no hay calificaciones
- Taller Nº3-2017Documento5 páginasTaller Nº3-2017DANIELA DIAZ GÓMEZAún no hay calificaciones
- U1 - S1.Ficha de Trabajo 1 - Estequiometria Con Redox - BENIQUEDocumento10 páginasU1 - S1.Ficha de Trabajo 1 - Estequiometria Con Redox - BENIQUEANALI ANITA BASURCO SALDIVAR100% (1)
- Academia San Marcos 1Documento2 páginasAcademia San Marcos 1Milagros Victoria Sacaca RamírezAún no hay calificaciones
- Boletín Red-Ox 20-21Documento7 páginasBoletín Red-Ox 20-21Viqui R.Aún no hay calificaciones
- T - Sem 08 - Ses 08 - Taller Examen Parcial PDFDocumento6 páginasT - Sem 08 - Ses 08 - Taller Examen Parcial PDFCarl JanAún no hay calificaciones
- EJERCICIOS REDOX Selectividad 2012Documento12 páginasEJERCICIOS REDOX Selectividad 2012María Victoria Arques GalianaAún no hay calificaciones
- T - Sem 04 - Ses 07 - Taller Examen ParcialDocumento6 páginasT - Sem 04 - Ses 07 - Taller Examen ParcialBrayam Stalyn Bonifacio AyalaAún no hay calificaciones
- Guía EstequiometríaDocumento4 páginasGuía EstequiometríaFelipe RosalesAún no hay calificaciones
- Calculos EstequiométricosDocumento5 páginasCalculos EstequiométricosPaula Medal MartínezAún no hay calificaciones
- Redox EjerciciosDocumento8 páginasRedox EjerciciosDENZILITOAún no hay calificaciones
- Redox Evau PDFDocumento2 páginasRedox Evau PDFRebeca HerreraAún no hay calificaciones
- Semana 1guía de Problemas para La Práctica 1Documento9 páginasSemana 1guía de Problemas para La Práctica 1Nora Cadenillas FernàndezAún no hay calificaciones
- Ejercicios T3. Estudio de Las Transformaciones QuímicasDocumento4 páginasEjercicios T3. Estudio de Las Transformaciones QuímicasiretchaiAún no hay calificaciones
- Pautema 5Documento3 páginasPautema 5joseAún no hay calificaciones
- Ejercicico de EstequiometriaDocumento3 páginasEjercicico de EstequiometriaEdith CcahuaAún no hay calificaciones
- Ejercicios Repaso EstequiometríaDocumento4 páginasEjercicios Repaso EstequiometríacarlotaarosaAún no hay calificaciones
- RedoxDocumento2 páginasRedoxEvaAún no hay calificaciones
- Nivel2 Serie4Documento14 páginasNivel2 Serie4Lucho HuamaniAún no hay calificaciones
- Ejercicios RedoxDocumento13 páginasEjercicios RedoxJusta CAÑIBANO PALMEROAún no hay calificaciones
- Q SSM Dom Sem04Documento2 páginasQ SSM Dom Sem04Alejandro Bonifacio SánchezAún no hay calificaciones
- Ejercicios de Redox Con RespuestasDocumento14 páginasEjercicios de Redox Con RespuestasEugenia BogarinAún no hay calificaciones
- Clase 2 EstequiometriaDocumento4 páginasClase 2 EstequiometriaMayker Suasnabar HuarcayaAún no hay calificaciones
- 4 RedoxDocumento5 páginas4 Redoxoskarg4420Aún no hay calificaciones
- 3 - Química - Taller - Semana 15Documento5 páginas3 - Química - Taller - Semana 15roman carlos acevedo espinolaAún no hay calificaciones
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Informe de La Práctica No. 2. Reacciones de SEAr, Obtención de Amarillo MartiusDocumento8 páginasInforme de La Práctica No. 2. Reacciones de SEAr, Obtención de Amarillo MartiusAlejandra Hernández ValenzoAún no hay calificaciones
- Ventanilla Única de Comercio Exterior VUCEDocumento34 páginasVentanilla Única de Comercio Exterior VUCEedisson ayalaAún no hay calificaciones
- Pre Informe AlcoholesDocumento6 páginasPre Informe AlcoholesCristina Saldarriaga GarcésAún no hay calificaciones
- Quimica Cepu 05 de OctubreDocumento4 páginasQuimica Cepu 05 de OctubrePaulo Cesar Guerrero BustamanteAún no hay calificaciones
- Acido CitricoDocumento78 páginasAcido CitricoLolaAún no hay calificaciones
- HDSM - Agua AcidulaDocumento8 páginasHDSM - Agua AcidulaJUANAún no hay calificaciones
- Práctica 3 - 8Documento8 páginasPráctica 3 - 8EVELIN ANYUL CONTRERAS MENDOZAAún no hay calificaciones
- Quimica Eje IiiDocumento12 páginasQuimica Eje IiijesusAún no hay calificaciones
- Quim General EjxDocumento9 páginasQuim General EjxCarlos Alfredo Rodriguez LoayzaAún no hay calificaciones
- La IndustriaDocumento27 páginasLa IndustriaEvelyn MadridAún no hay calificaciones
- Obtención Del Etileno.Documento21 páginasObtención Del Etileno.Ejemplo_dg79100% (1)
- HOJA DE DATOS DE SEGURIDAD Ácido Sulfurico 98%Documento10 páginasHOJA DE DATOS DE SEGURIDAD Ácido Sulfurico 98%Rita IbarraAún no hay calificaciones
- Problemas Resueltos de Química AnalíticaDocumento11 páginasProblemas Resueltos de Química AnalíticaGabriela OM100% (1)
- Informe1 de Quimica OrganicaDocumento5 páginasInforme1 de Quimica Organicacanal sin nombreAún no hay calificaciones
- Aguas Acidas en MinaDocumento16 páginasAguas Acidas en MinaAlex Garcia CruzadoAún no hay calificaciones
- El Globo LibreDocumento75 páginasEl Globo LibreDaniela Medina AlarcónAún no hay calificaciones
- Economia Del AtomoDocumento3 páginasEconomia Del AtomoMiroslaba CharlesAún no hay calificaciones
- Practica de RedoxDocumento3 páginasPractica de RedoxLuca RiosAún no hay calificaciones
- Practica 6 QuimicaDocumento5 páginasPractica 6 QuimicaAntonio HernandezAún no hay calificaciones
- 9 Clase Anfigenos PDFDocumento79 páginas9 Clase Anfigenos PDFWalter Rivas100% (2)
- Taller de QuimicaDocumento3 páginasTaller de QuimicaJuneys OsorioAún no hay calificaciones
- Clase 2 Calculo EstequimetricosDocumento36 páginasClase 2 Calculo EstequimetricosChristian BahirAún no hay calificaciones
- SulfonacionDocumento11 páginasSulfonacionpedro aguilar quitoAún no hay calificaciones