Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Estructura de Aminoácidos
Cargado por
Diego Carreon0 calificaciones0% encontró este documento útil (0 votos)
10 vistas3 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
10 vistas3 páginasEstructura de Aminoácidos
Cargado por
Diego CarreonCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
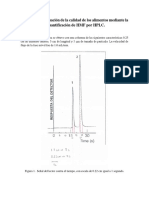
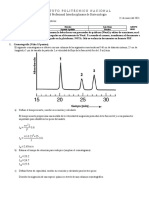
Estructura de aminoácidos.
Todos los organismos emplean los mismos 20 aminoácidos como bloques
constructivos para armar las moléculas de proteína. A estos 20 aminoácidos se
les llama aminoácidos comunes, estándar o normales. A pesar de la poca
cantidad de los aminoácidos, se puede obtener una variedad enorme de
distintos polipéptidos al unir los 20 aminoácidos comunes para formar
distintas combinaciones.
Los aminoácidos se llaman así porque son derivados aminados de ácidos
carboxílicos. En los 20 aminoácidos comunes, los grupos amino y carboxilo
están unidos al mismo átomo de carbono: el átomo de carbono a. Así, todos
los aminoácidos estándar que contienen las proteínas son a-aminoácidos. Al
carbono a se unen otros dos sustituyentes: un átomo de hidrógeno y una
cadena lateral (R) que es única para cada aminoácido
En 19 de los 20 aminoácidos que se usan en la biosíntesis de proteínas, el
átomo de carbono a es quiral, o asimétrico, porque tiene cuatro grupos
diferentes unidos a él. La excepción es la glicina, cuyo grupo R sólo es un átomo
de hidrógeno (la molécula no es quiral, porque el átomo de carbono a está
unida a dos átomos idénticos de hidrógeno). Los 19 aminoácidos quirales
pueden, en consecuencia, existir como estereoisómeros. Los estereoisómeros
son compuestos que tienen la misma fórmula molecular, pero difieren en el
orden o configuración de sus átomos en el espacio. Los dos estereoisómeros
son moléculas distintas que no se pueden Inter convertir con facilidad entre sí
ya que un cambio de configuración requiere romper uno o más enlaces. Los
estereoisómeros de aminoácidos no son imágenes especulares (es decir,
imágenes en espejo) superponibles; a dichos estereoisómeros se les llama
enantiómeros. Dos de los 19 aminoácidos quirales, la isoleucina y la treonina,
presentan dos átomos quirales de carbono cada uno.
También podría gustarte
- 3BM2 MC Ejp P12Documento6 páginas3BM2 MC Ejp P12Diego CarreonAún no hay calificaciones
- Chitosan A VersaDocumento8 páginasChitosan A VersaDiego CarreonAún no hay calificaciones
- Actividad 3 CIP PDFDocumento2 páginasActividad 3 CIP PDFDiego CarreonAún no hay calificaciones
- Actividad 4 Examen CIP PDFDocumento2 páginasActividad 4 Examen CIP PDFDiego CarreonAún no hay calificaciones
- 1 s2.0 S0168365906007061 MainDocumento8 páginas1 s2.0 S0168365906007061 MainDiego CarreonAún no hay calificaciones
- ViscosidadDocumento4 páginasViscosidadDiego CarreonAún no hay calificaciones
- TAMIZADODocumento4 páginasTAMIZADODiego CarreonAún no hay calificaciones
- Practica 2. - Determinación de Constantes Cinéticas, KM y Vmax y Medición de La Actividad Enzimatica en Enzimas LibresDocumento9 páginasPractica 2. - Determinación de Constantes Cinéticas, KM y Vmax y Medición de La Actividad Enzimatica en Enzimas LibresDiego CarreonAún no hay calificaciones
- Analisis de DatosDocumento6 páginasAnalisis de DatosDiego CarreonAún no hay calificaciones
- CalifDocumento1 páginaCalifDiego CarreonAún no hay calificaciones
- P1 BioconverDocumento10 páginasP1 BioconverDiego CarreonAún no hay calificaciones
- Difusividad de Gases PreviaDocumento8 páginasDifusividad de Gases PreviaDiego CarreonAún no hay calificaciones
- Difusividad Térmica PreviasDocumento6 páginasDifusividad Térmica PreviasDiego CarreonAún no hay calificaciones
- Tarea 2 Búsqueda de RaícesDocumento50 páginasTarea 2 Búsqueda de RaícesDiego CarreonAún no hay calificaciones
- 3BM2 MC Ejp P11Documento2 páginas3BM2 MC Ejp P11Diego CarreonAún no hay calificaciones
- 3BM2 MC Ejp P10Documento4 páginas3BM2 MC Ejp P10Diego CarreonAún no hay calificaciones
- Diego Carreon - 3er Examen MC Enero 2021aDocumento5 páginasDiego Carreon - 3er Examen MC Enero 2021aDiego CarreonAún no hay calificaciones