Documentos de Académico
Documentos de Profesional
Documentos de Cultura
03 Estequiometria
03 Estequiometria
Cargado por
johan peña alencar0 calificaciones0% encontró este documento útil (0 votos)
5 vistas3 páginasTítulo original
03 ESTEQUIOMETRIA
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
5 vistas3 páginas03 Estequiometria
03 Estequiometria
Cargado por
johan peña alencarCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
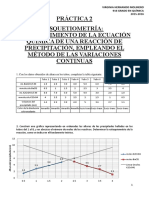
EJERCICIOS DE ESTEQUIOMETRIA
PLANTEAMIENTO ECUACIÓN BALANCEADA
1. Calcule la masa en Kg de hierro (Fe) que se obtendrá 160 56 32g/n
al reaccionar 50Hlb de óxido férrico (Fe 2O3). ¿Se cumple la
Ley de la conservación de la masa? 2Fe2 O 3→ 4 Fe +3 O2
2. ¿Cuántas moléculas de amoniaco (NH 3) se obtiene si 28 2 17g/n
reaccionan 50pg de nitrógeno (N2) con suficiente
hidrogeno? N +3 H 2 →2 NH 3
2
3. En el proceso de obtención del Aluminio se producen
600Kg de Aluminio a partir de una masa de Óxido de 102 27 32 g/n
aluminio. ¿Cuál es el número de moles de Óxido de
aluminio utilizado en el proceso? Calcule el volumen de
2 Al 2 O 3 → 4 Al +3 O 2
oxigeno (ft3) producido
4. El cohete secundario del transbordador espacial usa
Aluminio y Perclorato de amonio, en función a su reacción 27 118 135 102 18 30g/n
calcule: a) masa de perclorato de amonio usado para 3 Al +3 NH ClO → AlCl + Al O +6 H O+3 NO
4 4 3 2 3 2
reaccionar una 1000lb de Aluminio; b) volumen del NO.
5. Se han producido 2,50 Tg de óxido áurico a partir de 197 32 448 g/n
una masa desconocida de oro. Calcule la cantidad de
átomos de oro utilizados y el volumen de oxígeno (in 3). 4 Au +3 O2 →2 Au2 O3
6. ¿Cuántas moléculas de clorato de aluminio (Al(ClO 3)) 81 27 279 2g/n
se producirán si reaccionan 2 toneladas de aluminio (Al)
con suficiente ácido clórico?
6 HClO3 +2 Al →2 Al(ClO3 )3 +3 H 2
7. Se hacen reaccionar 300oz de Benceno con suficiente
oxígeno para su combustión. Calcule: a) moléculas de 78 32 44 18 g/n
anhídrido (GN); b) volumen de agua (yd 3); c) masa de 2C6 H 6 +15O2 →12CO 2+6H2 O
oxígeno utilizado (Moz).
8. El clorato de potasio se descompone por calor en
g
Cloruro de potasio y Oxígeno. Se han producido 20dm3 de 32
2 KClO 123 75 n
Oxígeno (CNTP). ¿Cuántas moléculas de Clorato de 3 ( s ) → 2 K Cl ( s ) +3 O 2 (g)
potasio se usaron (nN)?
9. ¿Cuántas moléculas de Hidróxido de aluminio 78 98 342 18g/n
(Al(OH)3) reaccionaran con 150 moléculas de Ácido 2 Al( OH) +3 H SO → Al (SO ) +6 H 2 O
sulfúrico (H2SO4) para producir Sulfato de aluminio y agua? 3 2 4 2 43
10. Reacciona 0,750Kg de cromo con ácido clorhídrico y
ha producido cloruro crómico. Calcule la masa (ton) de 52 37 160 2 g/n
cloruro crómico y el volumen de hidrogeno (m3). 2Cr +6 HCl →2 CrCl3 +3 H 2
11. Al reaccionar una muestra de óxido férrico con 25%
de pureza se obtuvieron 1,5x103 átomos de Hierro. 160 28 56 44 g/n
Determine: a) masa de la muestra (mg); b) moléculas de
anhídrido usados; c) moles de anhídrido producidas. Fe 2 O3 +3 CO →2 Fe +3 CO2
PLANTEAMIENTO ECUACIÓN BALANCEADA
12. Al reaccionar una muestra de 2,6x10 3Kg de óxido 160 28 56 44 g/n
férrico se obtuvieron 1,5x103 Kg Hierro. Determine el
grado de pureza de la muestra de óxido férrico. Fe 2 O 3 +3 CO →2 Fe +3 CO2
13. En el proceso de obtención del Aluminio se producen
el volumen de oxigeno fue de 450dm3. Sabiendo que la 102 27 32 g/n
masa de la muestra de óxido de aluminio era 2000 g. 2 Al2 O 3 →4 Al +3 O2
¿Cuál es el porcentaje de pureza de la muestra de Óxido?
14. Se hacen reaccionar 250 Zg de oro al 75 % de
pureza con suficiente cantidad de oxígeno. Calcule la 197 32 448 g/n
cantidad de átomos de oxígeno y la cantidad de sustancia
de óxido áurico.
4 Au +3 O2 →2 Au2 O3
15. Han reaccionado 1500mg de una muestra de ácido
con 0,0529oz de una muestra de metal, se han producido 85 27 279 2 g/n
2,2mlb de sal. Calcule: a) pureza de ambos reactivos; b) 6 HClO3 +2 Al →2 Al (ClO3 )3 +3 H 2
volumen del hidrogeno producido en CNTP
16. Una muestra de óxido de aluminio presenta una
pureza de 40%. Y se produce oxígeno, que fue 102 27 32 g/n
almacenado en un cilindro de 50 cm de altura y 5 cm de
radio. Calcule: a) la masa la muestra de óxido de aluminio;
2 Al2 O 3 →4 Al +3 O2
b) átomos de aluminio.
17. Reacciona una muestra de Magnesio con suficiente
ácido clorhídrico y se forma 1500mg de sal. La pureza del
Mg 24+ 2 H Cl37 → Mg Cl 96 2 g /n
metal es del 35 %. Calcule: a) la masa de la muestra de 2 +H2
metal; b) radio (in) de la esfera que almacena el hidrogeno
producido.
18. Al reaccionar una muestra de 8 oz de Hierro con 10 oz
de ácido clorhídrico se han producido 14,77 oz de sal. 56 37 164 2 g/n
Determine el grado de pureza de la muestra de hierro. ¿el 2 Fe +6 HCl →2 FeCl 3 +3 H 2
ácido esta puro?
19. Una muestra de 30 lb de benceno (C 6H6) reacciona
con 60 lb de Bromo (Br 2) y generan 30 lb de bromo
C 6 H 78 160 157
benceno (C6H6Br). Calcule a) pureza del benceno; b) 6 + Br2 → C 6 H 5 Br + HBr 81 g /n
moléculas del ácido bromhídrico; c) reacciono todo el
bromo.
20. La combustión de la glucosa genera por cada mol de
azúcar 38 moles de ATP. Reacciona una muestra de 60 g g
18
de glucosa y se producen 44 g de anhídrido carbónico. C 6 H 12 O 180 32 44 n
6 +6 O 2 → 6 C O 2 +6 H 2 O
Calcule: a) pureza de la glucosa; b) cantidad de sustancia
formada de agua; C) moles de ATP producido.
21. Reaccionan 50 Kg de aluminio con 50 Mg de oxígeno. 27 32 102g/n
Calcule: a) cantidad de sustancia de producto; b)
partículas sobrantes 4 Al + 3O2 →2 Al 2 O3
22. Reacciona 1,5 Kg de amoniaco con 80dm3 de 17 18
32 30g/n
Oxígeno. Calcule: a) masa de anhídrido (lb); b) cantidad
de sustancia de agua; c) moléculas del reactivo que sobra. 4 NH +5O →6 H O +4NO
3 2 2
PLANTEAMIENTO ECUACIÓN BALANCEADA
23. Reaccionan 3,5x1030N de aluminio con 270 oz de 81 279
ácido clórico. Calcule: a) masa de sal (lb); b) volumen de 27 2g/n
hidrogeno (m3); c) relación cuantitativa entre los moles de 6 HClO +2Al →2 Al (ClO ) +3 H
metal y gas.
3 33 2
24. Reaccionan 2,5x1015N de ácido sulfúrico con 5,0 ton
de hidróxido de aluminio. Calcule: a) masa (Tlb) de sal; b) 78 98 342 18g/n
cantidad de sustancia de agua; c) relación cuantitativa 2 Al ( OH) +3 H SO → Al (SO ) +6 H 2 O
entre las masas de hidróxido y agua 3 2 4 2 43
2 5 . Combustionan 1200 mg de benceno con 3692 mg de 78 32 44 18 g/n
oxígeno. Calcule: a) moléculas de agua; b) volumen de
anhídrido. ¿Hubo combustión completa? 2C6 H 6 +15O2 →12CO 2+6H2 O
2 6 . Reaccionan 2Tlb de ácido clórico con 2Toz de
aluminio. Calcule: a) radio de la esfera donde se 85 27 279 2 g/n
almacenara el hidrogeno obtenido; b) moléculas de la 6 HClO3 +2 Al →2 Al (ClO3 )3 +3 H 2
sal producida; c) moles sobrantes.
2 7 . Calcule la masa de sal que se producirá si reaccionan
7x10 8 nn de ácido con 2,5x10 24 µlb del metal. 81 279
27 2g/n
¿Cuantas partículas sobran?, ¿Cuál será la masa del 6 HClO +2Al →2 Al (ClO ) +3 H
hidrogeno desprendido? ¿En que se parecen la cantidad 3 33 2
de partículas de ácido y de hidrogeno?
2 8 . Reacciona 2,2 Hg de amoniaco con 8,0 m3 de
Oxígeno. Calcule: a) masa de anhídrido (Toz); b) 17 32 18 30g/n
cantidad de sustancia de agua; c) moléculas del reactivo 4 NH +5O →6 H O +4NO
que sobra 3 2 2
29. Combustionan 25 moles de benceno con 300 g de 78 32 44 18 g/n
oxígeno. Calcule: a) moléculas de agua; b) volumen
de anhídrido. ¿Hubo combustión completa? 2C6 H 6 +15O2 →12CO 2+6H2 O
30. Reaccionan 800 lb de hierro con 10Dn de ácido. 56 37 164 2 g/n
Calcule: a) masa (moz) de sal; b) volumen de H 2; c)
relación cualitativa entre las masa de metal y sal.
2 Fe +6 HCl →2 FeCl 3 +3 H 2
31. Reaccionan 8,0x1030N de hierro con 100g de ácido. 56 37 164 2 g/n
Calcule: a) masa (moz) de sal; b) partículas de H 2; c)
relación cualitativa entre las masa de metal y sal.
2 Fe +6 HCl →2 FeCl 3 +3 H 2
32. Reaccionan 50g de aluminio con 50g de oxígeno. 27 32 102g/n
Calcule: a) cantidad de sustancia de producto; b)
partículas sobrantes 4 Al + 3O2 →2 Al 2 O3
33. Se hacen reaccionar iguales cantidades de masa de
reactivos. Calcule: a) partículas de sal; b) volumen 78 98 342 18g/n
2 Al( OH)3+3 H 2 SO 4 → Al ( SO ) +6 H 2 O
de hidrogeno producido; c) cantidad de sustancia 2 4 3
sobrante.
También podría gustarte
- ESTEQUIOMETRIADocumento3 páginasESTEQUIOMETRIALuis David Bocanegra CarbajalAún no hay calificaciones
- Problem A RioDocumento5 páginasProblem A RioVeronica Rodriguez OlveraAún no hay calificaciones
- TALLER No.2 ESTEQUIOMETRIADocumento5 páginasTALLER No.2 ESTEQUIOMETRIADANIELA PEREA GIRALDOAún no hay calificaciones
- Métodos Peróxidos y TBARSDocumento5 páginasMétodos Peróxidos y TBARSSoy Genial DaniAún no hay calificaciones
- 03 Estequiometria Junio 2020Documento3 páginas03 Estequiometria Junio 2020Gabriel ArraizAún no hay calificaciones
- Estequiometria IIDocumento3 páginasEstequiometria IIAndy IbarraAún no hay calificaciones
- Ejercicios de Reacciones Químicas - Reactivos ImpurosDocumento1 páginaEjercicios de Reacciones Químicas - Reactivos ImpurosClases particulares en la LagunaAún no hay calificaciones
- Calculos Estequiometricos QUIMICADocumento22 páginasCalculos Estequiometricos QUIMICAJose Gutierrez50% (4)
- Quimica II y III ParcialDocumento22 páginasQuimica II y III Parcialaminta ochoa0% (1)
- Estequiometria 2023Documento3 páginasEstequiometria 2023Cintia anabel QuirogaAún no hay calificaciones
- Ejercicios Quimica EstequiometriaDocumento6 páginasEjercicios Quimica EstequiometriaEnmanuel De la PazAún no hay calificaciones
- Ficha 7. Reacciones Químicas.Documento12 páginasFicha 7. Reacciones Químicas.Manlorfer 11Aún no hay calificaciones
- Boletin - de - Problemas - Tema 3Documento2 páginasBoletin - de - Problemas - Tema 3José Javier Gómez Sánchez100% (1)
- Problemas Coleccion Estequiometria ResueltosDocumento6 páginasProblemas Coleccion Estequiometria ResueltosAlejandro RapalliniAún no hay calificaciones
- Estequiometría 1Documento8 páginasEstequiometría 1Nicolas CastilloAún no hay calificaciones
- Guia 2 - Estequiometria 2023Documento4 páginasGuia 2 - Estequiometria 2023pedro cumpleAún no hay calificaciones
- Tarea Estequiometrà - A (IVP)Documento1 páginaTarea Estequiometrà - A (IVP)Camila CincoAún no hay calificaciones
- Ejercicios Estequiometria - 2-22Documento3 páginasEjercicios Estequiometria - 2-22JOSE ABDIELAún no hay calificaciones
- Reacciones 1 BachilleratoDocumento3 páginasReacciones 1 BachilleratoAmalia PerezAún no hay calificaciones
- Ejercicios de Reacciones QuímicasDocumento2 páginasEjercicios de Reacciones QuímicasClases particulares en la LagunaAún no hay calificaciones
- 5TO - Ejercicios EstequiometríaDocumento4 páginas5TO - Ejercicios EstequiometríaEddy Amache RamosAún no hay calificaciones
- EJERCICIOS DE ESTEQUIOMETRÍA 1º Bach Con SolucionesDocumento6 páginasEJERCICIOS DE ESTEQUIOMETRÍA 1º Bach Con SolucionesJosé LuisAún no hay calificaciones
- Taller de EstequiometríaDocumento5 páginasTaller de EstequiometríaValentina Rubio AngelAún no hay calificaciones
- Problemas de EstequiometríaDocumento0 páginasProblemas de EstequiometríaaureliocolanAún no hay calificaciones
- Estequiometría - QuímicaDocumento3 páginasEstequiometría - QuímicaPedro Rafael Hurtado AlvaradoAún no hay calificaciones
- Estequiometria IIDocumento3 páginasEstequiometria IIMIGUEL ARRIAGADAAún no hay calificaciones
- Metalurgia 2014Documento4 páginasMetalurgia 2014Luis VacaAún no hay calificaciones
- Taller EstequiometríaDocumento2 páginasTaller EstequiometríaAngely GiraldoAún no hay calificaciones
- Practico4 2015Documento2 páginasPractico4 2015Carlos A. Diaz100% (1)
- Segunda Semana - OdtDocumento2 páginasSegunda Semana - OdtiIDAITaAún no hay calificaciones
- PC3 - Relaciones EstequiométricasDocumento2 páginasPC3 - Relaciones EstequiométricasZoila TorresAún no hay calificaciones
- TP-reacciones QuimicasDocumento4 páginasTP-reacciones QuimicasdelfinaAún no hay calificaciones
- Problemas EstequiométricosDocumento3 páginasProblemas EstequiométricosjramosburgosAún no hay calificaciones
- Ejercicios Tema 2Documento4 páginasEjercicios Tema 2mrcorreosomAún no hay calificaciones
- Ejercicios Tema 4. Química GeneralDocumento5 páginasEjercicios Tema 4. Química GeneralPablo Molero MartínAún no hay calificaciones
- Problemas EstequiométricosDocumento3 páginasProblemas Estequiométricosmgarveg653Aún no hay calificaciones
- Ejercicios de Reacciones Químicas Con Reactivo LimitanteDocumento1 páginaEjercicios de Reacciones Químicas Con Reactivo LimitanteClases particulares en la LagunaAún no hay calificaciones
- Calculos EstequiometricosDocumento12 páginasCalculos Estequiometricoscaballero_leon82Aún no hay calificaciones
- Redox SelecDocumento2 páginasRedox Selecapi-3722779100% (1)
- Taller Estequiometria 2013-bDocumento4 páginasTaller Estequiometria 2013-bCarlos MojicaAún no hay calificaciones
- Taller EstequiometríaDocumento3 páginasTaller Estequiometríaciro alexander cristancho peraltaAún no hay calificaciones
- Recurso - 1653756794158 - Semana 09 - QuímicaDocumento3 páginasRecurso - 1653756794158 - Semana 09 - Químicakatherin becerraAún no hay calificaciones
- 1BtoProfesorActividadesQuimica3Eva PDFDocumento14 páginas1BtoProfesorActividadesQuimica3Eva PDFmusic MúsicaAún no hay calificaciones
- Taller 4Documento1 páginaTaller 4GABRIEL ALEJANDRO ROJAS ESCOBARAún no hay calificaciones
- FUII7T7I7YTDocumento3 páginasFUII7T7I7YTRamiro Ramírez CaputtoAún no hay calificaciones
- Actividad EstequiometriaDocumento2 páginasActividad EstequiometriaDavid Heredia TapiaAún no hay calificaciones
- Ejercicio de MetalurgiaDocumento4 páginasEjercicio de MetalurgiaSAMUEL SANCHEZ0% (1)
- Práctica+calificada+12+ (1) 221121 233813Documento14 páginasPráctica+calificada+12+ (1) 221121 233813JOSE LUIS DEL CASTILLO MARTINEZAún no hay calificaciones
- Reactivo Limitante y ExcesoDocumento2 páginasReactivo Limitante y ExcesoErik Michael Laura FloresAún no hay calificaciones
- Problemas Estequiometria y DisolucionesDocumento10 páginasProblemas Estequiometria y DisolucionesElena Paz O'Neill TarquisAún no hay calificaciones
- Tema 8 Problemas EstequiometriaDocumento1 páginaTema 8 Problemas EstequiometriaNomorememes JoaAún no hay calificaciones
- Tarea GlobalDocumento8 páginasTarea GlobalXavier VillonAún no hay calificaciones
- Adicional EstequiometriaDocumento8 páginasAdicional EstequiometriaLautaro Roa0% (1)
- Tema 7. Estequiometría Ejercicios BDocumento4 páginasTema 7. Estequiometría Ejercicios BOskarAún no hay calificaciones
- Estequiometría Guia CompletaDocumento3 páginasEstequiometría Guia CompletanicolasAún no hay calificaciones
- Ejercicios de Estequiometria Reactivo Limitante Impurezas y RendimientoDocumento2 páginasEjercicios de Estequiometria Reactivo Limitante Impurezas y RendimientoRuddy Juan0% (4)
- Ejercicios T3. Estudio de Las Transformaciones QuímicasDocumento4 páginasEjercicios T3. Estudio de Las Transformaciones QuímicasiretchaiAún no hay calificaciones
- Guía Estequiometría 1Documento3 páginasGuía Estequiometría 1Marcelo RojasAún no hay calificaciones
- QUÍMICA II Equilibrio QuímicoDocumento79 páginasQUÍMICA II Equilibrio Químicojohan peña alencarAún no hay calificaciones
- EQUILIBRIO IONICO Ácidos Fuertes y Débiles 2020Documento34 páginasEQUILIBRIO IONICO Ácidos Fuertes y Débiles 2020johan peña alencarAún no hay calificaciones
- PRÁCTICA #1 ModificadaDocumento8 páginasPRÁCTICA #1 Modificadajohan peña alencarAún no hay calificaciones
- 05 GasesDocumento2 páginas05 Gasesjohan peña alencarAún no hay calificaciones
- 02 Cantidad de SustanciaDocumento3 páginas02 Cantidad de Sustanciajohan peña alencar100% (1)
- 01 Magnitudes y Unidades 2019Documento2 páginas01 Magnitudes y Unidades 2019johan peña alencarAún no hay calificaciones
- 04 SolucionesDocumento3 páginas04 Solucionesjohan peña alencarAún no hay calificaciones
- 05 GasesDocumento2 páginas05 Gasesjohan peña alencarAún no hay calificaciones
- 02 Cantidad de SustanciaDocumento3 páginas02 Cantidad de Sustanciajohan peña alencar100% (1)
- Aplicación de La Ceniza en Concreto - En.esDocumento19 páginasAplicación de La Ceniza en Concreto - En.esHENRY STEVE GARCES ROMEROAún no hay calificaciones
- Tema 6 - Identificación de Las Materias PrimasDocumento8 páginasTema 6 - Identificación de Las Materias Primasangela maimoAún no hay calificaciones
- EtinoDocumento8 páginasEtinoSebastian RiosAún no hay calificaciones
- Rev A 101 Steps To Better Histology Full Es ESDocumento138 páginasRev A 101 Steps To Better Histology Full Es ESNicole CespedesAún no hay calificaciones
- Tarea de Quimica Semana 07Documento1 páginaTarea de Quimica Semana 07JESSICA NATHALIA CANO VENEROSAún no hay calificaciones
- Reporte 3. Determinación Del Punto de FusiónDocumento14 páginasReporte 3. Determinación Del Punto de FusiónCarmen RodríguezAún no hay calificaciones
- MI Porcelanato Gres Porcel Nico y Cer Mico VS4Documento3 páginasMI Porcelanato Gres Porcel Nico y Cer Mico VS4Giuliana MirandaAún no hay calificaciones
- FILTRACIÓNDocumento38 páginasFILTRACIÓNALVES BROLIN MUCHA MALLAUPOMAAún no hay calificaciones
- Recocidos de Ablandamiento - J. ApraizDocumento10 páginasRecocidos de Ablandamiento - J. Apraizcamilo francoAún no hay calificaciones
- Clasificación de Los DetectoresDocumento24 páginasClasificación de Los DetectoresLuis David Vallejos PantojaAún no hay calificaciones
- Daryza 2024Documento7 páginasDaryza 2024Consorcio Facomp S.A.C.Aún no hay calificaciones
- Taller de Procesamiento BioquímicoDocumento4 páginasTaller de Procesamiento BioquímicoTrisAún no hay calificaciones
- Cuadernillo QADocumento114 páginasCuadernillo QADiana VillalbaAún no hay calificaciones
- Calculo Malla A Tierra-Valores Que Cumplen-La EneaDocumento1 páginaCalculo Malla A Tierra-Valores Que Cumplen-La EneaJorgeGuzman100% (1)
- Tarea de TermodinámicaDocumento5 páginasTarea de TermodinámicaCarlos Salazar PrinzAún no hay calificaciones
- Practica No.2 Química Orgánica I Obtención de Una GrasaDocumento6 páginasPractica No.2 Química Orgánica I Obtención de Una GrasaStefany RodriguezAún no hay calificaciones
- Articulo Op3 ExtraccionDocumento2 páginasArticulo Op3 ExtraccionmiguelAún no hay calificaciones
- HS Cemento Solvente PVCDocumento2 páginasHS Cemento Solvente PVCControl Pérdidas Bajo CaucaAún no hay calificaciones
- Mapa Conceptual BIOTECNOLOGIADocumento2 páginasMapa Conceptual BIOTECNOLOGIAYARINETH SOLANO MANOSALVAAún no hay calificaciones
- BIOLOGIA GenesDocumento31 páginasBIOLOGIA GenesHugo SierraAún no hay calificaciones
- Almacenes Dispositivos MedicosDocumento6 páginasAlmacenes Dispositivos MedicosNahum Banda ZuñigaAún no hay calificaciones
- Marco Teorico Neutralización y Evaporación UnmsmDocumento4 páginasMarco Teorico Neutralización y Evaporación UnmsmBryanAlexanderJuscamaytaCosme0% (2)
- Teoria Grafos TimelineDocumento4 páginasTeoria Grafos TimelineOziel Alejandres NavarroAún no hay calificaciones
- Informe de Laboratorio Estequiometria y Estado GaseosoDocumento8 páginasInforme de Laboratorio Estequiometria y Estado Gaseosojuan david acevedo cubidesAún no hay calificaciones
- Labquimica 4Documento12 páginasLabquimica 4Nicole TorresAún no hay calificaciones
- Silabo Laboratorio de Ingeniería Química I-FDocumento4 páginasSilabo Laboratorio de Ingeniería Química I-FmeryAún no hay calificaciones
- Caracterización de Arcillas Del - Estado de GuanajuatoDocumento8 páginasCaracterización de Arcillas Del - Estado de GuanajuatoCasandra FierroAún no hay calificaciones
- Práctica 2Documento3 páginasPráctica 2Virginia Hernando67% (3)
- Unidades QuimicasDocumento7 páginasUnidades QuimicasanibalAún no hay calificaciones