Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ejemplo Aplicativo de Un Modelamiento
Cargado por
LuisAlexRoaCondoriTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Ejemplo Aplicativo de Un Modelamiento
Cargado por
LuisAlexRoaCondoriCopyright:
Formatos disponibles
EJEMPLO APLICATIVO DE UN MODELAMIENTO
I. RESUMEN DEL MÉTODO
II. EL OBJETIVO
III. MODELAMIENTO MATEMÁTICO DE UN REACTOR DE STEAM CRACKING
1. Ecuación estequiometria
La pirolisis del etano esta presentado por la ecuación de reacción química irreversible de
primer orden en el rango de temperatura de 626.58 – 926.85 °C.
C 2 H 6 (g) →C 2 H 4 (g )+ H 2(g) (1)
A temperaturas de aproximadamente 980-1200 ° C, los enlaces C-H de las moléculas de
etano se disocian de manera que el etileno y el hidrógeno se producen como productos
principales. La conversión de etano en etileno puede llegar hasta el 65-70%Propiedades
físicas y datos para la reacción de pirólisis de etano.
Propiedades físicas y datos para la reacción de pirólisis de etano
Componente 0
AH 298 (KJ/kgmol) C P (KJ/kgmol K)
A C2 H6 -83820 14.1504+7.549∗1 0−2 T −1.799∗1 0−5 T 2
B C2 H4 52510 1.839+1.19167∗1 0−1 T −3.6515∗1 0−5 T 2
C H2 0 27.012+3.5085∗1 0−3 T +6.9∗1 0 4 T −1
Constante de velocidad de reacción
−36354.6
( )
k =4.717 x 1014 e T
Constantes Universal de los gases.
Kpam3
R=8.314
kgmol K
2. Balance de materia
El reactor de horno se modela como un reactor de flujo pistón. El enfoque implica
establecer el balance de materiales en estado estable sobre un elemento de volumen
diferencial (dV r ) de longitud del reactor (dz ), como se muestra en siguiente figura.
La base es un mol de etano.
Entrada=Salida−Generación+ Acumulación
F A=( F A + dF A ) + (−r A dv r ) +0 (2)
−F AO
r A= d xA (3)
A dz
Para la reacción irreversible de primer orden, la ecuación de velocidad cinética
−r A =K 1 C A (4)
A bajas presiones inferiores a 5 bar se obtiene la concentración de A de la ley de los
gases.
PA
C A= (5)
RT R
Reordenando, se obtiene la velocidad de reacción
y A P tot
r A =−K (6)
RT R
Por lo tanto, para determinar la fracción molar de etano ( y A ), el balance
estequiométrico de las especies que reacción con respecto al elemento de volumen
diferencial se muestra a continuación.
Balance estequiométrico de las especies
Componente Flujo Molar Flujo de salida
A C2 H6 F AO F AO (1−x A )
B C2 H4 0 F AO x A
C H2 0 F AO x A
TOTAL F ¿=F AO F T =F AO + F AO x A =F AO (1+ x A )
Por lo tanto, la fracción molar del etano ( y A ) viene dada por
1−x A
y A= (7)
1+ x A
Reordenando
dx a 1−x A AP Tot
dz
=K ( ( )
1+ x A F AO R T r
) (8)
Utilizando la ecuación de Arrhenius
−363546
( )
K 1=4.717 x 104 e T (9)
Reordenando
−363546
( )
dx a 4.717 x 104 AP Tot e
T
1−x A
( )
r
=⌈ ⌉⌈ ⌉ (10)
dz F AO R Tr 1+ x A
Para un diámetro interno de tubo, presión de reactor y flujo de etano de entrada, el
−363546
4.717 x 104 AP Tot ( )
T
⌉ se mantiene constante y el termino ⌈ e
r
termino ⌈ ⌉ depende
F AO R Tr
de la temperatura.
3. Balance de energía
El balance de energía sobre el elemento de diferencial (dV r ) hace referencial al calor de
reacción, la transferencia de calor del horno en la pared del tubo y los efectos de calor
sensible.
Entrada=Salida−Generación+ Acumulación
20, 21, 22, 26, 28, 29 ,30, 31, 34, 37, 38(caída de presión)
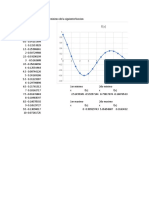
IV. RESULTADOS DE LAINVESTIGACIÓN
V. Tabla 1 de resultado
Grafica de todo XD
VI. ANALISIS
También podría gustarte
- Accion Decisiva Tarea 1 A La 10Documento110 páginasAccion Decisiva Tarea 1 A La 10RAFAEL ALFONSO HERNANDEZ GARCIAAún no hay calificaciones
- Conductividad TérmicaDocumento5 páginasConductividad TérmicaLuisAlexRoaCondori100% (1)
- Carta Poder SimpleDocumento1 páginaCarta Poder Simple!ana!Aún no hay calificaciones
- Sesion Cadenas AlimenticiasDocumento12 páginasSesion Cadenas AlimenticiasBeybi María Ramírez TooresAún no hay calificaciones
- Diseño de Separadores Horizontal ExposiciónDocumento11 páginasDiseño de Separadores Horizontal ExposiciónLuisAlexRoaCondoriAún no hay calificaciones
- Maximizing - Refinery - Integration - With - Flexicoking - Technology - En-Convertido ESDocumento26 páginasMaximizing - Refinery - Integration - With - Flexicoking - Technology - En-Convertido ESLuisAlexRoaCondoriAún no hay calificaciones
- Transporte de HCsDocumento9 páginasTransporte de HCsLuisAlexRoaCondoriAún no hay calificaciones
- Solver Max MinDocumento2 páginasSolver Max MinLuisAlexRoaCondoriAún no hay calificaciones
- Ejemplo Aplicativo de Un ModelamientoDocumento3 páginasEjemplo Aplicativo de Un ModelamientoLuisAlexRoaCondoriAún no hay calificaciones
- Ecuaciones de Estado y Métodos de Coeficientes de ActividadDocumento10 páginasEcuaciones de Estado y Métodos de Coeficientes de ActividadLuisAlexRoaCondoriAún no hay calificaciones
- Diagramas TernariosDocumento6 páginasDiagramas TernariosLuisAlexRoaCondoriAún no hay calificaciones
- Informe Diseño de ColumnaDocumento16 páginasInforme Diseño de ColumnaLuisAlexRoaCondoriAún no hay calificaciones
- Endulzamiento Con AminasDocumento15 páginasEndulzamiento Con AminasLuisAlexRoaCondoriAún no hay calificaciones
- Poder Simple para Recoger DocumentosDocumento1 páginaPoder Simple para Recoger DocumentosVenturo Cordero VillacortaAún no hay calificaciones
- Plantas - TraducirDocumento6 páginasPlantas - TraducirEstrella TaparaAún no hay calificaciones
- Absorcion PDFDocumento34 páginasAbsorcion PDFLuisAlexRoaCondoriAún no hay calificaciones
- Gasoil Automoción: CombustiblesDocumento17 páginasGasoil Automoción: CombustiblesLuisAlexRoaCondoriAún no hay calificaciones
- Ecuaciones de Estado y Métodos de Coeficientes de ActividadDocumento10 páginasEcuaciones de Estado y Métodos de Coeficientes de ActividadLuisAlexRoaCondoriAún no hay calificaciones
- Diagramas TernariosDocumento6 páginasDiagramas TernariosLuisAlexRoaCondoriAún no hay calificaciones
- Diagramas TernariosDocumento6 páginasDiagramas TernariosLuisAlexRoaCondoriAún no hay calificaciones
- Perparacion 7191 PDFDocumento37 páginasPerparacion 7191 PDFjoaquinAún no hay calificaciones
- Reacciones Metodo Del Trapecio y SimpsonDocumento4 páginasReacciones Metodo Del Trapecio y SimpsonLuisAlexRoaCondoriAún no hay calificaciones
- Ecuaciones de Estado y Métodos de Coeficientes de ActividadDocumento10 páginasEcuaciones de Estado y Métodos de Coeficientes de ActividadLuisAlexRoaCondoriAún no hay calificaciones
- Pon Esta Diapo en Ves de La Diapo 5 de Mi ParteDocumento1 páginaPon Esta Diapo en Ves de La Diapo 5 de Mi ParteLuisAlexRoaCondoriAún no hay calificaciones
- Ecuaciones de Estado y Métodos de Coeficientes de ActividadDocumento10 páginasEcuaciones de Estado y Métodos de Coeficientes de ActividadLuisAlexRoaCondoriAún no hay calificaciones
- Importancia y Aplicacion de Disenos ExpeDocumento8 páginasImportancia y Aplicacion de Disenos ExpeLuisAlexRoaCondoriAún no hay calificaciones
- Rx. HalogenaciónDocumento7 páginasRx. HalogenaciónLuisAlexRoaCondoriAún no hay calificaciones
- Aleta CircularDocumento6 páginasAleta CircularLuisAlexRoaCondoriAún no hay calificaciones
- 2 Diagramas P Id PDFDocumento43 páginas2 Diagramas P Id PDFFreddy YugchaAún no hay calificaciones
- Modulo 1Documento16 páginasModulo 1LuisAlexRoaCondoriAún no hay calificaciones
- Marco Teorio Planta PilotoDocumento10 páginasMarco Teorio Planta PilotoLuisAlexRoaCondoriAún no hay calificaciones
- Caracteristicas de La Industria QuimicaDocumento22 páginasCaracteristicas de La Industria Quimicaprincesslove521_4165Aún no hay calificaciones
- Notas de Anexos AmuayDocumento532 páginasNotas de Anexos Amuayluis100% (1)
- Examen Nombre Jorge Ivan Lozano Belmontes 2a Mi PDFDocumento7 páginasExamen Nombre Jorge Ivan Lozano Belmontes 2a Mi PDFJosé Luis-099 EspartanAún no hay calificaciones
- Taller Mecanico Informe CascoDocumento14 páginasTaller Mecanico Informe CascoAriel ChafuelanAún no hay calificaciones
- Rebeldes y PatriotasDocumento54 páginasRebeldes y PatriotasSantiago de la EsperanzaAún no hay calificaciones
- Practica 4 Termodinamica Sustancias PurasDocumento7 páginasPractica 4 Termodinamica Sustancias PurasAdrian Cenobio0% (1)
- Trabajo Final Electricidad Industrial - Electricidad Basica - IiDocumento7 páginasTrabajo Final Electricidad Industrial - Electricidad Basica - IiElvis Enrique Llanque PerazaAún no hay calificaciones
- Replicación ViralDocumento6 páginasReplicación ViralAna VázquezAún no hay calificaciones
- Guia Docente Las Tics en El Aula 9° PDFDocumento7 páginasGuia Docente Las Tics en El Aula 9° PDFMARIA LILIANA BARBOSAAún no hay calificaciones
- Paper GuajiraDocumento6 páginasPaper GuajiraOttón MartínezAún no hay calificaciones
- Metodos NumericosDocumento15 páginasMetodos NumericosYARELYAún no hay calificaciones
- Trabajo Práctico MagnetismoDocumento4 páginasTrabajo Práctico Magnetismontvg_3Aún no hay calificaciones
- Tema 3 - Características Evolutivas de Niños de 0 A 5 AñosDocumento35 páginasTema 3 - Características Evolutivas de Niños de 0 A 5 AñosElizabeth Andrea Espinoza ApazaAún no hay calificaciones
- Catalogo 2022Documento28 páginasCatalogo 2022Yuldor GutierrezAún no hay calificaciones
- Tumbes Taller ViiDocumento86 páginasTumbes Taller ViijessicabeAún no hay calificaciones
- Mexicanos en Las OlimpiadasDocumento23 páginasMexicanos en Las Olimpiadaselvistecnology8Aún no hay calificaciones
- Instructivo Con Documentos-3Documento13 páginasInstructivo Con Documentos-3GAITAN MEZA CATALINAAún no hay calificaciones
- Frederick W Act 4Documento8 páginasFrederick W Act 4alex rochaAún no hay calificaciones
- Aviso - Operacion - Delicias Donde Katin - CHITRÉ (CABECERA)Documento1 páginaAviso - Operacion - Delicias Donde Katin - CHITRÉ (CABECERA)Kathia Steffanie Villarreal SolisAún no hay calificaciones
- Solucionario Guía 2 - Cs Nat - 8voDocumento4 páginasSolucionario Guía 2 - Cs Nat - 8voLiceo República de Italia Enseñanza BásicaAún no hay calificaciones
- Manual Televisor LG 29fs4rk Chassis-Cw62cDocumento32 páginasManual Televisor LG 29fs4rk Chassis-Cw62cJohnathan Castelblanco ChavezAún no hay calificaciones
- Capítulo VDocumento50 páginasCapítulo VJefree Ulices Giron pintoAún no hay calificaciones
- Prueba Siec EspañolDocumento2 páginasPrueba Siec EspañolDoris DuranAún no hay calificaciones
- CL - P - 5to Grado - S5 - Normativa Del Sustantivo I - Numero PDFDocumento3 páginasCL - P - 5to Grado - S5 - Normativa Del Sustantivo I - Numero PDFAnonymous R94xpT5Aún no hay calificaciones
- Areas de Las Principales Figuras Geometricas para Segundo de SecundariaDocumento5 páginasAreas de Las Principales Figuras Geometricas para Segundo de SecundariaAntonioAún no hay calificaciones
- Proyecto ProductivoDocumento60 páginasProyecto ProductivoZairha Daniela Peña BalantaAún no hay calificaciones
- Fundici 2)Documento4 páginasFundici 2)Ariadna VeraAún no hay calificaciones
- Portafolio Teresa BurgaDocumento99 páginasPortafolio Teresa BurgaNicolásAún no hay calificaciones