Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cinetica Quimica
Cargado por
BrenDa Man Cera MolDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cinetica Quimica
Cargado por
BrenDa Man Cera MolCopyright:
Formatos disponibles
Mancera Molina Brenda 2QM1
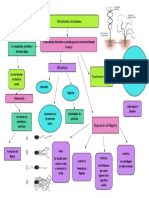
CINETICA QUIMICA
Estudia las velocidades de las reacciones químicas y los factores que afectan a esas
velocidades
Cinética de reacciones
Tipo de reacciones homogéneas
Homogéneas Heterogéneas
Velocidad de reacción Ley de velocidad
Una fase (Más de una
fases)
Medida de la rapidez con Cinética Constante especifica K
que se consumen los Orden de reacción
reactivos o se forma el
Gaseosa
producto.
Liquida Constante de proporcionalidad
Solida Exponentes a los que están elevadas De primer orden Orden Cero de la ley de velocidad, entre v y
Solución Cambio en la concentración de las concentraciones en la ley de las concentraciones de
reactivos (desaparición) o velocidad reactivos.
productos (aparición) en cierto La velocidad es La velocidad de reacción
lapso de tiempo. proporcional a la no depende de la
Respecto a De la reacción primera potencia de la concentración inicial de
v = M/unidad de tiempo total Tiempo de vida media: t1/2
cada reactivo concentración inicial de reactivo = constante.
reactivo ([A]0)
Tiempo que se requiere para que
Exponente al que
Suma de los órdenes [A]t = [A] 0 . e – k t (1) desaparezca la mitad de reactivo.
está elevada la [A]t = - k.t + [A]0
Naturaleza de v = - Δ [A] / aΔt = - Δ de reacción respecto t1/2 = ln2 / k 1er orden
concentración de ó
los reactivos [B] / bΔt = Δ[C] / cΔt = a cada reactivo
cada reactivo t1/2 = [A]0/2k orden cero
Concentración Δ[D] / dΔt ln [A]t = - k t + ln [A] 0 (2)
de los reactivos
Temperatura Dado: a A + b B → c C Ley de velocidad:
Presencia de + d D con: a, b, c y d = v = k [A]0 = k
coeficientes Pueden ser números enteros o
catalizadores Ley de velocidad:
fraccionarios
Se determinan experimentalmente v = k [A] 0
En general no coinciden con los
coeficientes estequiométricos.
También podría gustarte
- DETERMINACIÓN DE PROTEÍNAS POR EL MÉTODO DE LOWRY ManceraMolinaBrenda 5QV2Documento4 páginasDETERMINACIÓN DE PROTEÍNAS POR EL MÉTODO DE LOWRY ManceraMolinaBrenda 5QV2BrenDa Man Cera MolAún no hay calificaciones
- DETERMINACIÓN DE PROTEÍNAS POR EL MÉTODO DE BRADFORD ManceraMolinaBrenda 5QV2Documento8 páginasDETERMINACIÓN DE PROTEÍNAS POR EL MÉTODO DE BRADFORD ManceraMolinaBrenda 5QV2BrenDa Man Cera MolAún no hay calificaciones
- Reporte de Verificacion ManceraMolinaBrenda 5QV2Documento10 páginasReporte de Verificacion ManceraMolinaBrenda 5QV2BrenDa Man Cera MolAún no hay calificaciones
- Practica 4 Semillas y GerminacionDocumento17 páginasPractica 4 Semillas y GerminacionBrenDa Man Cera Mol100% (1)
- Practica Hongos FilamentososDocumento3 páginasPractica Hongos FilamentososBrenDa Man Cera MolAún no hay calificaciones
- Mancera - Molina - Brenda - Seccion1 - Equipo4 - SUSTRATO e INHIBIDORDocumento2 páginasMancera - Molina - Brenda - Seccion1 - Equipo4 - SUSTRATO e INHIBIDORBrenDa Man Cera MolAún no hay calificaciones
- Perfil de Elucion Mancera Molin Brenda 5QV2Documento1 páginaPerfil de Elucion Mancera Molin Brenda 5QV2BrenDa Man Cera MolAún no hay calificaciones
- Qué Prefieres Cenar, 10 Tacos de Pastor o 2 Rebanadas de SandíaDocumento8 páginasQué Prefieres Cenar, 10 Tacos de Pastor o 2 Rebanadas de SandíaBrenDa Man Cera Mol50% (2)
- Auxinas manceraMolinaBrenda 4QM1Documento8 páginasAuxinas manceraMolinaBrenda 4QM1BrenDa Man Cera MolAún no hay calificaciones
- PRÁCTICA 6 BiologiaDocumento7 páginasPRÁCTICA 6 BiologiaBrenDa Man Cera MolAún no hay calificaciones
- Potenciometría DiagramaDocumento1 páginaPotenciometría DiagramaBrenDa Man Cera MolAún no hay calificaciones
- Práctica 1 Organismos de Importancia BiotecnológicaDocumento10 páginasPráctica 1 Organismos de Importancia BiotecnológicaBrenDa Man Cera MolAún no hay calificaciones
- Practica 2 Reacciones de Aminoacidos y ProteinasDocumento4 páginasPractica 2 Reacciones de Aminoacidos y ProteinasBrenDa Man Cera MolAún no hay calificaciones
- Practica 2 Celular y Tedjios de PlantasDocumento11 páginasPractica 2 Celular y Tedjios de PlantasBrenDa Man Cera MolAún no hay calificaciones
- Nematodos TrabajoDocumento17 páginasNematodos TrabajoBrenDa Man Cera MolAún no hay calificaciones
- Tarea 8 de Bioestadística (QBP) 2020Documento6 páginasTarea 8 de Bioestadística (QBP) 2020BrenDa Man Cera MolAún no hay calificaciones
- Indicadores de PHDocumento9 páginasIndicadores de PHBrenDa Man Cera Mol100% (1)
- Examen Correspondiente El Tema 4Documento3 páginasExamen Correspondiente El Tema 4BrenDa Man Cera Mol0% (1)
- Glosario de BacteriologíaDocumento3 páginasGlosario de BacteriologíaBrenDa Man Cera MolAún no hay calificaciones
- Ejercicios Del Tema 3Documento1 páginaEjercicios Del Tema 3BrenDa Man Cera Mol0% (1)
- Movimiento MicrobianoDocumento1 páginaMovimiento MicrobianoBrenDa Man Cera MolAún no hay calificaciones
- Diagrama de Flujo Transposicion BencilicaDocumento2 páginasDiagrama de Flujo Transposicion BencilicaBrenDa Man Cera MolAún no hay calificaciones
- Protistas Superiores e InferioresDocumento5 páginasProtistas Superiores e InferioresBrenDa Man Cera MolAún no hay calificaciones
- Practica 5 Cromatografia TerminadaDocumento6 páginasPractica 5 Cromatografia TerminadaBrenDa Man Cera MolAún no hay calificaciones
- Practica de Presion de Vapor Terminada y CorregidaDocumento5 páginasPractica de Presion de Vapor Terminada y CorregidaBrenDa Man Cera Mol100% (1)
- DIAGRAMA DE FLUJO Sintesis de Ciclo HexanoDocumento2 páginasDIAGRAMA DE FLUJO Sintesis de Ciclo HexanoBrenDa Man Cera MolAún no hay calificaciones
- MicrosDocumento3 páginasMicrosBrenDa Man Cera Mol100% (1)
- Poster Cientifico ExposicionDocumento1 páginaPoster Cientifico ExposicionBrenDa Man Cera Mol0% (1)
- Árbol FilogenéticoDocumento17 páginasÁrbol FilogenéticoBrenDa Man Cera MolAún no hay calificaciones
- Derivados de Los Aminoacidos 2006Documento10 páginasDerivados de Los Aminoacidos 2006CardonaCristianAún no hay calificaciones
- 01 Reglamento para Transporte Con LocomotorasDocumento5 páginas01 Reglamento para Transporte Con Locomotorasrosel prudencio huamanAún no hay calificaciones
- Naturales (Autoguardado)Documento102 páginasNaturales (Autoguardado)Jesus GarciaAún no hay calificaciones
- Induccion ElectromagneticaDocumento37 páginasInduccion ElectromagneticaJoseph Stamuck HidalgoAún no hay calificaciones
- Problemas Sobre La Auto Inductancia e Inductancia MutuaDocumento3 páginasProblemas Sobre La Auto Inductancia e Inductancia MutuaCesar FloresAún no hay calificaciones
- Cuadro Comparativo Redes de TransporteDocumento11 páginasCuadro Comparativo Redes de Transportecesar augusto muñoz ortizAún no hay calificaciones
- ConcurrenciaDocumento5 páginasConcurrenciaDafne ItzelAún no hay calificaciones
- Consideraciones PreworkDocumento17 páginasConsideraciones PreworknicolAún no hay calificaciones
- Jonatan Alzuru Aponte, El Arte Del Rumiar. Origen y Sentido en La Filosofía NietzscheanaDocumento17 páginasJonatan Alzuru Aponte, El Arte Del Rumiar. Origen y Sentido en La Filosofía NietzscheanaalzurujAún no hay calificaciones
- Manual de Aplicación TermanDocumento14 páginasManual de Aplicación TermanJennifer CarrizalesAún no hay calificaciones
- UntitledDocumento27 páginasUntitledMARIA ALVARADOAún no hay calificaciones
- Aviar Segundo ExamenDocumento4 páginasAviar Segundo Examenyacson cano valenciaAún no hay calificaciones
- Infiltraciones en El PieDocumento10 páginasInfiltraciones en El PieIroNy100% (1)
- Catecfinal ENSAYO 1Documento594 páginasCatecfinal ENSAYO 1Yvan MartelAún no hay calificaciones
- Trabajo 2 - TD3Documento23 páginasTrabajo 2 - TD3TatianaAún no hay calificaciones
- Reducto ResDocumento5 páginasReducto ResDavid Tuyo ZangaAún no hay calificaciones
- Grupo Familia Balance 2010Documento79 páginasGrupo Familia Balance 2010Enderson NoriegaAún no hay calificaciones
- GLACIAR Ingenier A S.A.S. - Cooling Towers - Torres de EnfriamientoDocumento1 páginaGLACIAR Ingenier A S.A.S. - Cooling Towers - Torres de EnfriamientoJuan Diego Suarez RiosAún no hay calificaciones
- Tarea para El Segundo Parcial Sección PDocumento3 páginasTarea para El Segundo Parcial Sección PEduardo Velásquez0% (1)
- Triptico de Termica - Motores DieselDocumento2 páginasTriptico de Termica - Motores Dieselwentworth_vpAún no hay calificaciones
- DATACENTERDocumento3 páginasDATACENTERSarai Orellana CifuentesAún no hay calificaciones
- CUADRO SINOPTICO No. 10 LA ACCESIÓN COMO MODO ORIGINARIO DE ADQUIRIR LA PROPIEDAD DERECHO CIVIL II (29AGOS2022)Documento1 páginaCUADRO SINOPTICO No. 10 LA ACCESIÓN COMO MODO ORIGINARIO DE ADQUIRIR LA PROPIEDAD DERECHO CIVIL II (29AGOS2022)Erick Oajaca100% (1)
- Efluentes MataderoDocumento23 páginasEfluentes MataderoRamon Cruz Mamani50% (2)
- Presentación Nucala (Oct 2020)Documento52 páginasPresentación Nucala (Oct 2020)Ricardo MorenoAún no hay calificaciones
- Alquinga Villafuerte Josselyn AlexandraDocumento146 páginasAlquinga Villafuerte Josselyn AlexandraJennizzen OrellanaAún no hay calificaciones
- Informe de MineralogiaDocumento3 páginasInforme de MineralogiaYanina Cahuana AlcaAún no hay calificaciones
- El Niño Del LaurelDocumento35 páginasEl Niño Del LaurelAdan Miguel Goez RodriguezAún no hay calificaciones
- Evaluación Del Rango ArticularDocumento5 páginasEvaluación Del Rango ArticularMarta Lucia Delgado Enriquez0% (1)
- RX de Torax Interpretacion PDFDocumento8 páginasRX de Torax Interpretacion PDFKarim Alberto Vargas67% (3)
- NanonutricionDocumento1 páginaNanonutriciongingerAún no hay calificaciones