Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Primer Postulado
Cargado por
Carlos CastillaDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Primer Postulado
Cargado por
Carlos CastillaCopyright:
Formatos disponibles
PRIMER POSTULADO
ORBITAS CIRCULARES (decir que Rutherford no pudo explicar si eran circulares, el dijo que
estaban dispersas pero que estaban en orbita del átomo)
El primer postulado de Bohr propone que los electrones están encerrados en lo que llegó a
llamarse estados de energía permisibles TAMBIEN LLAMADOS NIVELES ENERGETICOS
En otras palabras, cada estado de energía permisible o nivel energético de un átomo corresponde
a un valor de energía diferente.
No se desgastan por lo tanto no colapsan
SEGUNDO POSTULADO
‘’N’’ Primer numero cuántico (explicar con imagen los niveles de energía con la imagen, explicando
lo de la letra N)
Señalar que Bohr uso ya el primer numero cuántico. Los siguientes serian L, M, S
Tercer postulado
(señalar que los espectros de emisión no podía señalar Rutherford)
También estableció que el nivel de energía más bajo que ocupa un electrón
se denomina “estado fundamental”. El “estado excitado” es un estado más
inestable, resultado del paso de un electrón a un orbital de mayor energía.
LA ENERGIA DE ORBITAS VA EN AUMENTO
ORBITA INTERNA O MAS CERCANA AL NUCLEO TIENE MENOR ENERGIA
ORBITA EXTERNA O MAS LEJANA AL NUCLEO TIENE MENOR ENERGIA
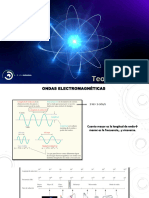
Cuando un electrón pasa de una orbita externa a una interna, la diferencia de
energía se emite en forma de radiación electro magnética.
Cuando un electron pasa de una orbita externa (mayor energía) a una orbita
interna (menor energia) EMITE ENERGIA (FOTON)
Cuando un electron pasa de una orbita interna a una externa absorbe energía
También podría gustarte
- Modelo AtomicoDocumento3 páginasModelo AtomicoGustavo Alonso Luévanos ArizmendiAún no hay calificaciones
- Documento 70Documento2 páginasDocumento 70María Quispe huallpaAún no hay calificaciones
- Modelo Atomico de BohrDocumento2 páginasModelo Atomico de Bohrkarina matus santiagoAún no hay calificaciones
- Modelos Atomicos de BohrDocumento9 páginasModelos Atomicos de BohrRichard SeggebruchAún no hay calificaciones
- Teoría Atómica de Bohr y Teoría Atómica de SommerfeldDocumento6 páginasTeoría Atómica de Bohr y Teoría Atómica de SommerfeldIEduardo Gomez SilvaAún no hay calificaciones
- Quimica 1Documento5 páginasQuimica 1Andres CodenaAún no hay calificaciones
- 1.2.-Teoria Atomica de Bohr.Documento8 páginas1.2.-Teoria Atomica de Bohr.Claudia de la RosaAún no hay calificaciones
- Modelo Atómico de BohrDocumento1 páginaModelo Atómico de BohrRoberto GarciaAún no hay calificaciones
- 7°-Actividad Quimica Grado 7°Documento2 páginas7°-Actividad Quimica Grado 7°Carlos RuizAún no hay calificaciones
- CartografíaDocumento15 páginasCartografíakarinaAún no hay calificaciones
- QuimicaestefanyDocumento2 páginasQuimicaestefanyÅrnąldö SêrnåAún no hay calificaciones
- Los Modelos AtomicosDocumento8 páginasLos Modelos Atomicosarturo gomezAún no hay calificaciones
- Cuál Es La Teoría Del Modelo Atómico de BohrDocumento2 páginasCuál Es La Teoría Del Modelo Atómico de BohrIvana BaigorriaAún no hay calificaciones
- Modelo Atómico de BohrDocumento4 páginasModelo Atómico de BohrEl VAún no hay calificaciones
- Niels Bohr Sabía Que Las Principales Objeciones Al Modelo Atómico de Rutherford Eran QueDocumento2 páginasNiels Bohr Sabía Que Las Principales Objeciones Al Modelo Atómico de Rutherford Eran QueEdgar Campusano SanchezAún no hay calificaciones
- Teoria de BhorDocumento2 páginasTeoria de BhorBrenda Cecilia PonceAún no hay calificaciones
- Química Modelo BohrDocumento1 páginaQuímica Modelo BohrMarcos Gutierrez FernandezAún no hay calificaciones
- 3-Teoría Cuántica-VfinalDocumento48 páginas3-Teoría Cuántica-VfinaljuanixgenoAún no hay calificaciones
- Modelo Atómico de Niels Bohr PreguntasDocumento3 páginasModelo Atómico de Niels Bohr PreguntasGabriel Jaramillo CisnerosAún no hay calificaciones
- Relación Carga Masa Del ElectrónDocumento5 páginasRelación Carga Masa Del ElectrónNeider BlancoAún no hay calificaciones
- Modelo Atomico de BohrDocumento3 páginasModelo Atomico de BohrAsh SttylesAún no hay calificaciones
- Modelo Atómico 2aDocumento2 páginasModelo Atómico 2aMauricioAún no hay calificaciones
- Trabajo en Equipo QuimicaDocumento6 páginasTrabajo en Equipo QuimicaYAREMI ADALID LOPEZ LLANOSAún no hay calificaciones
- Qué Es El Modelo Atómico de Bohr (TP 7)Documento1 páginaQué Es El Modelo Atómico de Bohr (TP 7)THE JOKERYTAún no hay calificaciones
- Orbitas Estacionarias Según Modelo Atómico de BohrDocumento2 páginasOrbitas Estacionarias Según Modelo Atómico de BohrJoaquin Antonio Garcia Suarez100% (3)
- Quimica 6Documento3 páginasQuimica 6neilyortegamartinezAún no hay calificaciones
- Apuntes Unidad 1 y 2Documento116 páginasApuntes Unidad 1 y 2Garcia Saldaña Brayan AdolfoAún no hay calificaciones
- Teoría CuánticaDocumento16 páginasTeoría CuánticaANDRES EDUARDO PINTO OLALLAAún no hay calificaciones
- Modelo Atómico de BohrDocumento6 páginasModelo Atómico de BohrAlx GruelAún no hay calificaciones
- Bohr y La Mecánica CuánticaDocumento5 páginasBohr y La Mecánica CuánticaNabil RamírezAún no hay calificaciones
- El Átomo y El ElectrónDocumento6 páginasEl Átomo y El ElectrónBernardo Jesús Preciado MendozaAún no hay calificaciones
- Modelo Nuclear Del ÁtomoDocumento4 páginasModelo Nuclear Del ÁtomoKevin MartínezAún no hay calificaciones
- Mecánica Cuántica. Equipo.1.3Documento1 páginaMecánica Cuántica. Equipo.1.3Hugo Alejandro Garcia UriosteguiAún no hay calificaciones
- Espectros y Modelos AtomicosDocumento42 páginasEspectros y Modelos AtomicoscristianAún no hay calificaciones
- Atomo CuanticoDocumento9 páginasAtomo CuanticoVilchis Granados Axel MaximilianoAún no hay calificaciones
- Modelo Atómico de BohrDocumento10 páginasModelo Atómico de BohrEmmanuel Tandaypán Farfán0% (1)
- Modelo Atómico de BohrDocumento2 páginasModelo Atómico de BohrCris Carry-onAún no hay calificaciones
- Espectroscopía y Modelos AtómicosDocumento47 páginasEspectroscopía y Modelos AtómicosSebastian AgudeloAún no hay calificaciones
- Estructura AtómicaDocumento10 páginasEstructura AtómicaLinda AguilarAún no hay calificaciones
- Modelo Atomico de BohrDocumento14 páginasModelo Atomico de BohrJackson RamirezAún no hay calificaciones
- Resumen EstructuraDocumento2 páginasResumen EstructurateresacamposcalvoAún no hay calificaciones
- El Modelo Atomico de BohrDocumento3 páginasEl Modelo Atomico de BohrFrida LlerenaAún no hay calificaciones
- Modelo Atómico de BohrDocumento5 páginasModelo Atómico de BohrRoberto LagunaAún no hay calificaciones
- Quimica - Unidad 1 - InformacionDocumento23 páginasQuimica - Unidad 1 - InformacionLOPEZ SALAS ABDIELAún no hay calificaciones
- Concepciones Del Átomo y AutoresDocumento5 páginasConcepciones Del Átomo y Autorespepe suarezAún no hay calificaciones
- Modelo Atómico de BohrDocumento22 páginasModelo Atómico de BohrValentina CarpioAún no hay calificaciones
- Modelo de Bohr y Espectro AtómicoDocumento10 páginasModelo de Bohr y Espectro AtómicoYazmin AlmanzaAún no hay calificaciones
- BOHR Y SommerfeldDocumento1 páginaBOHR Y SommerfeldRoberth MaykollAún no hay calificaciones
- Modelo Atomico de BohrDocumento15 páginasModelo Atomico de BohrAlexander MoranAún no hay calificaciones
- Modelo Atómico de BohrDocumento3 páginasModelo Atómico de BohrAnonymous Uo2QH3tqxTAún no hay calificaciones
- Resumen y Actividades Mode. AtomicosDocumento3 páginasResumen y Actividades Mode. AtomicosAdriana RobalinoAún no hay calificaciones
- Rutherford VS BohrDocumento3 páginasRutherford VS BohrJesús Cabrera CorralAún no hay calificaciones
- Ochoas 5 (1) .09Documento17 páginasOchoas 5 (1) .09zumbaclauAún no hay calificaciones
- Explicación e Importancia Del Modelo Atómico de BohrDocumento1 páginaExplicación e Importancia Del Modelo Atómico de BohrDionelsys RodriguezAún no hay calificaciones
- Actividad 1 - Rodrigo Niño Sepulveda - Estado SolidoDocumento9 páginasActividad 1 - Rodrigo Niño Sepulveda - Estado SolidoRodrigo XAún no hay calificaciones
- AtomoDocumento1 páginaAtomoelizabeth alcocerAún no hay calificaciones
- Modelos AtomicosDocumento4 páginasModelos AtomicosLissette Espinoza MoralesAún no hay calificaciones
- Modelo Cuántico y Configuración ElectrónicaDocumento3 páginasModelo Cuántico y Configuración ElectrónicaKevin MirandaAún no hay calificaciones
- Teoría Final de la Luz: Y Búsqueda de ExtraterrestresDe EverandTeoría Final de la Luz: Y Búsqueda de ExtraterrestresAún no hay calificaciones
- Arquitectura de SoftwareDocumento34 páginasArquitectura de SoftwareCarlos CastillaAún no hay calificaciones
- Arquitectura de SoftwareDocumento34 páginasArquitectura de SoftwareCarlos CastillaAún no hay calificaciones
- Expo - Recorrido de Un Grafo en Anchura1Documento10 páginasExpo - Recorrido de Un Grafo en Anchura1Carlos CastillaAún no hay calificaciones
- Arquitectura de SoftwareDocumento34 páginasArquitectura de SoftwareCarlos CastillaAún no hay calificaciones
- Recorrido de Un GrafoDocumento9 páginasRecorrido de Un GrafoCarlos CastillaAún no hay calificaciones
- Arquitectura de SoftwareDocumento34 páginasArquitectura de SoftwareCarlos CastillaAún no hay calificaciones
- Recorrido de Un GrafoDocumento9 páginasRecorrido de Un GrafoCarlos CastillaAún no hay calificaciones
- Resumen AmbientalDocumento10 páginasResumen AmbientalCarlos CastillaAún no hay calificaciones
- Valores y VirtudesDocumento5 páginasValores y VirtudesCarlos CastillaAún no hay calificaciones
- Procedimientos y Funciones ProgramacionDocumento5 páginasProcedimientos y Funciones ProgramacionCarlos CastillaAún no hay calificaciones
- Resumen AlgoritmoDocumento2 páginasResumen AlgoritmoCarlos CastillaAún no hay calificaciones
- Resumen AlgoritmoDocumento2 páginasResumen AlgoritmoCarlos CastillaAún no hay calificaciones
- Sistemas Operativos Atravez Del TiempoDocumento11 páginasSistemas Operativos Atravez Del TiempoCarlos CastillaAún no hay calificaciones
- Definición de Sistema ComplejoDocumento1 páginaDefinición de Sistema ComplejoCarlos CastillaAún no hay calificaciones
- Definición de Sistema ComplejoDocumento1 páginaDefinición de Sistema ComplejoCarlos CastillaAún no hay calificaciones
- Primer PostuladoDocumento1 páginaPrimer PostuladoCarlos CastillaAún no hay calificaciones
- Ensayo AmbientalDocumento1 páginaEnsayo AmbientalCarlos CastillaAún no hay calificaciones
- Herramientas de Gestion AmbientalDocumento5 páginasHerramientas de Gestion AmbientalCarlos CastillaAún no hay calificaciones
- Adic Video Juegos Carlos CastillaDocumento2 páginasAdic Video Juegos Carlos CastillaCarlos CastillaAún no hay calificaciones
- Definición de Sistema ComplejoDocumento1 páginaDefinición de Sistema ComplejoCarlos CastillaAún no hay calificaciones
- La Química Es La Ciencia Que Estudia La Composición de Los ElementosDocumento32 páginasLa Química Es La Ciencia Que Estudia La Composición de Los ElementosCarlos CastillaAún no hay calificaciones
- La Química Es La Ciencia Que Estudia La Composición de Los ElementosDocumento32 páginasLa Química Es La Ciencia Que Estudia La Composición de Los ElementosCarlos CastillaAún no hay calificaciones
- Contribuciones Cientificas IngDocumento12 páginasContribuciones Cientificas IngCarlos CastillaAún no hay calificaciones
- Definición de Sistema ComplejoDocumento1 páginaDefinición de Sistema ComplejoCarlos CastillaAún no hay calificaciones
- Cultura MayaDocumento3 páginasCultura MayaCarlos CastillaAún no hay calificaciones
- Ensayo de Mexico TerminadoDocumento5 páginasEnsayo de Mexico TerminadoCarlos CastillaAún no hay calificaciones
- Etapas de La Independencia de MéxicoDocumento2 páginasEtapas de La Independencia de MéxicoLive Lifeyou LivelifeyouAún no hay calificaciones
- Adic Video Juegos Carlos CastillaDocumento2 páginasAdic Video Juegos Carlos CastillaCarlos CastillaAún no hay calificaciones