Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Teoría Orbitales Moleculares
Cargado por
Martha Liliana Ruiz NievesDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Teoría Orbitales Moleculares
Cargado por
Martha Liliana Ruiz NievesCopyright:
Formatos disponibles
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Teora de Orbitales Moleculares
Profesor Ctedra: Sr. Ricardo Letelier
Profesor Auxiliar: Magn Torres
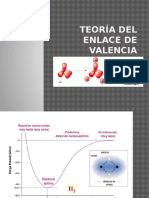
Los orbitales moleculares se forman por una combinacin lineal de orbitales atmicos.
Como los orbitales atmicos estaban definidos por una funcin de onda, las combinaciones
entre ellos se tomarn como interferencias constructivas o destructivas. sto define tipos
de orbitales moleculares enlazantes y antienlazantes.
O.M. Enlazante
Energa menor que el orbital de partida
Interferencia constructiva
Genera Enlace Qumico
O.M. Antienlazante
Energa mayor que el orbital de partida
Interferencia destructiva
Orbital Antienlazante (densidad electrnica baja
entre ncleos)
La combinacin de ciertos orbitales atmicos dar origen a diferentes tipos de orbitales
moleculares.
Orbitales tipo s
Se generan a partir de una combinacin lineal de dos orbitales atmicos tipo s.
* antienlazante
1s
enlazante
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Orbitales tipo p,p
Se generan a partir de una combinacin lineal de dos orbitales atmicos tipo npx, y npy.
antienlazante
antienlazante
2p
enlazante
enlazante
*Nota importante: Despus del Nitrgeno (Z=7) el orden entre orbitales enlazantes se
invierte (primero viene el sigma y despus el pi).
_________________________________________________________________________
Tipos de Molculas Diatmicas:
Homonucleares: Poseen los mismos ncleos (H2, Li2, O2, N2)
Heteronucleares: Poseen ncleos distintos (HLi,CN,NO,CO,BN,LiH,HHe)
Paramagnticas: Poseen electrones desapareados, se ven afectadas por campos
magnticos.
m = n(n + 2)
Diamagnticas: Poseen todos sus electrones apareados y no se ven afectadas por campos
magnticos (m=0).
Polares: Su vector momento dipolar es distinto de cero, son afectadas por campos
elctricos (Molculas heteronucleares).
Apolares: Su vector momento dipolar es igual a cero, no se ven afectadas por campos
elctricos (Molculas homonucleares).
_________________________________________________________________________
Vector momento dipolar: Vector cuya magnitud est determinada por la diferencia de
electronegatividades entre tomos, cuya direccin est definida por el ngulo definido por
la geometra de la molcula y cuyo sentido est definido desde el tomo menos
electronegativo hacia el tomo ms electronegativo.
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Orden de enlace: El orden de enlace determina el nmero de enlaces que tiene la
molcula. En caso de ser cero, sta no existe. Se calcula con la siguiente frmula:
_
_
1
OE = (n e enlazantes n e antienlazantes )
2
Molculas Diatmicas Homonucleares
H2
He2
1s
1s
OE=1
diamagntica
=0
OE=0 (no existe)
diamagntica
=0
* Noten que las reglas para llenar los orbitales moleculares son las mismas de las de
orbitales atmicos: Principio de mnima energa, principio de exclusin de Pauli, Regla de
Hund.
Li2
2s
Be2
2s
OE: 1
diamagntica
=0
OE: 0 (no existe)
diamagntica
=0
QI21A Qumica Moderna
Teora de Orbitales Moleculares
B2
N2
2p
2p
OE: 1
paramagntica
=0
OE: 3
diamagntica
=0
F2
NO
2p
OE: 0.5
paramagntica
=0
Ambos Flor Otorgan 9 electrones
OE: 1.5
paramagntica
<>
<>0
En total se aportan (7+8) electrones, 7
del Nitrgeno y 8 del Oxgeno.
QI21A Qumica Moderna
Teora de Orbitales Moleculares
En general, la regla para llenar las molculas es la siguiente...
2p*
*
2p
2p
2
2s
2
1
1s
1
Ms ejemplos...
HF (cido Fluorhdrico): El Flor otorga 9 electrones y el Hidrgeno 1. Debemos llenar
los OM con 10 electrones.
2p
2s
1s
OE: 0.5 (6-4)=1, Diamagntica y Momento dipolar distinto de cero.
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Para molculas con carga positiva, recuerden que se resta un electrn...
Para molculas con carga negativa, se agrega un electrn...
O2 +
O2 -
2p
OE: 2.5
OE: 1.5
paramagntica
paramagntica
_________________________________________________________________________
(P3 Examen 2004/1) El Potencial de Ionizacin del Oxgeno atmico es mayor que el
PI del Oxgeno diatmico. A su vez el PI del Nitrgeno atmico es menor que el PI del
Nitrgeno diatmico. Explique.
Solucin: Hacemos el diagrama energtico...
E=0
PIN
2p
PIN2
Nitrgeno
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Recordemos que los orbitales enlazantes poseen MENOR energa que los orbitales de
partida. Ahora para el Oxgeno...
E=0
PIO
PIO2
2p
Oxgeno
Ac recordemos que los orbitales antienlazantes poseen MAYOR energa que los orbitales
de partida.
Otros conceptos:
El orden de enlace aparte de determinar el tipo de enlace que posee la molcula y saber
si sta existe o no. Tambin nos entrega la longitud del tipo de enlace. A medida que el
orden de enlace aumenta, la longitud de enlace disminuye. O sea un enlace triple es ms
corto que un enlace simple.
La propiedad de paramagnetismo se puede aplicar a tomos... Por ejemplo, la
configuracin electrnica del Nitrgeno: 1s 2 2s 2 2p1x 2p1y 2p1z posee electrones
desapareados, por lo tanto el Nitrgeno atmico es paramagntico.
Suponga que el oxgeno diatmico puede ganar o perder 2 o ms electrones. Con sto,
ordene las molculas de mayor a menor longitud de enlace.
2
2 * 2
2 * 2
2
2
2 *
2 *
2
O
2 = (1s ) (1s ) ( 2s ) ( 2s ) ( 2p ) ( 2px ) ( 2py ) ( 2px ) ( 2py ) OE = 1
2 * 2
2 * 2
2
2
2 *
2 * 1
O
2 = (1s ) (1s ) ( 2s ) ( 2s ) ( 2p ) ( 2px ) ( 2py ) ( 2px ) ( 2py ) OE = 1.5
O 2 = (1s ) 2 (1*s ) 2 ( 2s ) 2 (*2s ) 2 ( 2p ) 2 ( 2px ) 2 ( 2py ) 2 (*2px )1(*2py )1OE = 2
2 * 2
2 * 2
2
2
2 *
1
O+
2 = (1s ) (1s ) ( 2s ) ( 2s ) ( 2p ) ( 2px ) ( 2py ) ( 2px ) OE = 2.5
2
2 * 2
2 * 2
2
2
2
O+
2 = (1s ) (1s ) ( 2s ) ( 2s ) ( 2p ) ( 2px ) ( 2py ) OE = 3
+
2
2
O+
2 < O2 < O2 < O2 < O2
_________________________________________________________________________
QI21A Qumica Moderna
Teora de Orbitales Moleculares
Cientficos han descubierto un meteorito compuesto por elementos X,Y,M. Los datos
que poseen los cientficos son los siguientes...
M se ve afectado por campos magnticos y su nmero de protones vara entre 18 y
20.
El nmero de protones de X e Y varan entre 6 y 8.
X2 es diamagntica y X2- es menos estable que su forma neutra.
XY es isoelectrnica con X2+.
Para M
Ar(Z=18) es diamagntico
K(Z=19) es paramagntico (sirve)
Ca(Z=20) es diamagntico.
M=K (Potasio).
X e Y pueden ser C, N u O.
C2 es diamagntica
N2 es diamagntica
O2 es paramagntica (no sirve)
C2- no puebla orbitales antienlazantes (estable)
N2- puebla orbitales antienlazantes (inestable)
2 * 2
2 * 2
2
2
2 *
1
N
2 = (1s ) (1s ) ( 2s ) ( 2s ) ( 2p ) ( 2px ) ( 2py ) ( 2px )
X=N (Nitrgeno)
N2+ posee 13 electrones en su configuracin...
NO posee 15 electrones
CN posee 13 electrones
Y=C (Carbono)
También podría gustarte
- Grupos FuncionalesDocumento40 páginasGrupos FuncionalesHeidi CG100% (1)
- Tabla Periodica Ejercicios ResueltosDocumento8 páginasTabla Periodica Ejercicios ResueltosOrlando AdvinculaAún no hay calificaciones
- Secuencia Didactica Guiada Quimica 1Documento138 páginasSecuencia Didactica Guiada Quimica 1malpica79Aún no hay calificaciones
- Química Orgánica ApuntesDocumento13 páginasQuímica Orgánica ApuntesDivulgación de archivosAún no hay calificaciones
- Clase Geometria MolecularDocumento65 páginasClase Geometria MoleculartortillasdemaizAún no hay calificaciones
- Aditivos Tipo GDocumento3 páginasAditivos Tipo GJohan EdquenAún no hay calificaciones
- Reacciones REDOXDocumento73 páginasReacciones REDOXingrriAún no hay calificaciones
- Clase 2 Números Cuánticos y Configuración Electrónica 2017Documento33 páginasClase 2 Números Cuánticos y Configuración Electrónica 2017magalopezAún no hay calificaciones
- Solution of Mathisson-Papapetrou-Dixon equations: for spinning test particles in a Kerr metricDe EverandSolution of Mathisson-Papapetrou-Dixon equations: for spinning test particles in a Kerr metricAún no hay calificaciones
- Traducción ASCE 41-17Documento22 páginasTraducción ASCE 41-17miltonAún no hay calificaciones
- Tema 4 - Reacciones Químicas. EstequiometríaDocumento7 páginasTema 4 - Reacciones Químicas. EstequiometríaCecilia ReynosaAún no hay calificaciones
- Practica Fisica Bachillerato A Tu Medida 01 2017Documento52 páginasPractica Fisica Bachillerato A Tu Medida 01 2017Adrián JLAún no hay calificaciones
- Proyecto SteamDocumento13 páginasProyecto Steamjavier0% (1)
- Libro de QuímicaDocumento62 páginasLibro de QuímicaGiovanoniNoniAún no hay calificaciones
- Prueba Sumativa COEFICIENTE 2 Química !° Med A y B NÚMEROS CUÁNTICOS YCONFIGURACIÓN ELECTRÓNICADocumento6 páginasPrueba Sumativa COEFICIENTE 2 Química !° Med A y B NÚMEROS CUÁNTICOS YCONFIGURACIÓN ELECTRÓNICAAna María Millán InzunzaAún no hay calificaciones
- Ejercicios Protones y Neutrones 2º EsoDocumento1 páginaEjercicios Protones y Neutrones 2º EsoMeryGrassMancheñoDíazAún no hay calificaciones
- Enlaces CovalentesDocumento101 páginasEnlaces CovalentesRobert Velázquez LucianoAún no hay calificaciones
- Guía de Estudios de La Materia de Ciencias 3 Con Énfasis en QuímicaDocumento5 páginasGuía de Estudios de La Materia de Ciencias 3 Con Énfasis en QuímicaLaura Edith Ruiz MartínezAún no hay calificaciones
- Manual Instrumentos OpticosDocumento26 páginasManual Instrumentos OpticosAlejandro0% (1)
- Linea de ConduccionDocumento33 páginasLinea de ConduccionAlex MacedoAún no hay calificaciones
- Práctica DE Laboratorio: Construcción de Un Mesocosmos CerradoDocumento11 páginasPráctica DE Laboratorio: Construcción de Un Mesocosmos CerradoAngel Goyes100% (1)
- U1. Materia y Sistemas MaterialesDocumento11 páginasU1. Materia y Sistemas MaterialesAgustin Ganin100% (1)
- Clase 2-Cadenas TroficasDocumento31 páginasClase 2-Cadenas TroficasAnonymous 2HShWKOIAún no hay calificaciones
- Temas Selectos de Química I Parcial 1Documento32 páginasTemas Selectos de Química I Parcial 1José Luis Cam100% (2)
- Módulo de QuímicaDocumento24 páginasMódulo de QuímicaCarmelino Almestar VillegasAún no hay calificaciones
- Prefijos - Multiplos de 10Documento1 páginaPrefijos - Multiplos de 10Mr29RicardoAún no hay calificaciones
- 3 OrbitalesMolecularesDocumento30 páginas3 OrbitalesMolecularesMartin GonzalezAún no hay calificaciones
- MolesDocumento2 páginasMolesAngelo Alexander LimaAún no hay calificaciones
- Teoria Atomica Moderna OrbitalesDocumento32 páginasTeoria Atomica Moderna OrbitalesLeibniz FourierAún no hay calificaciones
- Calculos EstequiometricosDocumento11 páginasCalculos EstequiometricosNoemi BarrosAún no hay calificaciones
- PRÁCTICA (Neutralización de Soluciones)Documento10 páginasPRÁCTICA (Neutralización de Soluciones)alfredoabad19Aún no hay calificaciones
- Informe 7 Orbitales AtomicosDocumento14 páginasInforme 7 Orbitales Atomicosanon_178136847Aún no hay calificaciones
- QUIMICA 5to AñoDocumento6 páginasQUIMICA 5to Añoyamileth100% (1)
- Orbitales SDocumento3 páginasOrbitales SDianita LozaAún no hay calificaciones
- DETECTOR Geiger MullerDocumento10 páginasDETECTOR Geiger MullerEDERrbAún no hay calificaciones
- Perturbaciones OrbitalesDocumento6 páginasPerturbaciones OrbitalesXime Coral0% (1)
- Presentacion Estructura AtomicaDocumento20 páginasPresentacion Estructura AtomicaTio InataAún no hay calificaciones
- Variaciones OrbitalesDocumento2 páginasVariaciones OrbitalesCarlos CEAún no hay calificaciones
- Guía Ácido Base Conceptos y Teorías PDFDocumento12 páginasGuía Ácido Base Conceptos y Teorías PDFRicardo Antonio Muñoz PartuzaAún no hay calificaciones
- Cuaderno de Ejercicios de Quimica Felix PDFDocumento52 páginasCuaderno de Ejercicios de Quimica Felix PDFbeba2722100% (1)
- QuimicaIII 22ADocumento79 páginasQuimicaIII 22Azxcvuno4307Aún no hay calificaciones
- Informe 4 ORBITALES MOLECULARESDocumento2 páginasInforme 4 ORBITALES MOLECULARESjennyfer castrillonAún no hay calificaciones
- Examen Diagnostico FísicaDocumento7 páginasExamen Diagnostico FísicaRoberto Arturo González ContrerasAún no hay calificaciones
- Hibridación de Orbitales AtómicosDocumento30 páginasHibridación de Orbitales AtómicosMonica BortAún no hay calificaciones
- Numeros CuanticosDocumento4 páginasNumeros CuanticosAlex GeassAún no hay calificaciones
- Manual PDN 2010 02 Quimica PDFDocumento254 páginasManual PDN 2010 02 Quimica PDFJorge Condori VilcaAún no hay calificaciones
- Configuración Electrónica de Un ÁtomoDocumento13 páginasConfiguración Electrónica de Un ÁtomoernestolavAún no hay calificaciones
- Los HidrocarburosDocumento43 páginasLos HidrocarburosPatricia Diaz AranguizAún no hay calificaciones
- Formulacion Quimica InorganicaDocumento7 páginasFormulacion Quimica InorganicayetignrAún no hay calificaciones
- Q2 PAU EstructuraAtómicaClasificacionPeriódicaElementos PDFDocumento7 páginasQ2 PAU EstructuraAtómicaClasificacionPeriódicaElementos PDFMerche García SáezAún no hay calificaciones
- Examen Grupos FuncionalesDocumento2 páginasExamen Grupos FuncionalesDaniela SPAún no hay calificaciones
- Examen de Química 2Documento4 páginasExamen de Química 2LThalía Gachúz HdezAún no hay calificaciones
- Reactivo Limitante y e ExcesoDocumento4 páginasReactivo Limitante y e ExcesoMartin CrispinoAún no hay calificaciones
- Inorganica IupacDocumento134 páginasInorganica Iupackonus2080Aún no hay calificaciones
- Unidad 7 REDOX y Metodo AlgebraicoDocumento4 páginasUnidad 7 REDOX y Metodo AlgebraicoMariale Arauz RizoAún no hay calificaciones
- TP 1Documento4 páginasTP 1Catalina BuscagliaAún no hay calificaciones
- Orbitales Moleculares CiclobutadienoDocumento7 páginasOrbitales Moleculares CiclobutadienoMaria MartinezAún no hay calificaciones
- Examen de QuimicaDocumento3 páginasExamen de QuimicaJerry HernandezAún no hay calificaciones
- 4-Enlace y Nomenclatura ImprimirDocumento45 páginas4-Enlace y Nomenclatura ImprimirFrancisco VanegasAún no hay calificaciones
- Tema 2 Orbitales MolecularesDocumento14 páginasTema 2 Orbitales MolecularesIsmael Angel NietoAún no hay calificaciones
- La nanotecnología: El mundo de las máquinas a escala nanométricaDe EverandLa nanotecnología: El mundo de las máquinas a escala nanométricaAún no hay calificaciones
- Clase0 RepasoDocumento112 páginasClase0 RepasoCarolina VazquezAún no hay calificaciones
- Estructura Atómica de Los MaterialesDocumento49 páginasEstructura Atómica de Los MaterialesJulián Valencia MogollonAún no hay calificaciones
- Estructura Molecular TOMDocumento33 páginasEstructura Molecular TOMNorbey Muñoz LibrePensadorAún no hay calificaciones
- Banco Hidraulico de BaseDocumento12 páginasBanco Hidraulico de BaseÊďwin Ķim Hýûn JöônğAún no hay calificaciones
- EnsayoDocumento2 páginasEnsayoMiguel Madrigal BAún no hay calificaciones
- Modificación en Las Propiedades Del AceroDocumento27 páginasModificación en Las Propiedades Del AceroAngee Jeon ♡Aún no hay calificaciones
- VALORACIONES - MEZCLAS Alcalinas de CarbonatosDocumento8 páginasVALORACIONES - MEZCLAS Alcalinas de CarbonatosRocio BedogniAún no hay calificaciones
- Trabajo Práctico #3 - ESTATICA - 1M2 - 1K7 - 1K8 - Fisica IDocumento4 páginasTrabajo Práctico #3 - ESTATICA - 1M2 - 1K7 - 1K8 - Fisica IWalter Díaz100% (1)
- Marco Teorico, Viscosimetro de OstwaldDocumento4 páginasMarco Teorico, Viscosimetro de OstwaldreicehlAún no hay calificaciones
- Clase Quimica Grado DecimoDocumento8 páginasClase Quimica Grado Decimohernan sierraAún no hay calificaciones
- Guia ProfesorDocumento4 páginasGuia ProfesorJuan David'sAún no hay calificaciones
- Labo Sistema de RefrigeracionDocumento14 páginasLabo Sistema de RefrigeracionAngie S. ChumpitaziAún no hay calificaciones
- Proyecto Aula TermodinamicaDocumento3 páginasProyecto Aula TermodinamicaAlexander Peñaloza PimientaAún no hay calificaciones
- 5 Ejercicios Adaptados A IngDocumento7 páginas5 Ejercicios Adaptados A IngJose Anderson Guevara MegoAún no hay calificaciones
- PermeabilidadDocumento3 páginasPermeabilidadjavyko_69100% (1)
- Examen Del Curso de Tecnologia Del ConcrDocumento10 páginasExamen Del Curso de Tecnologia Del ConcrDaggi ChavezAún no hay calificaciones
- Santos Flores Johnny JesusDocumento158 páginasSantos Flores Johnny JesusWilmer Neciosup Flores100% (1)
- Investigacion Hidroplaneo y Caracteristicas SemirremolquesDocumento10 páginasInvestigacion Hidroplaneo y Caracteristicas SemirremolquesIndira ColmenaAún no hay calificaciones
- Practica Especial de Soluciones 2024Documento16 páginasPractica Especial de Soluciones 2024Joel David NmmsAún no hay calificaciones
- Practica N 3Documento25 páginasPractica N 3Gianfranco Rivas OreAún no hay calificaciones
- Presion Columna de Gases-MarioJimenez - 1Documento9 páginasPresion Columna de Gases-MarioJimenez - 1andreacallizayaAún no hay calificaciones
- Intercambiador Tubo y CorazaDocumento26 páginasIntercambiador Tubo y CorazaOctavio Contreras67% (3)
- FECHADocumento2 páginasFECHAJose Gregorio OrtegaAún no hay calificaciones
- Radiacion y Brillo SolarDocumento20 páginasRadiacion y Brillo SolarHumberto MuñozAún no hay calificaciones
- Factor de Recobro Por El Medio APIDocumento4 páginasFactor de Recobro Por El Medio APIXavy SnchzAún no hay calificaciones
- Informe Topográfico y OrográficoDocumento7 páginasInforme Topográfico y OrográficoMitchell Liñan NizamaAún no hay calificaciones
- l4 Quenta RamiroDocumento6 páginasl4 Quenta RamiroRAMIRO ARIEL QUENTA RAMOSAún no hay calificaciones
- Luis HernamDocumento31 páginasLuis HernamCañola AndrésAún no hay calificaciones