Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Diagramas Ternarios Fases
Diagramas Ternarios Fases
Cargado por
Ruselkis FloresTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Diagramas Ternarios Fases
Diagramas Ternarios Fases
Cargado por
Ruselkis FloresCopyright:
Formatos disponibles
DISCUSIN GENERAL SOBRE
LOS DIAGRAMAS DE FASE
OSCAR JAIME RESTREPO BAENA
Doctor en Materiales
Universidad de Oviedo - Espaa
UNIVERSIDAD NACIONAL DE COLOMBIA
GRUPO DE CERMICOS Y VTREOS
MEDELLIN
1998
Oscar Jaime Restrepo Baena
DISCUSIN GENERAL SOBRE LOS DIAGRAMAS DE FASE
NATURALEZA E IMPORTANCIA DE LOS DIAGRAMAS DE FASE
1. INTRODUCCIN
Los materiales en estado slido existen en muchas formas diferentes o fases. El nmero
de tales fases puede ser grande incluso para sustancias puras, por ejemplo el hielo puede
existir en varias fases slidas y un metal tan importante como el hierro presenta hasta
cuatro fases slidas. En los sistemas que presentan ms de una especie qumica el
nmero de fases puede igualmente ser grande. Es tambin frecuente, an en sistemas
comerciales importantes, la disponibilidad de datos que cubren slo una parte de los
sistemas. En vista del hecho que las propiedades de los materiales dependen
significativamente de la naturaleza, nmero, cantidad, y forma de las posibles fases que se
presentan y pueden cambiarse por alteraciones en dichas cantidades, es vital, en el uso
de materiales, conocer las condiciones bajo las cuales cualquier sistema dado puede
existir en sus varias formas posibles.
A travs de los aos se ha acumulado gran cantidad de informacin de un gran nmero de
sistemas; para registrar tal enorme cantidad de datos se acostumbra graficar el nmero y
composicin (e indirectamente las cantidades) de fases presentes como funcin de la
temperatura, la presin y sobre todo la composicin. Estas grficas se llaman diagramas
de fase, diagramas de constitucin o diagramas de equilibrio. Este ltimo nombre se
deriva del hecho de que tales diagramas permiten mostrar la mayora de las fases
estables que se encuentran bajo condiciones de equilibrio.
El trmino condiciones de equilibrio requiere cierta elaboracin. Estrictamente hablando
el estado de equilibrio de un sistema es aquel estado en el cual las propiedades del
sistema no cambian con el tiempo, a menos que se ejerza una restriccin. En este ltimo
sentido, restriccin significa normalmente una alteracin de la temperatura, la presin o la
composicin, pero puede tambin referirse a la aplicacin de fuerzas mecnicas,
elctricas, magnticas, etc. En la prctica, sin embargo, la definicin de equilibrio se
modifica teniendo en cuenta las velocidades relativas de los posibles procesos que
puedan introducirse en un sistema por cambios en la temperatura, la composicin o la
presin. Frecuentemente un sistema es importante slo para ciertos valores de presin,
temperatura y composicin; en tales casos las reacciones al interior de los sistemas
pueden proceder a velocidades que son: a) tan lentas que producen cambios
despreciables en las propiedades para perodos de tiempo lo suficientemente
considerables. b) tan rpidas que llegan al equilibrio en menos tiempo que el que se
puede registrar de manera prctica y c) una magnitud intermedia. Los diagramas de fase
Discusin General sobre Diagramas de Fase
muestran los reactivos en los procesos tipo a) y los productos de reaccin en los procesos
tipo b) y c) como fases en equilibrio.
En el tratamiento de los diagramas de fase, tanto en la determinacin, como en el uso se
ha hecho un acercamiento fundamentalmente emprico, aunque en general ellos poseen
una fuerte base termodinmica. En principio, al menos los diagramas de equilibrio,
pueden calcularse por relaciones termodinmicas, en la prctica, sin embargo, slo se
recurre a sustituciones relativamente simples fundamentalmente por dos razones: la teora
exacta para casos generales es bastante compleja y muchos de los datos termodinmicos
necesarios no se encuentran disponibles. Otros acercamientos posibles son: a) estudios
desde un punto de vista puramente qumico, con lo cual se involucraran algunos sistemas
que no son de inters. b) una visin puramente matemtica, haciendo uso de un lenguaje y
simbolismos que no se manejan normalmente en ingeniera. c) estudio geomtrico y/o
aproximacin fenomenolgica a los diagramas de fase sin casi ninguna discusin
termodinmica. En estas notas se opta por una fundamentacin termodinmica con el fin
de sentar las bases de discusin para cualquier otro sistema que se desee afrontar.
2. DEFINICIONES
La base de todo el trabajo sobre los diagramas de equilibrio es, por supuesto, la regla de
fases de Willard Gibbs.
El diagrama, tambin conocido como diagrama de fase o diagrama de equilibrio es
esencialmente una expresin grfica de la regla de fases. La ecuacin siguiente presenta
la regla de fases en la forma matemtica usual:
F+L=C+2
Donde:
C: Nmero de componentes del sistema
F: Nmero de fases presentes en el equilibrio
L: Varianza del sistema (grados de libertad)
Los trminos usados en la expresin anterior as como otros necesarios para entender los
diagramas de fase se definen a continuacin.
2.1 SISTEMA: cualquier porcin del universo material que pueda aislarse completamente
y arbitrariamente del resto, por consideracin de los cambios que puedan ocurrir en su
interior y bajo condiciones variantes.
Los sistemas que existen dentro de otros sistemas se llaman subsistemas. En el sistema
Ca0 - Al203 los componentes, cal-almina, con sus puntos de mezcla congruentes forman
sistemas unos con otros, por ejemplo, los sistemas 5Ca0.3Al203 - CaO.Al2O3 y CaO-
Oscar Jaime Restrepo Baena
CaO.Al2O3. En el sistema ternario CaO-Al2O3-SiO2 las uniones binarias tales como
CaO.SiO2 - CaO-Al2O3-2SiO2 son verdaderos sistemas binarios y los tres componentes
se mezclan congruentemente, CaO-SiO2, CaO-Al2O3-SiO2 y 2CaO.Al2O3.SiO2 cuya lnea
de frontera comn se encuentra en un eutctico constituye un verdadero sistema ternario.
Los subsistemas en los cuales no se forman componentes se llaman sistemas mnimos.
2.2 FASE: cualquier porcin del sistema fsicamente homognea consigo misma y
separada por una superficie mecnicamente separable de otras porciones.
2.3 COMPONENTES: el menor nmero de variables individuales independientes (vapor,
lquido o slido) por medio de los cuales la composicin del sistema puede expresarse
cuantitativamente.
2.4 VARIANZA DEL SISTEMA (GRADOS DE LIBERTAD): es la aplicacin de la regla
de fase al tipo de sistemas bajo consideracin; la variable independiente condiciona
cuales factores se consideran; usualmente son la temperatura, la presin y la
concentracin. El nmero de estas variables, las cuales se fijan de manera arbitraria para
definir completamente el sistema, se llama varianza o grados de libertad del sistema.
2.5 EQUILIBRIO: Se dice que el equilibrio existe en cualquier sistema cuando las fases
del mismo no conducen a ningn cambio en las propiedades con el paso del tiempo y
permite que las fases tengan las mismas propiedades cuando se tienen las mismas
condiciones con respecto a las variantes que se han alcanzado por procedimientos
diferentes.
2.6 EQUILIBRIO HETEROGNEO: un sistema es heterogneo y est en equilibrio
heterogneo cuando consta de dos o ms porciones homogneas (fases) en equilibrio
entre ellas.
2.7 EQUILIBRIO HOMOGNEO: un sistema es homogneo y est en equilibrio
homogneo cuando consta de una fase y todos los procesos y/o reacciones que ocurren al
interior estn en equilibrio reversible.
2.8 PUNTO DE FUSIN CONGRUENTE: la temperatura a la cual un slido cambia a un
lquido a la presin especificada, en la cual la fase lquida tiene la misma composicin que
la fase slida.
2.9 PUNTO DE FUSIN INCONGRUENTE: la temperatura a la cual una fase slida
cambia a una segunda fase slida ms un lquido, ambos de diferente composicin que el
slido original.
2.10 SOLUCIN SLIDA: es una fase cristalina simple la cual puede variar en
composicin con lmites finitos sin tener la apariencia de una fase adicional.
Discusin General sobre Diagramas de Fase
2.11 POLIMORFISMO: la propiedad que poseen algunas sustancias de existir en ms de
una forma cristalina, todas las formas con igual composicin qumica, pero con diferente
estructura cristalina y propiedades fsicas e idntico comportamiento en las fases lquida o
gaseosa, en la fusin o evaporacin.
2.12 PUNTO DE INVERSIN: La temperatura a la cual una forma polimrfica de una
sustancia cambia a otra bajo condiciones invariantes.
2.13 METAESTABLE: se dice que una forma polimrfica es metaestable cuando existe
en equilibrio con vapor en el rango de temperaturas en el cual otra forma polimrfica de
menor presin de vapor est en equilibrio con el mismo vapor. Metaestabilidad no debe
confundirse con inestabilidad la cual infiere que una forma polimrfica puede existir a una
temperatura por encima o por debajo de su temperatura de transicin debido a la de la
inversin.
2.14 FORMAS ENANTIOTRPICAS: formas polimrficas que poseen un punto de
inversin en el cual estn en equilibrio, esto es, que son interconvertibles. Por ejemplo: y
2CaO.SiO2 y y cuarzo. En tales casos, las curvas de presin de vapor se
interceptan por debajo del punto de fusin de la forma polimrfica de ms alta
temperatura.
2.15 FORMAS MONOTRPICAS: en ciertas instancias de polimorfismo, las curvas de
presin de vapor de dos formas no se encuentran por debajo del punto de fusin, por lo
tanto carecen de punto de inversin estable y la forma que presenta una presin de vapor
ms alta es metaestable con respecto a la otra en todas las temperaturas por debajo del
punto de fusin. Tales formas se llaman monotrpicas y no son interconvertibles.
2.16 ESTUDIO ISOTRMICO: el mtodo de considerar los cambios que ocurren en un
sistema en el cual la variable temperatura se mantiene constante y la composicin (o la
presin) se vara.
2.17 ESTUDIO ISOPLTICO: el mtodo de considerar los cambios que ocurren en un
sistema en el cual la variable composicin se mantiene constante y la temperatura vara
(una isopleta es una lnea de composicin constante).
2.18 EUTCTICO: un eutctico es un punto invariante (temperatura) es el sistema en el
cual la fase reacciona, una remocin del calor provoca una desaparicin de la fase lquida
sin cambio de temperatura. La composicin eutctica es aquella combinacin de
componentes de un sistema mnimo que tiene el ms bajo punto de fusin que cualquier
otra relacin de componentes y est en la interseccin de dos curvas de solubilidad en un
sistema binario y de tres superficies de solubilidad en un sistema ternario.
2.19
LQUIDUS: el lmite de puntos invariantes temperatura-composicin que
representan la solubilidad mxima (saturacin) de un componente en la fase lquida. En un
sistema binario es una lnea y en un sistema ternario es una superficie, usualmente curva.
5
Oscar Jaime Restrepo Baena
En un estudio isopltico a la temperatura superior a la de lquidus, el sistema es
completamente lquido y en la interseccin de lquidus y la isopleta, el lquido est en
equilibrio con una fase cristalina.
2.20 SLIDUS: el lmite de puntos invariantes temperaturacomposicin en un sistema, a
temperatura por debajo de la cual slido y lquido estn en equilibrio y por debajo de la
cual el sistema es completamente slido. En un sistema binario sin soluciones slidas es
una lnea recta y con soluciones slidas es una lnea curvada o una combinacin de curvas
y lneas rectas. De otro lado en un sistema ternario el slido es un plano o una superficie
curvada respectivamente.
2.21 FASE PRIMARIA: en un estudio isopltico la primera fase cristalina que aparece en
el enfriamiento a una composicin desde el estado lquido (esto es la interseccin entre la
isopleta y la lnea lquidus).
2.22 LNEA DE FRONTERA: la interseccin de las superficies lquidus adyacentes en un
diagrama de fases ternario. El rea incluida por una serie de lneas de frontera
adyacentes se conoce como rea de fase primaria.
2.23 LNEAS DE AMARRE: una lnea dibujada desde un punto arbitrario en el lquidus al
punto en el slidus correspondiente a la composicin de la fase slida que existe en
equilibrio con el lquido a la temperatura del punto arbitrario. Para una temperatura
particular, es la lnea recta que conecta la composicin de dos fases en equilibrio una con
otra.
2.24 UNIONES: La regin de un diagrama de fases que representa todas las mezclas
que pueden formarse de un nmero dado de composiciones seleccionadas. Una unin
puede ser binaria (una lnea recta), ternaria (un plano), etc., dependiendo del nmero de
composiciones seleccionadas, las cuales no necesariamente son compuestas. Debe
notarse, sin embargo, que ninguna composicin seleccionada puede formarse a partir de
las otras.
2.25 LNEA ALKEMADA: una unin en un diagrama de fases ternario que conecta los
puntos de composicin de dos fases primarias cuyas reas de fase son adyacentes y la
interseccin de las cuales forman una curva de frontera.
2.26 TRINGULO DE COMPOSICIN: en sistemas ternarios los tres puntos que
conectan las uniones de composicin de tres fases primarias cuyas superficies lquidas se
encuentran en un punto.
3. FUNDAMENTOS TERMODINMICOS
La termodinmica es una disciplina cientfica que estudia las relaciones matemticas
cuantitativas entre las propiedades mensurables de los sistemas, dando cuenta de leyes y
6
Discusin General sobre Diagramas de Fase
principios que estn involucrados en las transformaciones energticas de la materia. Las
relaciones estn expresadas en trminos de cantidades, las cuales pueden designarse
como variables de estado y propiedades de estado.
En un sentido operativo las variables de estado son los potenciales que pueden
manipularse de manera razonable para fijar o alterar la condicin o estado del sistema;
esto es, aquellas propiedades a travs de las cuales pueden ejercerse restricciones al
sistema. Las variables de estado ms frecuentes son la temperatura, la presin y la
composicin; en situaciones especiales pueden ser importantes otras variables como los
potenciales mecnico, elctrico, magntico, gravitacional y superficial. En el tratamiento
de los diagramas de fase, slo la temperatura, la presin y la composicin se consideran
fundamentales, por lo tanto es de ellos que se trata aqu.
La fsico-qumica, donde la termodinmica tiene su origen, ha tenido en cuenta
tradicionalmente lquidos y gases. La experiencia ha mostrado que cuando se fija el
estado del sistema regulando la temperatura, la presin y la composicin, ste queda
completamente especificado, no importando la historia pasada del sistema. Las
propiedades de tales sustancias se conocen como propiedades de estado ya que estas
propiedades son las nicas funciones de estado que son tambin funciones de valor
singular y por lo tanto pueden manejarse cuantitativamente en las expresiones
matemticas de la termodinmica.
Cuando se trabaja con materiales, los cuales pueden ser slidos, es frecuente encontrar
que las propiedades dependen de la historia pasada tanto como de la temperatura, la
presin y la composicin. Esta situacin se debe a dos caractersticas de los slidos, su
capacidad para resistir esfuerzos cortantes y su inercia relativa a reaccionar, comparados
con los gases y lquidos. Esta caracterstica de los slidos es la responsable de muchas
de sus propiedades y por lo tanto el estudio de los diagramas de equilibrio debe tener en
cuenta tales aspectos ya que son limitaciones al aplicar las ecuaciones termodinmicas.
3.1 CRITERIO DE EQUILIBRIO
La termodinmica ha hecho posible expresar en unos pocos principios, o leyes, la
evidencia de innumerables observaciones y experimentos sobre la naturaleza del universo.
Estas layes expresadas matemticamente forman un conjunto de ecuaciones
extremadamente tiles que relacionan las cantidades de estado de los sistemas.
La primera ley de la termodinmica asegura que para un sistema en equilibrio interno, hay
una cantidad llamada energa interna E, que es una propiedad de estado del sistema. Ms
especficamente, esta ley establece que en cualquier sistema cerrado que pasa de un
estado inicial dado a un estado final, por cualquier medio o proceso, si se mide todo el
calor, Q, absorbido por el sistema y todo el trabajo, W, hecho por el sistema, la diferencia
entre Q y W ser constante para cualquier va utilizada. Esto teniendo en cuenta que las
magnitudes Q y W separadamente dependen de la naturaleza del medio. En otras
palabras, la diferencia Q-W depende slo de los estados inicial y final del sistema, esto
Oscar Jaime Restrepo Baena
significa el cambio en una propiedad de estado del sistema. Ya que tanto Q como W son
trminos de energa, esta propiedad de estado es tambin un trmino de energa, se le ha
dado el nombre de energa interna y su smbolo es E; entonces,
2 E = Q - W
(1)
La energa interna no est descrita en detalle por la termodinmica clsica. Debe tenerse
en cuenta que ni desde un punto de vista termodinmico, ni atomstico, puede
considerarse a E, ni ninguna otra forma de energa, como completamente definida. Esto
quiere decir que la magnitud del trmino energa no puede darse nunca en una base
absoluta, sino relativamente a algn sistema arbitrario de referencia; por ejemplo, E slo
est parcialmente definida por la ecuacin (1) o por su equivalente diferencial
dE = Q - W
(2)
El smbolo diferencial d se aplica slo a cambios en las propiedades de estado, es un
diferencial exacto. La ecuacin (2) define slo un cambio en E durante un proceso, en
trminos de dos cambios medibles Q, el calor absorbido por el sistema, y W el trabajo
hecho por el sistema durante el proceso. Integrando (2) resulta:
E2 - E1 = 12Q - 12W
Esto es, la energa E2 del sistema, en el estado 2, slo puede darse en trminos de la
energa E1, en el estado 1, cuando se pasa de un estado al otro. La misma limitacin
existe cuando se considera el problema atomsticamente.
La segunda ley de la termodinmica asegura que otra propiedad asociada con todos los
sistemas llamada entropa, S, es tambin una propiedad de estado y tiene como
caracterstica importante que:
a. En cualquier proceso que se lleva a cabo en un sistema en equilibrio con sus
alrededores (proceso reversible) la entropa del sistema ms la de los alrededores es
constante, esto es:
dsistrevS + d alrrevS = 0
(3)
b. En un proceso espontneo (irreversible):
dsistirrevS + d alrirrevS > 0
(4)
Esta cantidad, la entropa, est (parcialmente) definida termodinmicamente como:
dS = dQrev
8
Discusin General sobre Diagramas de Fase
(5)
Resumiendo (3), (4) y (5) se establece una expresin para la segunda ley
dS 0
(6)
para un sistema y sus alrededores, esto es, un sistema aislado (sistema adiabtico,
isomtrico y cerrado).
De nuevo, la termodinmica no describe la entropa en detalle y el entendimiento de la
ecuacin (5) en ocasiones es de una gran dificultad en quien estudia este tema. La
entropa como cantidad termodinmica es una expresin del grado de aleatoriedad de un
sistema y la segunda ley de la termodinmica es nicamente una expresin que da cuenta
de la tendencia hacia la espontaneidad, hacia la completa aleatoriedad o hacia la mxima
entropa.
Est claro que el equilibrio real (el ms probable) de cualquier grupo de tomos est
determinado primordialmente por dos factores; la resistencia de las energas potenciales
interatmicas y la resistencia de la tendencia a la aleatoriedad. Estos tomos, con las ms
altas atracciones mutuas tendern a juntarse produciendo las mayores energas de
interaccin negativa posible. De otro lado, la energa cintica de los tomos aumentar la
aleatoriedad en las posiciones atmicas (entropa positiva). El compromiso ptimo entre
estas dos tendencias opuestas llevar al estado de equilibrio. Una expresin
termodinmica equivalente puede derivarse combinando las ecuaciones (2) y (5), para un
proceso reversible; esto es, un sistema en equilibrio:
dE = TdS - W
(7)
Si se restringe el sistema a una composicin y masa fijas en el cual el nico trabajo hecho
por el sistema est asociado a un cambio de volumen (contra la presin) W se convierte
en P alr dV y ya que P alr = P sist en un proceso reversible, entonces:
dE = TdS - Palr dV = TdS - PdV
(8)
Tal y como se plantea la ecuacin (8), no se trata de la forma ms til, ya que el cambio de
E est expresado en trminos de dos variables independientes S y V; las cuales son
difciles de manipular experimentalmente. Esta dificultad puede eliminarse introduciendo
una nueva cantidad, G, llamada energa libre de Gibbs y definida como:
G E + PV -TS
(9)
diferenciando (9) y sustituyendo en (8) se obtiene:
dG = VdP - SdT
(10)
Oscar Jaime Restrepo Baena
Aqu la cantidad dependiente G, est expresada en trminos de dos variables
independientes P y T, las cuales pueden controlarse fcilmente en el laboratorio. Para
procesos llevados a cabo a presin y temperatura constantes, la ecuacin (10) dice que
bajo condiciones de equilibrio:
dG = 0
(11)
Adems puede mostrarse, de las ecuaciones (4) y (9) que para un proceso espontneo o
irreversible, a presin y temperatura constante:
dG < 0
(12)
Por lo tanto, las dos primeras leyes de la termodinmica revelan que en un proceso
espontneo, a presin y temperatura constante, la energa libre decrece y alcanza un
mnimo en el equilibrio.
3.2 EQUILIBRIO EN SISTEMAS DE COMPOSICIN VARIABLE.
Es importante tratar el problema de los sistemas multicomponentes, multifsicos, esto es,
heterogneos, los cuales pueden presentar variaciones de composicin interna por
trasferencia de materia entre las fases. Tal sistema puede estudiarse centrando la
atencin primero en una fase simple; por lo tanto puede considerarse cada fase como un
sistema y el resto de ellas como los alrededores. Para ser consistentes con la condicin
de que el sistema heterogneo original puede permitir el transporte de materia entre
fases, el nuevo sistema de una sola fase debe considerarse como un sistema abierto;
esto es, puede intercambiar materia con los alrededores. Cada intercambio de materia
lleva a una trasferencia de energa interna, la cual, para un cambio infinitesimal, puede
expresarse como:
dE = E dni = i dni
ni
(13)
donde i se llama el potencial qumico de i y es la tasa de cambio de la energa interna con
el cambio en la cantidad del i-simo componente, manteniendo constantes todas las otras
variables. Al escribir la primera ley para un sistema abierto de este tipo, el trmino de
energa de la ecuacin (13) debe adicionarse a los trminos de calor y trabajo. Como
resultado, el planteamiento combinado de la primera y segunda ley para un proceso
reversible en una fase simple para un sistema abierto, en el cual hay efectos del calor,
trabajo de la presin e intercambio de materia con los alrededores, se tiene:
dE = TdS - PdV + i dni
(14)
En esta expresin, el potencial qumico de cada componente se toma para valores
constantes de S, V y cantidades de los otros componentes. Combinando la expresin (14)
10
Discusin General sobre Diagramas de Fase
con el diferencial de la funcin de energa libre (9) se obtiene una expresin alterna para la
combinacin de la primera y segunda ley:
dG = VdP - SdT + i dni
(15)
El potencial qumico en esta expresin todava est escrito para valores constantes de S,
V y cantidades de los otros componentes. Debido a que dG es un diferencial exacto,
tambin puede escribirse:
dG = G dP + G dT + i dni (16)
P
T
ni
donde la derivada parcial de G con respecto a la variable dada en cada caso puede
escribirse manteniendo constante las otras variables del grupo T, P, nj .... nn comparando
(13), (15) y (16) se obtiene que:
(GT
= i = (E
ni ) T,P,n1,....ni-1,ni+1,...
ni )S,V, n1,....ni-1,ni+1,... (17)
En vista que de (17) los potenciales qumicos de (15) pueden referirse a la derivada
parcial de la energa interna, manteniendo constantes S, V, n1, n2,..... se podra simplificar
entonces:
dG = VdP - SdT + 1dn1 + 2dn2 + .....
(18)
sin hacer referencia a constantes.
Esta ecuacin puede presentarse para cada fase en un sistema multifsico.
En el tratamiento de un sistema multifsico en equilibrio no existe dificultad alguna en
aceptar el concepto de que todas las fases deben tener la misma temperatura y presin.
Aunque es menos evidente, pero igualmente vlido, cada componente est caracterizado
por un potencial qumico que es el mismo para todas las fases. Lo anterior tambin puede
demostrarse. Considrese dos fases y en un sistema en equilibrio. Si se transfiere
una cantidad dni de la fase a la fase manteniendo constantes T, P y las cantidades de
los otros componentes, se tiene de (18):
dG = 1 dn1
y dG = 1 dn1
El cambio total de energa libre de las dos fases es:
dG = dG + dG = (1 - 1 )dn1
11
Oscar Jaime Restrepo Baena
Ya que la composicin total y la masa de las dos masas juntas no cambia, las dos fases
pueden verse como un sistema de composicin y masa fijas, el cual est en equilibrio a
presin y temperatura constantes. Por lo tanto aplicando (11):
dG = (1 - 1 )dn1= 0
1 = 1
(19)
Un argumento similar puede emplearse para un sistema de dos fases y varios
componentes; de esto se desprende que existe slo un potencial qumico caracterstico
del sistema, visto como un todo, para cada componente, cuando el sistema est en
equilibrio.
Las expresiones (14) y (18) son formas de establecer de manera combinada la primera y
segunda ley de la termodinmica para un proceso reversible (en equilibrio) para un
sistema homogneo que puede intercambiar materia con sus alrededores. Otra forma
equivalente, que es til, puede derivarse de la siguiente forma:
La energa interna de una fase a valores fijos de temperatura, presin y composicin
puede encontrarse integrando la ecuacin (14):
dE = TdS - PdV + i dni
debido a que se han fijado los valores de T, P y los potenciales qumicos (que son funcin
slo de la composicin para T y P constantes) son tambin constantes, entonces:
E = TS - PV + i dni + C
(20)
la diferenciacin completa de (20) da:
dE = TdS + SdT -PdV - VdP + i dni + ni di
(21)
Restando (14) y (21) se obtiene:
0 = SdT - VdP + ni di
(22)
la cual es la expresin que se buscaba.
4. LA REGLA DE FASES
Cuando un sistema consista de una sola sustancia simple, se dice que consiste de slo
una fase. Si un sistema heterogneo est compuesto de varias partes, cada una de las
12
Discusin General sobre Diagramas de Fase
cuales es homognea en s misma, se dice que el sistema consta de tantas fases como
partes homogneas estn contenidas en el sistema.
Como ejemplo de un sistema compuesto de una sola fase se puede considerar un lquido
homogneo (no necesariamente una sustancia pura; puede considerarse una solucin), un
slido homogneo o un gas.
Los siguientes son ejemplos de sustancias que constan de dos fases: un sistema
compuesto de agua y vapor de agua; una solucin saturada de sal en agua con algo de sal
slida presente; un sistema compuesto de dos lquidos inmiscibles y as. En el primer
ejemplo las dos fases son una fase lquida compuesta de agua y una fase gaseosa
compuesta de vapor de agua. En el segundo ejemplo las dos fases son la solucin de
agua y sal y la sal slida. En el tercer ejemplo las dos fases son los dos lquidos.
Todas las propiedades especficas de una fase (esto es, todas las propiedades referidas
a la unidad de masa de la sustancia que constituye la fase, por ejemplo la densidad, el
calor especfico, etc.) dependen de la temperatura T, la presin P y la composicin
qumica de la fase.
Para definir la composicin qumica de una fase se puede dar el porcentaje de cada
sustancia qumicamente definida presente en la fase. Estrictamente hablando se puede
establecer que si el porcentaje de cada elemento qumico (contando la cantidad total del
elemento, tanto libre como qumicamente rodeado de otros elementos) se sabe el
porcentaje de los diferentes compuestos que pueden formarse con los elementos dados,
estara determinado por la temperatura dada y la presin de la fase. Adems, se sabe de
las leyes de la qumica, que para unas condiciones dadas de temperatura, presin y
concentracin relativa de los diferentes elementos presentes, siempre se alcanzar el
equilibrio qumico al interior de la fase. Por lo tanto se puede decir que una fase es una
mezcla homognea de todos los compuestos qumicos posibles que puedan formarse de
los elementos qumicos presentes en la fase y que el porcentaje de cada compuesto
presente est determinado completamente por T, P y las concentraciones relativas de
todos los elementos en la fase.
Considrese por ejemplo una fase gaseosa consistente de concentraciones definidas de
hidrgeno y oxgeno a unas condiciones dadas de temperatura y presin; las molculas
ms abundantes formadas del hidrgeno y oxgeno son H2, O2 y H2O (para efectos de
simplicidad se descartan las molculas raras de H, O, O3 y H2O2). El nmero de molculas
de agua que podran formarse en la mezcla gaseosa a temperatura y presin dadas est
determinada nicamente, y de ah la composicin de la mezcla gaseosa tambin, slo por
las concentraciones de hidrgeno y oxgeno. Estrictamente hablando se puede decir que
los componentes de una fase son los elementos qumicos contenidos en la fase (cada
elemento esta siendo contado como un componente independiente si est presente en su
forma elemental o en combinacin qumica con otros elementos). Sin embargo se sabe,
de consideraciones qumicas, que bajo ciertas condiciones, muchos equilibrios qumicos
se alcanzan slo despus de un perodo de tiempo que es largo comparado con intervalos
13
Oscar Jaime Restrepo Baena
de tiempo ordinario. Por lo tanto si se tiene una mezcla gaseosa de H2 y O2 a presin y
temperatura normal, el equilibrio qumico se alcanza cuando una gran cantidad de
hidrgeno y oxgeno se combinan para dar vapor de agua. Pero la reaccin:
2H2 + O2 2H2O
procede tan lentamente bajo condiciones normales, que prcticamente no se realiza la
combinacin entre el hidrgeno y el oxgeno en un perodo de tiempo razonablemente
corto. Por supuesto la reaccin se realizara ms rpidamente si la temperatura fuera
suficientemente alta o si se dispusiera de un catalizador.
De la discusin anterior se ve que en todos los casos para los cuales se tiene un
compuesto qumico que se forma o se disocia a una tasa extremadamente lenta se puede
considerar el componente mismo (y no sus elementos constituyentes) como prcticamente
un componente independiente de la fase. Si por ejemplo, se tiene una fase gaseosa
compuesta por hidrgeno, oxgeno y vapor de agua a una temperatura tan baja que el
agua prcticamente no se forma ni se disocia, se puede decir que la fase tiene tres
componentes independientes: H2, O2 y H2O (y no slo los dos componentes hidrgeno y
oxgeno). La constitucin fsica de la fase est determinada entonces por las masas de H2,
O2 y H2O por unidad de masa de la fase.
Es claro, de las consideraciones anteriores, que el nmero de componentes
independientes puede ser tan grande o tan pequeo como el nmero total de elementos
qumicos presentes. En el ejemplo anterior se tena n tres componentes independientes
(H2, O2 y H2O), en lugar de slo dos (H y O). De otro lado, si slo se tiene vapor de agua,
se puede descartar la disociacin en hidrgeno y en oxgeno y considerar que la fase
consiste de un solo componente (agua) y no de dos.
Considrese ahora el sistema compuesto de f fases y n componentes independientes.
Sea mik la masa del k-simo componente presente en la i-sima fase, entonces la
distribucin de los componentes entre las varias fases puede describirse
convenientemente por el arreglo:
m11, m21, ........ mf1
m12, m22, ........ mf2
............................
m1n, m2n, ........ mfn
(23)
A una temperatura y presin dadas, la condicin para el equilibrio del sistema es que el
potencial termodinmico sea mnimo. Esta condicin da relevancia al conjunto de
relaciones entre las cantidades (23).
Se asumir que la energa superficial del sistema es descartable y por lo tanto O puede
hacerse igual a la suma de los potenciales termodinmicos de todas las fases:
14
Discusin General sobre Diagramas de Fase
= 1 + 2 + ........ f
(24)
La funcin i depende de T, P y las masas mi1 , mi2 , ....... min de los varios componentes de
la i-sima fase:
i = i (T, P, mi1 , mi2 , ....... min )
(25)
La forma de esta funcin depende de las propiedades de la i-sima fase. Ntese, sin
embargo, que i considerada como una funcin de ni variables mi1 , mi2 , ....... min es
homognea en primer grado, adems, si se cambia mi1 , mi2 , ....... min por el mismo factor
k, no se alterar la constitucin de la fase (ya que slo depende de la relacin de las ms)
sino que se incrementa la masa total de la fase en el factor k. Por lo tanto i puede
multiplicarse por el mismo factor k.
Si el sistema est en equilibrio a una temperatura y presin dadas, debe ser la mnima.
Esto significa analticamente que si se impone en el sistema una transformacin
infinitesimal a temperatura y presin constante, la variacin resultante en puede
descartarse. Considerando una transformacin como resultado de la cual una cantidad m
(considerada como un infinitesimal de primer orden) del k-simo componente, se
transfiere de la i-sima a la j-sima fase, todos los otros componentes y fases no se veran
afectados. Entonces, mik sera mik-m y mjk sera mjk+m.
Con la variacin de slo cambiaron i y j , entonces se obtendr como la condicin
mnima:
= i + j = j m - i m = 0
mjk
mik
o
j = i
mjk
mik
(26)
Debido a que se puede presentar una ecuacin similar para cualquier par de fases y para
cualquiera de los componentes, se tendran juntas las n(f-1) ecuaciones de equilibrio.
1 = 2 = ...................
m11
m21
f
mf1
1 = 2 = ...................
f
m12
m22
mf2
............................................................
(27)
15
Oscar Jaime Restrepo Baena
1 = 2 = ..................
m1n
m2n
f
mfn
Se nota que cada ecuacin slo depende de la constitucin qumica de cada fase y no de
la cantidad total de sustancia presente en la fase. Adems, ya que (25) es una funcin
homognea de primer grado en las ms su derivada con respecto a cualquiera de las ms
es homognea de cero grado, esto es, su derivada slo depende de la relacin mi1 , mi2 ,
....... min . Del arreglo (23) se ve que hay (n-1)f de tales relaciones (las n-1 relaciones de n
variables contenidas en una columna de (23) determinan la constitucin de una fase).
Adems de estas (n-1)f variables tambin se tienen las variables T y p en (27), por lo tanto
se tienen un total de 2 + (n-1)f variables.
La diferencia, L, entre este nmero y el nmero n(f-1) de ecuaciones (27) es el nmero de
las (n-1)f+2 variables que pueden escogerse arbitrariamente, las variables restantes se
determinan entonces de las ecuaciones (5). Por lo tanto se llamar L al grado de
variabilidad, la varianza o el nmero de grados de libertad del sistema. Se tiene:
L = (n-1)f + 2 - (f-1)n
L=2+nf
L = 2 + C F
(28)
Esta ecuacin fue derivada por Gibbs y expresa la regla de fases. Dice que un sistema
compuesto por f fases y n componentes independientes tiene un grado de variabilidad L =
2 + n - f. Por grado de variabilidad se entiende el nmero de variables (se toman
usualmente T, P y las variables que determinan las composiciones de todas las fases) que
puedan escogerse arbitrariamente.
Para evitar malas interpretaciones debe notarse que slo se considera la composicin y
no la cantidad total de cada fase, porque el equilibrio termodinmico entre las dos fases
depende slo de los constituyentes y no de las cantidades totales de las dos fases
presentes, como se mostr en (26). Unos pocos ejemplos ilustrarn como puede aplicarse
la regla de las fases.
Ejemplo 1: Un sistema definido por un fluido qumicamente homogneo. Se tiene una sola
fase (f=1) y un componente (n=1); de (28) se obtiene entonces L = 2; por lo tanto se puede,
si se desea, escoger las dos variables T y P arbitrariamente, pero no se tendra la
oportunidad de cambiar la composicin ya que la sustancia es un compuesto
qumicamente definido. Note que la cantidad total de sustancia, como ya se estableci, no
se cuenta como un grado de libertad.
Ejemplo 2: Un sistema homogneo compuesto de dos gases qumicamente definidos.
Aqu se tiene una fase (f=1) y dos componentes independientes (n=2). De (28) se tiene L =
3. Esto implica que se pueden escoger libremente T, P y la relacin de los dos
componentes que determinan la composicin de la mezcla.
16
Discusin General sobre Diagramas de Fase
Ejemplo 3: Agua en equilibrio con su vapor saturado. Aqu se tienen dos fases: lquido y
vapor y un solo componente. Ya que f=2 y n=1, por lo tanto L=1. Slo se puede escoger la
temperatura arbitrariamente y la presin ser, entonces, igual a la presin de vapor
saturado para la temperatura dada. Ya que slo hay un componente, no se tendr,
obviamente, libertad de escoger la composicin de las dos fases. Ntese tambin en este
ejemplo, que para una temperatura dada se tendr un equilibrio entre cantidades
arbitrarias de agua y vapor de agua a una presin, la cual es igual a la presin de
saturacin. Sin embargo las cantidades de agua y vapor de agua no se cuentan como
grados de libertad.
Ejemplo 4: Un sistema compuesto por un componente qumico definido en tres fases
diferentes, slido, lquido y vapor, como por ejemplo hielo, agua y vapor de agua. Se tiene
un componente y tres fases, n=1, f=3. Se encuentra entonces de (28) que L=0. Esto
significa que no hay libertad de escoger las variables; las tres fases pueden coexistir slo
para un valor fijo de temperatura y un valor fijo de presin. Este hecho puede ilustrarse con
la ayuda de un diagrama en el cual la temperatura y la presin se grafican en las abscisas
y las ordenadas respectivamente.
Figura 1. Diagrama de fases del agua.
En la figura 1 la curva AB representa la presin del vapor de agua saturado graficada
contra la temperatura. Cuando los valores de T y P corresponden a un punto en esta curva
el agua y el vapor de agua pueden coexistir. Si manteniendo la temperatura constante se
incrementa la presin el equilibrio entre el agua y el vapor de agua no existir ms y toda
la sustancia se condensar en la fase lquida. Si en lugar de ello decrece la presin, toda
la sustancia se evaporar. De aqu que para los puntos por encima de la curva AB se
tendr agua y para los puntos por debajo de ella se tendr vapor, como se indica en la
figura 1.
La curva AC es anloga a la AB pero corresponde a la presin de vapor saturado en
contacto con hielo y no con agua lquida. Por encima de la curva AC es estable el hielo y
por debajo de ella es estable el vapor. Debido a que el agua y el vapor pueden coexistir a
lo largo de AB y el hielo y el vapor pueden coexistir a lo largo de AC, es necesario que el
punto en el diagrama correspondiente a los valores de T y P, para los cuales hielo, agua y
vapor pueden coexistir, cae en ambas curvas; esto es, el punto coincide con el punto de
interseccin A de las dos curvas. Se ve ahora que las tres fases pueden coexistir slo
para un valor definido de temperatura y presin.
17
Oscar Jaime Restrepo Baena
El punto A se llama punto triple debido a que es la interseccin, no slo de las curvas
agua-vapor y vapor-hielo sino tambin de la curva AD hielo-agua. Estas tres curvas
dividen el plano T, P en tres regiones que representan los rangos de estabilidad del vapor,
hielo y agua; el punto triple es la frontera de las tres regiones.
El punto triple del agua est a T = 0,0075C y a P = 0,0062 atm. Debido a que la presin
en el punto triple es menor que la presin atmosfrica la lnea horizontal P = 1 atm.
(punteada en el diagrama) intercepta las tres regiones hielo, agua y vapor. La interseccin
de la lnea punteada con la lnea AD corresponde a una temperatura igual a la del punto f
de congelamiento del agua a presin atmosfrica (0C). La interseccin b con la curva AB
corresponde a la temperatura de ebullicin del agua a presin atmosfrica (100C).
Para algunas sustancias la presin en el punto triple es mayor que 1 atm. Para estas
sustancias la lnea horizontal punteada, correspondiente a la presin atmosfrica, cae por
debajo del punto triple y pasa por lo tanto directamente de la regin slida a la de vapor
sin interceptar la regin lquida. A presin atmosfrica estas sustancias no se lican sino
que se vaporizan directamente desde la fase slida (sublimacin) y slo pueden existir en
la fase lquida a presiones suficientemente altas.
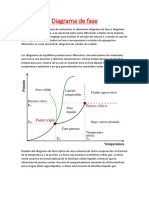
5. INTERPRETACION DE LOS DIAGRAMAS
5.1 SISTEMAS DE UN COMPONENTE
Las variables independientes en sistemas de un componente estn limitadas a la
temperatura y la presin ya que la composicin es fija. Se sigue entonces, de la regla de
fases, que el sistema es bivariante si slo est presente una fase; es univariante si hay
dos fases presentes e invariante si hay tres fases presentes. La regla de fases
proporciona entonces, un ensayo muy vlido para determinar el equilibrio; esto es, con
condiciones de equilibrio invariante, el nmero de fases presentes no puede exceder el
nmero de componentes ms dos. El diagrama de un sistema de un componente en el
cual las variables independientes temperatura y presin estn en las abscisas y las
ordenadas respectivamente, se presenta a continuacin; all se observa:
18
Discusin General sobre Diagramas de Fase
Figura 2. Relaciones de fase en un sistema de un componente.
a) Curva F-A (univariante): es la curva de sublimacin para la modificacin de A.
b) Curva A-B (univariante): es la curva de sublimacin para la modificacin de B.
c) Curva B-C (univariante): es la curva de presin de vapor para el lquido.
d) Curva A-D (univariante): es la curva de transicin para las modificaciones A y B y
representa el cambio del punto de transicin con la presin.
e) Curva B-E (univariante) es la curva de fusin para la modificacin B y representa el
cambio del punto de fusin con la presin.
f) Punto A: (invariante): Es el punto de transicin para las dos modificaciones cristalinas;
se llama tambin punto triple, ya que es el punto en el que coexisten en equilibrio tres
fases (dos slidas y una gaseosa).
g) Punto B: es el punto triple (invariante) para el equilibrio entre la modificacin cristalina
B, lquido y vapor.
h) El sistema es bivariante en todas las partes que no sean lneas o intersecciones.
Haciendo referencia a sustancias refractarias es hasta el presente imposible, con unas
pocas excepciones, medir directamente la presin de vapor de fases slidas y lquidas.
Es posible, sin embargo, construir diagramas para sustancias refractarias que muestren
cualitativamente la presin de vapor para las diferentes fases si se conocen las relaciones
temperatura-estabilidad debido a que la fase inestable siempre tiene una presin de
vapor ms alta que la fase estable, aunque la presin de vapor es infinitesimalmente
pequea.
Los sistemas de un componente tienen aplicacin en la fabricacin de materiales
cermicos. Lo ms espectacular es el desarrollo de tcnicas de alta temperatura y presin
para la fabricacin de diamantes sintticos y nitruro de boro. En el diagrama de equilibrio
de fases del carbono pueden verse las condiciones de temperatura y presin necesarias
para obtener diamante (metaestable a temperatura ambiente) y no grafito que es la otra
forma alotrpica del carbono.
19
Oscar Jaime Restrepo Baena
Figura 3. Diagrama de estabilidad para el carbono
Figura 4. Diagrama de estabilidad para el carbono
Otro sistema de gran inters para los refractaristas es el de la slice (SiO2). En l hay cinco
fases condensadas: cuarzo , cuarzo, tridimita 2, cristobalita y slice lquida. A una
atmsfera de presin las temperaturas de transicin son las que se muestran en la figura.
La transicin de cuarzo a cuarzo que tiene lugar a 573C es rpida y reversible. Las
otras transformaciones son lentas y necesitan largos perodos de tiempo para alcanzar el
equilibrio.
20
Discusin General sobre Diagramas de Fase
Figura 5. Diagrama de fases del SiO2
Los valores de presin de vapor del diagrama son una medida del potencial qumico de la
slice en las diferentes fases. El diagrama de la figura 5 puede extenderse de manera que
se incluyan las formas metaestables de la slice.
Figura 6. Diagrama de fases del SiO2 incluyendo las fases metaestables
Se tiene as el siguiente diagrama: a una temperatura cualquiera la fase slida estable es
aquella que tiene el valor ms pequeo de la presin de vapor (energa libre ms baja).
Esto no es estrictamente cierto, ya que por ejemplo a 1100C, la slice vtrea podra
transformarse en cristobalita , cuarzo o tridimita 2. De esas transformaciones la que
tiene lugar viene determinada por la cintica de los cambios. En la prctica cuando la
slice vtrea se calienta durante un largo perodo de tiempo a aquella temperatura, cristaliza
21
Oscar Jaime Restrepo Baena
o se desvitrifica para formar cristobalita que no es la forma de menor energa libre, pero
estructuralmente es la ms similar a la slice vtrea. Enfriando la cristobalita se trasforma
en cristobalita .
5.2 SISTEMAS DE DOS COMPONENTES
Los sistemas de dos componentes tienen tres variables independientes, nominalmente,
temperatura, presin y composicin. En los sistemas de importancia en cermica, donde
la presin de vapor permanece muy baja para grandes variaciones en la temperatura, la
variable presin y la fase gaseosa pueden eliminarse de consideracin. Por lo tanto los
diagramas pueden reducirse a dos dimensiones representando la composicin en las
abscisas y la temperatura en las ordenadas.
Los sistemas en los cuales se ha eliminado la presin se llaman sistemas condensados;
por lo tanto la regla de fases que representa estos sistemas condensados se expresa en
la ecuacin (29) donde F se refiere nicamente a las fases slida y lquida.
F+L=C+1
(29)
En los sistemas binarios bajo estas condiciones pueden coexistir tres fases produciendo
una condicin invariante; dos fases producen una condicin univariante y una fase una
condicin bivariante.
5.2.1 Insolubilidad total.
Se da cuando dos compuestos A y B son totalmente insolubles entre s en estado slido,
se pueden considerar los siguientes casos:
- Si A y B carecen de afinidad entre s: Sean Ta y Tb, las temperaturas de solidificacin de
A y B (Ta>Tb). Tomando como punto de partida un fundido homogneo de A y B a
temperatura superior a Ta; si se enfra el fundido los tomos de B obstaculizan la
solidificacin de A y hacen necesario un descenso de la temperatura hasta Ta para que A
pueda comenzar a solidificar. La accin perturbadora de B se debe tanto a la energa
cintica de sus tomos, como al efecto barrera que ellos oponen a los tomos de A para
que ellos se adicionen al slido que se est formando. La temperatura Ta es tanto menor
cuanto mayor sea la proporcin de tomos de B en el lquido.
La solidificacin se iniciar con la formacin de algunos cristales de A puro, ya que por no
existir afinidad entre A y B en estado slido, ningn tomo de B ser retenido en la red de
A. El lquido restante, enriquecido en B, respecto a su composicin inicial, exigir un nuevo
descenso de la temperatura para que la solidificacin pueda proseguir. Si el descenso de
temperatura se desarrolla de modo continuo y lento (en equilibrio), aumenta la cantidad de
A solidificado, hasta que el lquido residual contenga slo tomos de B. Al llegar a la
22
Discusin General sobre Diagramas de Fase
temperatura Tb se inicia la solidificacin de B en forma de cristales que, solidificados a
temperatura constante, constituyen una especie de matriz en la que se hallan dispersos los
granos del compuesto A (constituyente disperso).
En la figura 7 se sealan en las abscisas las concentraciones de A y B y en las ordenadas
las temperaturas de principio y fin de solidificacin.
Figura 7. Diagrama de insolubilidad total
- A y B forman un compuesto estequiomtrico AxBy: cuando entre los dos compuestos
existe afinidad qumica para formar otro compuesto A xBy; la red cristalina del compuesto C
suele ser distinta a la red de A y de la red de B, y ms estable que estas. Esto se debe a
que la agrupacin de tomos de A y B obedece a una atraccin entre ambos, enlace
inico, enlace covalente, etc. superior a la energa de enlace de los tomos de A entre s y
de B entre s.
La solidificacin se inicia cuando se ha disminuido suficientemente la temperatura hasta
equilibrar la energa cintica de los tomos (repulsin) con la afinidad qumica (fuerzas de
atraccin) que tiende a reagruparlos en forma de red slida del compuesto. Dado que la
atraccin de los tomos A y B es superior a la energa de enlace de cada elemento, esa
temperatura de solidificacin Tc, es ms elevada que Ta y Tb. Cuando se ha llegado a Tc,
la primera fraccin que solidifica deja al lquido con la misma proporcin de tomos A y B
que haba en el lquido inicial y por ello la solidificacin proseguir a temperatura constante
dando una estructura constituida por granos del compuesto C.
Cuando existe en el lquido un exceso de tomos de A respecto a la composicin
estequiomtrica AxBy, la solidificacin es similar a la de dos compuestos insolubles A y C
(siendo C en este caso el compuesto AxBy). La solidificacin de C se inicia a una
temperatura Tc inferior a Tc (Tc es tanto menor, cuanto mayor sea el exceso de tomos
de A). El lquido restante, enriquecido en A respecto a su composicin inicial, requerir un
nuevo descenso de temperatura para que, disminuyendo la energa cintica de los tomos
de A en el lquido, la solidificacin de C pueda seguir.
La solidificacin de C tiene lugar en un intervalo de temperatura hasta alcanzar la
temperatura Ta, momento en el que el lquido residual, compuesto slo por tomos de A,
23
Oscar Jaime Restrepo Baena
solidifica libremente a temperatura constante, como lo hacen los elementos puros. El
resultado ser un compuesto constituido por granos de C (constituyente primario),
contorneados por una matriz de granos de A, solidificados a temperatura Ta.
La naturaleza del constituyente matriz determina siempre el comportamiento trmico del
compuesto; claro est, que si la cantidad del compuesto qumico primario fuera tan grande
que los granos de C entraran en contacto entre s, podra designarse a ste como
constituyente matriz.
Figura 8. Insolubilidad parcial formando un compuesto estequiomtrico.
En la figura 8 se presenta el diagrama de solidificacin de dos compuestos insolubles
entre s que forman un compuesto estequiomtrico 50%A y 50%B.
- A y B presentan afinidad eutctica: se presenta cuando A y B tienden a formar un
compuesto de composicin A xBy estable en estado lquido hasta temperaturas inferiores a
Ta y Tb.
Siendo Ta y Tb respectivamente las temperaturas de solidificacin del compuesto A puro
y B puro y teniendo la mezcla lquida exactamente a la proporcin AxBy; suponiendo
Ta>Tb, si desciende la temperatura hasta Ta, los tomos de A no llegarn a solidificar,
pues la afinidad eutctica induce a que en el lquido la proporcin siga siendo de x tomos
de A y y tomos de B. Por consiguiente, nada de lquido A solidificar hasta tanto no
pueda solidificar tambin B. Pero tampoco se inicia la solidificacin al alcanzar la
temperatura Tb.
La solidificacin se inicia a una temperatura Te inferior tanto a Ta como a Tb en la que se
equilibra el balance entre fuerzas de atraccin y de repulsin. Puesto que a Te el
compuesto A se halla en estado lquido, pero notablemente sobre enfriado respecto a la
temperatura terica de solidificacin Ta, en primer lugar comienzan a solidificar, al
alcanzarse Te, algunos tomos de A, con gran velocidad de nucleacin y tendiendo por
tanto a dar una estructura muy fina. Pero de inmediato, y puesto que en el lquido la
proporcin de A y B debe seguir siendo x/y, solidifican tambin tomos de B, prximos, en
cantidad proporcional a los de A ya solidificados (y tomos de B por cada x tomos de A).
24
Discusin General sobre Diagramas de Fase
Dado que las condiciones de solidificacin del lquido restante a la temperatura Te son
idnticas a las iniciales, proseguir la solidificacin a temperatura constante. El resultado
a escala microscpica ser una mezcla de finos cristales de A puro y B puro (cada uno
con su red peculiar propia) ntimamente mezclados que dan un agregado complejo de
ambos compuestos, que recibe el nombre de estructura eutctica.
Cuando la mezcla lquida contiene un exceso de compuesto A, respecto a la composicin
eutctica, la solidificacin se inicia a la temperatura Ta, menor que Ta y tanto ms
prxima a ella, cuanto mayor sea el exceso de A que se tenga en la mezcla, con formacin
de granos de A.
El proceso contina con la formacin de ms cantidad de A slido cuando desciende la
temperatura. Al ir solidificando A, el lquido residual se enriquece en B y se va
aproximando a la composicin eutctica. Una vez alcanzada la proporcin AxBy, el lquido
solidificar a temperatura constante Te cuando el enfriamiento llegue a este valor, a modo
de matriz en la que quedan embebidos los granos de A solidificados previamente (en el
intervalo de temperatura Ta-Te).
En la figura 9 se indica como ejemplo el diagrama de solidificacin de un sistema formado
por dos elementos que cumplen la condicin de ser insolubles en estado slido, pero con
afinidad para dar una eutctica de composicin atmica 70%A y 30%B.
Figura 9. Afinidad eutctica.
Desde un punto de vista trmico, no son deseables como materiales slidos este tipo de
compuestos cuando se requiera trabajar a temperaturas superiores a la eutctica.
5.2.2 Diagramas de equilibrio de solubilidad total. Sistemas Isomorfos.
En la solidificacin de compuestos binarios de solucin slida total, supngase el formado
por dos compuestos A y B de puntos de fusin respectivos Ta y Tb (Ta>Tb).
Durante la solidificacin los tomos de B entran en la red cristalina de A a temperaturas
superiores a Tb, ya que entre A y B existe una afinidad de solucin que tiende a apresar
los tomos de B en la red de A.
25
Oscar Jaime Restrepo Baena
La solidificacin de una solucin slida se inicia a una temperatura Ts, tanto ms baja,
cuanto mayor sea la proporcin de tomos de B que presenta inicialmente el lquido.
El primer slido formado es ms rico en metal A que la composicin promedia del lquido.
En efecto, a la temperatura Ts, se fijan en el slido un nmero de tomos de B menor que
el promedio, ya que a dicha temperatura los tomos de B en el lquido estn a temperatura
superior a Tb; por lo que, teniendo en cuenta la perturbacin producida por los tomos de
B en la solidificacin de A, ser necesario disminuir la temperatura para que la mezcla
siga solidificando.
La mezcla acabar de solidificar cuando todos los tomos de B se hayan incorporado al
slido; esto ocurre (por la afinidad de solucin existente entre B y A) por encima de la
temperatura Tb. Para que la solidificacin se realice en condiciones de equilibrio, las
velocidades de enfriamiento deben ser lentas, a fin de permitir que en cada momento
(antes de descender a una temperatura inferior) se uniformice la composicin del slido
por difusin de tomos de B hacia el interior y se permita igualmente la uniformidad del
lquido. Aunque en la prctica no se consigue la completa uniformidad del slido a cada
temperatura, es interesante el estudio de esta solidificacin de equilibrio terica (ver figura
10).
Para un compuesto de m% de composicin, las composiciones de la fase slida en
equilibrio con la fase lquida para una cierta temperatura T1, son las que corresponden a
las intersecciones con las lneas slidus y lquidus del diagrama de equilibrio, cuando se
traza la horizontal correspondiente a la temperatura T1 Isotrmica (Regla de la Horizontal).
De la figura 10 se pueden deducir las proporciones de la fase slida de composicin s% y
la fase lquida de composicin l% a dicha temperatura. Si se llama P1 al peso total de
slido a dicha temperatura, P 2 al del lquido y P t al peso total del compuesto, se verificar:
26
P1 + P 2 = P t
(30)
P1 * s + P 2 * l = P t * m
(31)
Discusin General sobre Diagramas de Fase
Figura 10. Diagrama de equilibrio de solubilidad total.
siendo esta ltima expresin el resultado de igualar los porcentajes de tomos B. De las
dos igualdades anteriores se deduce la llamada Regla de los Segmentos Inversos,
expresada por la relacin:
P1 = l - m
P2 m s
(32)
Anlogamente pueden deducirse los porcentajes de mezcla solidificada con relacin al
total y de mezcla lquida con relacin al total:
P1 = l m
Pt
ls
(33)
P2 = m s
Pt
ls
(34)
5.2.3 Equilibrios invariantes.
Reacciones invariantes son aquellos cambios de fase que tienen lugar a temperatura
constante. Para que este tipo de reacciones pueda darse en un sistema binario ser
preciso que, segn la Ley de Gibbs, haya tres fases en equilibrio.
Con anterioridad se ha comentado la constancia de temperatura durante la solidificacin
eutctica formada por dos compuestos insolubles entre s. Otro tanto ocurre cuando una
27
Oscar Jaime Restrepo Baena
fase lquida reacciona con otra fase slida para producir otra fase slida diferente
(reaccin peritctica), o cuando una fase lquida origina otra fase lquida y una slida
(reaccin monotctica), o cuando dos lquidos reaccionan para dar un slido (reaccin
sintctica). En los sistemas binarios pueden producirse adems, otros tipos de reaccin
invariante, por ejemplo transformaciones en que todas las fases en equilibrio son slidas
(reaccin eutectoide, peritectoide, etc.)
5.2.3.1 Reaccin eutctica binaria.
En general se dice que un sistema binario presenta una reaccin eutctica, cuando un
lquido de composicin constante da lugar a dos slidos de composiciones definidas. La
reaccin eutctica puede esquematizarse como sigue:
Lquido E Slido 1 + Slido 2
La reaccin eutctica se realiza en su totalidad, es decir, hasta la desaparicin de todo el
lquido a temperatura constante. A esta conclusin, empricamente comprobable, se llega
tambin tericamente, por aplicacin de la Ley de Gibbs.
Una de las principales caractersticas de los sistemas eutcticos es que la temperatura a
la que se forma la fase lquida es ms baja que la de los dos componentes puros. Esto
puede ser una ventaja o una desventaja, segn las aplicaciones. Para aplicaciones de alta
temperatura, como son los materiales refractarios, no interesa que se forme una fase
lquida. As la formacin de eutcticos de bajo punto de fusin conduce a severas
limitaciones en el uso de refractarios como puede verse en el diagrama del CaO-Al2O3
(figura 29). La fase lquida puede aparecer a temperaturas muy bajas debido a la
existencia de una serie de eutcticos.
En general xidos fuertemente bsicos como el CaO forman eutcticos de bajo punto de
fusin con xidos anfteros o bsicos y ese tipo de compuestos no pueden usarse
adyacentemente, aunque ellos independientemente tengan alta refractariedad.
Sin embargo, si las aplicaciones de alta temperatura no son las de mayor importancia,
puede ser deseable la aparicin de fase lquida como una ayuda para efectuar, por
ejemplo, el proceso de coccin a bajas temperaturas, ya que la fase lq uida facilita la
densificacin. La efectividad de los sistemas con punto eutctico tambin se usa para la
fusin a bajas temperaturas de vidrios. Esto queda patente observando el sistema Na 2OSiO2 (figura 11). De 1710C para la slice pura, se pasa a 790C para la composicin
eutctica 75% SiO2 -25% Na 2O.
28
Discusin General sobre Diagramas de Fase
Figura 11. Sistema SiO2-2Na2O.SiO2
5.2.3.2 Reaccin peritctica binaria.
Cuando por reaccin de un lquido y un slido, a temperatura constante, se obtiene otro
slido, la reaccin recibe el nombre de peritctica (o perifrica). Se trata de un slido con
un punto de fusin no congruente.
Considrese el diagrama de la figura 12 y dentro de l, la composicin m% de la
mencionada curva. Por aplicacin de la Ley de Gibbs, se desprende que a la temperatura
Tp, sta se mantiene constante durante la reaccin:
Lquido + Slido n Slido m
El enfriamiento de equilibrio segn la isopleta m% transcurre, al principio, como un
sistema de solubilidad total, se van formando cristales de la solucin slida n y la
composicin del lquido sigue la curva liquidus. Al llegar a la temperatura peritctica Tp, el
lquido de composicin p, reacciona con la solucin slida n para trasformarse
completamente en la solucin slida m .
29
Oscar Jaime Restrepo Baena
Figura 12. Diagrama peritctico.
Cuando comienza la reaccin entre el lquido y n, los cristales de la solucin slida Am se
forman en la intercara lquido/ n. Esta capa de cristales de m acta de barrera e impide
la reaccin posterior entre el lquido y n. Para que la reaccin sea completa hay que dar
tiempo suficiente para la difusin de los tomos del componente A desde Bn hasta m . Tal
difusin dar lugar al crecimiento de m en las intercaras n/ m y m /lquido hasta que la
formacin de m sea completa. Como tal tiempo no se alcanza, los cristales primarios de
n no se trasforman completamente en m y persistirn aunque no sea una fase de
equilibrio.
5.2.3.3 Reaccin monotctica binaria.
Existen casos en que dos compuestos no forman fase nica en estado fundido. Entre
ciertos lmites de composicin dan dos capas lquidas cuyas composiciones dependen de
la temperatura y su mezcla slo es completa por encima de una cierta temperatura crtica
Tm, tal como se muestra en la figura 13. Aplicando la regla de fases al compuesto m% se
aprecia que al llegar a la temperatura Tm tiene lugar la reaccin invariante:
Lquido I Lquido II +
esta reaccin recibe el nombre de monotctica.
30
Discusin General sobre Diagramas de Fase
Figura 13. Diagrama monotctico.
El enfriamiento de una mezcla lquida por la isopleta m% se realiza de un modo similar al
de un eutctico, pero dando lugar, a la temperatura Tm, a una sola fase slida y a un
lquido de composicin muy diferente de la del inicial.
El sistema SiO2-MgO presenta una reaccin invariante del tipo monotctico para un 98%
de SiO2.
Figura 14. Sistema MgO-SiO2
5.2.3.4 Reaccin sintctica binaria.
La reaccin sintctica es una reaccin invariante consistente en la descomposicin, por
calentamiento, de una fase slida en dos lquidos inmiscibles:
31
Oscar Jaime Restrepo Baena
Lquido I + Lquido II
como se ilustra en la figura 15.
Figura 15. Reaccin sintctica.
Esta reaccin es muy poco frecuente. Del diagrama de equilibrio se desprende que toda
mezcla fundida cuya composicin se encuentre dentro del rango de la lnea sintctica, se
separa en forma de dos lquidos. Recprocamente, al solidificar, la reaccin sintctica
tendr lugar en la superficie o separacin de los lquidos Li y Lii.
Esta reaccin se produce en la intercara de los dos lquidos y por tanto la fase B formada
acta como una barrera que impide que contine la reaccin entre Li y Lii por lo que, en
general, ser muy difcil mantener condiciones de equilibrio en un sistema con punto
sintctico. Despus de la formacin de los cristales de la fase cada uno de los lquidos
solidificar independientemente.
Existe otra reaccin invariante conocida como metatctica en la cual un slido A, se
encuentra en equilibrio con otra fase slida , de composicin diferente y un lquido:
+ Lquido
indicando una fusin parcial del slido durante la transformacin.
5.2.3.5 Otras reacciones invariantes.
Las reacciones invariantes entre tres fases de un sistema binario pueden reducirse a dos
tipos. Uno de ellos es la transformacin de una fase en otras dos a temperatura constante:
Fase I Fase II + Fase III
32
Discusin General sobre Diagramas de Fase
en este tipo de reaccin quedan encuadradas las eutcticas y monotcticas.
El otro tipo corresponde a la reaccin de dos fases para dar una tercera, distinta a las
anteriores:
Fase I + Fase II Fase III
a este corresponden las reacciones peritcticas y las sintcticas.
Cuando las reacciones se dan en estado slido, existen tres posibilidades de gran inters
que son:
Reaccin eutectoide:
Reaccin peritectoide:
Reaccin monotectoide:
+
+
n m +
Estos equilibrios presentan una velocidad de reaccin ms lenta que sus equivalentes
cuando existe una fase lquida.
5.2.4 Sistemas binarios complejos.
En la figura 16 se presenta un ejemplo de un diagrama binario hipottico de considerable
complejidad el cual permite ilustrar como se realiza la cristalizacin bajo condiciones de
equilibrio. Los dos componentes son A y B. El componente A, en el rango de temperaturas
que muestra el diagrama, presenta cinco formas enantiotrpicas: liquido, 1, 2, 3 y 4.
El componente B existe en solo dos formas: Liquida y 1. Existe un componente
intermedio , el cual no existe en estado lquido. En una parte del diagrama de
composicin coexisten dos lquidos L1, L2. Los componentes por definicin, se funden
congruentemente para formar lquidos de su propia composicin.
Patrones de cristalizacin: Se consideran tres lneas verticales de composicin
constante (isopletas); Ellas son: C, D, E.
a) Cristalizacin por la isopleta C: A una temperatura por encima del punto k, la
sustancia es un lquido homogneo. Cuando la temperatura llega al punto k, se da una
separacin en dos lquidos; la composicin y la cantidad relativa de los mismos va
cambiando a medida que la temperatura desciende de k a n. A la temperatura del punto
m, por ejemplo, la composicin de los dos lquidos corresponde a la interseccin de la
lnea horizontal (lnea de amarre), pasando por m, con las fronteras del campo (puntos d y
e) y las cantidades relativas de los dos lquidos L1 y L2, son proporcionales a la lnea m-e
y d-m respectivamente.
33
Oscar Jaime Restrepo Baena
Figura 16. Diagrama binario hipottico para ilustrar los posibles cambios de fase.
A la temperatura del punto n se produce la cristalizacin de la fase slida 1, en solucin.
Las fases coexistentes slida y lquida tienen la composicin de los extremos izquierdo y
derecho SS1 y L3 respectivamente, de la lnea que pasa por n. Un descenso posterior de la
temperatura slo produce un cambio de composicin y un cambio en las cantidades
relativas de las dos fases, las cuales se determinan utilizando lneas horizontales; esto
hasta alcanzar el punto o momento en el cual las composiciones de slido y lquido son h y
a respectivamente. A la temperatura del punto o el enfriamiento se detiene hasta que todo
el lquido de composicin a ha cristalizado en una mezcla de soluciones slidas 1 y 2 de
composicin h e i respectivamente.
Un posterior enfriamiento desde p hasta o produce una reaccin entre las fases 1 y 2 . La
relacin entre las composiciones y las cantidades de ambas fases se obtiene trazando
lneas horizontales a las temperaturas de inters. El slido 1 cambia su composicin de
h a p y 2 de i a p; a la temperatura del punto p continua la reaccin entre los slidos
1 y 2 dando lugar a la desaparicin de 2.
34
Discusin General sobre Diagramas de Fase
La solucin slida 2 de composicin p persiste inalterada hasta alcanzar la temperatura
del punto q en este punto hay una descomposicin parcial de la fase 2 para formar 3 de
composicin q (descomposicin eutectoide). Las dos fases coexisten cambiando sus
cantidades relativas y su composicin hasta alcanzar el punto r en donde ocurre otra
descomposicin eutctica. El slido 2 desaparece completamente y se forma una nueva
solucin slida de composicin r2. En el punto s, 3 pasa a ser 4 y all coexisten las dos
fases 4 y hasta alcanzar la temperatura ms baja que se muestra en el diagrama.
b) Cristalizacin por la isopleta D: Una masa de composicin D se enfra desde una
temperatura en la que existe una fase lquida homognea; las transformaciones sufridas
son las mismas descritas en la isopleta C hasta que se alcanza el punto v aqu se realiza
una reaccin entre el slido 1 y el lquido L, obtenindose la redisolucin de 1 y la
precipitacin de 2. Las fases L y 2 coexisten cambiando su composicin con la
disminucin de la temperatura hasta que desaparece la ltima gota de liquido en el punto
w. Desde w hasta x slo est presente la fase 2. En x se precipita la fase a partir de 2;
pero 2 slo persiste en un rango muy corto de enfriamiento en donde reacciona con y
es sta fase la que persiste durante el enfriamiento restante que se muestra en el
diagrama.
La fase es un compuesto intermedio de composicin A xBy, esto es, que toma tanto de A
como de B su estructura, en proporciones mayores que las estequiomtricas. No puede
considerarse como un componente de un sistema subsidiario ya que no se funde en un
lquido homogneo, sino que por el contrario al calentarse pasa a ser una solucin slida
2.
c) Cristalizacin por la isopleta E: El enfriamiento de una masa de composicin E
produce la cristalizacin de la solucin slida 1 de composicin f1 en el punto f; las fases
slida y lquida, coexistentes, cambian en composicin hasta que se alcanza la
temperatura del punto eutctico Co. Entonces se produce un detenimiento en el
enfriamiento hasta que la reaccin se halla completado, desapareciendo el lquido y
cristalizando las fases 2 y 1en la proporcin indicada por el principio de la palanca,
pasando por el punto g. Las racciones posteriores que se presentan en el enfriamiento, no
son suficientemente diferentes a las que previamente se describieron.
5.3 SISTEMAS DE TRES COMPONENTES (TERNARIOS).
Existen cuatro variables independientes en un sistema ternario ellos son: presin,
temperatura y dos concentraciones variables, ya que una solucin ternaria requiere
establecer su composicin con respecto a dos de los componentes antes de fijar su
composicin total. Cuando coexisten cinco fases (punto quntuple) se produce un sistema
invariante; cuatro fases darn un sistema univariante; tres un bivariante etc. Representar
grficamente un sistema ternario es una tarea compleja. Pero, sin embargo, si la presin
35
Oscar Jaime Restrepo Baena
de vapor es tan pequea que pueda descartarse el sistema ternario puede tratarse como
un sistema condensado, como es el caso de los sistemas binarios y de nuevo la regla de
fases puede expresarse como:
F+L=C+1
Las composiciones pueden representarse en coordenadas triangulares utilizando el
mtodo de Roozebum (o de Gibbs modificado), tal como se representa en la figura 17, all
cada lado del tringulo equiltero se divide en cien partes y cada diez divisiones se
interceptan lneas paralelas de cada una de los otros lados. Un punto de uno de los
vrtices c, por ejemplo, est compuesto totalmente por el componente C. Un punto sobre
la lnea AB est compuesto enteramente por los componentes A y B sin C; la distancia
relativa de un punto, tal como X a cada una de los tres vrtices puede expresarse en
porcentaje y por lo tanto puede representarse una composicin porcentual de una mezcla
ternaria o solucin en trminos de los componentes A, B, C. El punto x por ejemplo
representa una composicin de 45% A, 20%B y 35%C; mientras que y representa 15% A,
15% B y 70% C.
Figura 17. Representacin de composiciones en un sistema ternario por medio de coordenadas triangulares.
Un diagrama de composicin triangular tiene tambin la ventaja que una serie de
adiciones de un tercer componente a la mezcla, para cualquier relacin de los otros dos
componentes, puede representarse por una lnea recta desde el vrtice del tercer
componente, por ejemplo, la adicin del componente B a la mezcla de 33% A y 67% C
(punto D) caer siempre sobre la lnea DB.
36
Discusin General sobre Diagramas de Fase
Figura 17. Visin en perspectiva de un modelo espacial de un sistema ternario con un eutctico simple y sis
compuestos ternarios.
La temperatura puede representarse por lneas rectas perpendiculares al plano del
tringulo de composicin y por lo tanto no pueden mostrarse directamente en una
superficie bidimensional an as, la temperatura de una superficie trmica (usualmente la
superficie lquidus) pude indicarse en intervalos de temperatura uniforme usando
isotermas como se hace con las curvas de nivel en los mapas topogrficos. El diagrama
del slido real tiene una apariencia como la que se muestra en la figura 17.
La superficie lquidus es entonces, una serie de superficies curvadas interceptadas, que
representan los campos de las fases primarias de los componentes del sistema. El campo
de una fase primaria de un compuesto ternario que funde congruentemente es una
superficie en forma de domo y la elevacin ms alta, coincide con la temperatura de fusin
del compuesto.
La representacin de Roozebum posibilita la generalizacin de la regla de los segmentos
inversos cuando para una cierta temperatura la mezcla H tiene dos fases en equilibrio, de
composiciones I y J suponiendo que el peso total de la mezcla H sea Pt y sean P j y Pi los
pesos respectivos de las fases J e I, se tendra que P t = P j + P i, por lo tanto se verifica que
(figura 18):
PJ = HI
PI
HJ
(35)
37
Oscar Jaime Restrepo Baena
Figura 18. Generalizacin de la regla de los segmentos inversos.
Cuando la mezcla H est en equilibrio a temperatura T1 con otras tres fases S, R, L; el
equilibrio ser invariante; es decir, sin ningn grado de libertad, a dicha temperatura- que
ser constante- las proporciones en peso de las fases pueden determinarse por la
aplicacin repetida de la regla de los segmentos inversos antes mencionada; sean
respectivamente P1, P2 y P3 los pesos de las fases R, L, S y Pt = P 1 + P 2 + P 3 el peso de
la mezcla H, se tiene entonces que:
P1 =
Pt
NL *
LR
SH
SN
(36)
P3 = P t - (P 1+P 2)
Figura 19. Equilibrio entre tres fases S, R, L.
38
P2 =
Pt
NR * SH
LR
SN
(37)
(38)
Discusin General sobre Diagramas de Fase
El tringulo SRL recibe de tringulo de conjugacin.
Equilibrio de dos fases: Si en un sistema ternario hay solo dos fases en equilibrio el
nmero de grado de libertad es dos; eso quiere decir que fijada la temperatura, resultan
indeterminadas las composiciones de la fase slida o bien de la fase lquida.
Equilibrio de tres fases: si en un sistema ternario hay tres fases en equilibrio lquido,
slido, slido, las dos reacciones posibles durante la solidificacin son:
Lquido + (reaccin eutctica binaria)
Lquido + (reaccin peritctica binaria)
El nmero de grados de libertad en estos casos es uno por consiguiente la reaccin
eutctica binaria (o peritctica binaria) no se realiza a temperatura constante, por lo tanto
puede variar la temperatura sin que se rompa el equilibrio.
A cada temperatura T1 de dicho intervalo, estn completamente definidos las
composiciones del slido y del lquido.
En la solidificacin de no equilibrio puede aparecer segregacin menor, no slo en los
constituyentes proeutcticos, sino tambin en los eutcticos y peritcticos binarios.
Equilibrios de cuatro fases: Pueden presentarse en la solidificacin cuando se realiza
una de las reacciones siguientes entre el lquido y las fases a ,b y c
Lquido + +
Lquido + +
Lquido + + +
(reaccin eutctica ternaria)
(reaccin peritctica ternaria de segunda clase)
(reaccin peritctica ternaria de tercer clase)
Estas reacciones son invariantes (L=0) y, por tanto, se realizan a temperatura constante.
5.3.1 Sistemas ternarios sin soluciones slidas.
5.3.1.1 Casos tpicos: En la figura 20 se presentan seis casos tpicos de sistemas
ternarios. La figura a) muestra un sistema sin componentes binarios o ternarios
presentes. El campo 1-4-2-c representa el campo de estabilidad del componente C en
equilibrio con la solucin. El slido C es la fase primaria para esta rea y es el ltimo
slido que desaparece cuando se calienta cualquier composicin en esta rea, tambin
es la primera fase que aparece cuando se enfra un lquido representado por puntos en
esta rea. Los puntos 1, 2 y 3 son eutcticos binarios, mientras que el punto 4 es un
eutctico ternario. Las lneas 1-4, 2-4 y 3-4 se conocen como lneas de frontera, cada una
de las cuales representa una condicin de equilibrio de tres fases (dos slidos y una
lquida). Las dos fases en equilibrio a lo largo de 1-4 son A y C, a lo largo de 2-4 son C y B
39
Oscar Jaime Restrepo Baena
y a lo largo de 3-4 son A y B . El punto 4 es un punto cudruple en un sistema condensado
en el cual los slidos A, B y C estn en equilibrio con la solucin
Figura 20. Seis casos tpicos de sistemas de tres componentes.
Los diagramas b), c), d) y e) en la figura 20 presentan un compuesto binario intermedio
AB; la lnea recta que une este compuesto con el tercer componente C, del sistema
ternario se llama lnea de conjugacin; las lneas de conjugacin dividen los sistemas
ternarios en tringulos de composicin las fases finales producidas por la cristalizacin de
equilibrio en uno de estos tringulos se indican por los vrtices del mismo; por ejemplo en
los diagramas b), c), d) y e) las fases finales en los tringulos A-BA-C son las fases
cristalinas A, AB y C; en la grfica f), donde se presenta un compuesto ternario junto a un
compuesto binario, las lneas de conjugacin forman cuatro tringulos subsidiarios.
La figura b) muestra un sistema ternario donde el compuesto binario AB es estable en su
punto de fusin. Si la lnea c-x cruza la lnea 5-6, el punto de interseccin ser un mximo
para dicha frontera y los puntos 5 y 6 sern eutcticos y cada tringulo de composicin se
comportar como un verdadero sistema ternario. Sin embargo si c-x no cruza 5-6, sino
que intercepta 1-5 y 4-5; (como en c)) entonces slo 6 ser un eutctico. En e) cruza el
campo de la fase primaria de otro compuesto, cuya composicin no es la de la lnea y por
lo tanto ella no describe un sistema binario.
En d) la composicin del compuesto binario AB cae fuera del campo 4-5-6-3 debido a que
presenta un punto de fusin incongruente. En el sistema binario AB se disocia a la
temperatura correspondiente al punto 4 en un slido A y en un lquido. En el sistema
ternario ABC, el compuesto AB es la fase primaria en el campo 3-4-5-6 y es all donde es
estable.
40
Discusin General sobre Diagramas de Fase
En e) AB se disocia en dos slidos A y B en el sistema binario AB. En el sistema ternario
el compuesto AB es estable en el campo 4-5-6
En f) el sistema tiene un compuesto binario AB y un compuesto ternario ABC, cada uno de
los cuales tiene un punto de fusin congruente con sus composiciones respectivas los
cuales estn al interior o en las fronteras de los campos en los cuales ellos son las fases
primarias.
Estos casos simples tambin se aplican a sistemas complejos tales como el de la figura
21.
Figura 21. Sistema de tres componentes Al 2O3-SiO2-CaO
5.3.1.2 Patrones de cristalizacin.
a) Sistemas simples: La relacin entre fases slidas y lquidas de un sistema que no
tiene soluciones slidas se conoce cuando se determinan las lneas lquidus del sistema
para todas las composiciones. El conocimiento de la curva de cristalizacin o la curva de
fusin (el inverso de la anterior) para cualquier fundido es muy importante en el estado del
calentamiento de cuerpos cermicos.
En la figura 22 el punto m es un eutctico ternario y todas las curvas de cristalizacin del
sistema terminan en este punto. Si un liquido de composicin a se enfra lentamente, el
sistema permanece lquido, hasta alcanzar la lnea lquidus, a esta temperatura comienza a
cristalizar el slido A. El curso de la curva de cristalizacin desde este punto a la frontera
m-k sigue la lnea recta trazada desde a hasta A. Esto es cierto para todas las curvas de
cristalizacin que no presenten soluciones slidas la composicin del lquido pasa de a
hasta b permitiendo la cristalizacin de A. En b aparece una segunda fase y la curva de
cristalizacin sigue la frontera k-m en la cual cristalizan juntas las fases A y C; en el punto
41
Oscar Jaime Restrepo Baena
m la temperatura permanece constante y cristalizan juntas las fases A, B y C, hasta que
todo el lquido ha desaparecido. El producto final ser una mezcla de cristales grandes de
A y C y pequeos cristales de A, B y C (mezcla eutctica).
Figura 22. Curso de la cristalizacin en un sistema ternario simple.
La composicin de los slidos que cristalizan en cualquier instante de entre b y m est
dada por el punto donde la tangente a la curva de cristalizacin intercepta el lado del
tringulo de composicin que representa las dos fases que coexisten. Por ejemplo en b,
como se indica en la figura 22 se tendr una composicin b. La relacin entre A y C est
dada por la regla de los segmentos inversos b-c/b- A. La composicin media de las
fases que cristalizan entre los puntos b y m est representada por la interseccin de una
lnea trazada desde m hasta b, con el lado que corresponde a los slidos que utilizan b; la
proporcin entre A y C est dada por b- c / b- A, la composicin media del slido total
que se separa entre a y m (antes de comenzar la cristalizacin de B) est determinada por
la lnea trazada entre m y a y el lado de composicin correspondiente, llegando hasta a.
Durante la cristalizacin eutctica en m la composicin del slido total cambia desde a
hasta a, alcanzando el punto final cuando desaparece la ltima gota de lquido.
El mtodo para calcular las cantidades de slido que se separan entre varias
temperaturas obedece a la regla de los segmentos inversos y es anlogo a lo explicado
para dos fases, tal como ya se anot. Por ejemplo, en el enfriamiento de un fundido de
composicin original a, desde la temperatura lquidus al punto al punto b, la relacin entre
la cantidad de slido cristalizado y la cantidad total del sistema, es igual ab/Ab mientras
que la cantidad de lquido de composicin b con el remanente en b es aA /Ab,
Similarmente la cantidad relativa de slido de composicin media a, cristalizada entre a y
m (antes que b haya comenzado a cristalizar) es igual am/am y la cantidad relativa de
lquido de composicin eutctica es igual a aa/am.
El caso de un sistema ternario con un compuesto binario estable en el punto de fusin se
discuti al presentar la figura b). La cristalizacin de cada subsistema se trata de manera
similar al caso anterior.
42
Discusin General sobre Diagramas de Fase
b) Sistemas con punto peritctico ternario: En la figura 23 el punto m es un eutctico
ternario y el punto o es un peritctico; ambos se encuentran al mismo lado de la lnea de
conjugacin C-AB; los puntos h y j son eutcticos binarios y se encuentran en lados
opuestos de la lnea. El campo de A (A-j-o-k) est atravesado por la lnea C-AB, de aqu
que el sistema C-AB no sea un verdadero sistema binario, la temperatura a lo largo de om, decrece de o hasta m y o es un punto peritctico.
Figura 23. Sistema ternario con un componente binario
En el enfriamiento, un fundido de composicin a cristaliza inicialmente un slido A a lo
largo de A-B. De b a o, A y AB cristalizan juntos y la composicin total del slido separado
entre a y o, est dada por a, entonces debe existir lquido restante cuando se llegue a o.
El punto a est en el tringulo de composicin A-AB-C y el producto final de cristalizacin
debe contener estas tres fases.
Es evidente, del diagrama, que las tres fases que estn en equilibrio en o son A, AB y C,
por lo tanto la solidificacin final de la composicin a debe realizarse en o y no en m, ya
que a se encuentra en el tringulo de composicin cuyas reas de fase slida C y AB
cristalizan, mientras una parte de la fase A es reabsorbida o disuelta.
El fundido C, sobre la lnea de conjugacin C-AB cristaliza como sigue: a lo largo de c-b
se separa A; a lo largo de b-o, se separan juntos A y AB; en o, C y AB se separan y A se
disuelve completamente; los productos finales de cristalizacin son solamente AB y C.
El fundido d, a la izquierda de la lnea de conjugacin en el tringulo de composicin BAB-C cristaliza como sigue: A lo largo de d-e se separa A; a lo largo de e-o, cristalizan C y
A juntos; en o se disuelve A y se forma AB (la temperatura permanece constante hasta que
todo A desaparece); a lo largo de o-m, AB y C cristalizan juntos; en m los productos finales
de cristalizacin son AB, B y C, lo cual es lgico debido a que d se encuentra en el
tringulo de composicin B, AB, C. La composicin media del slido que se separa entre
d y o est representada por el punto d. En el momento en el cual desaparece A en o y
antes de comenzar la cristalizacin en o-m, la composicin media del slido ha cambiado
de da d y est compuesta por C y AB. A lo largo de o-m la composicin media del
slido cambia de d a d y durante la cristalizacin final se pasa de d a d.
43
Oscar Jaime Restrepo Baena
c) Sistemas con puntos eutcticos binarios y ternarios: en la figura 24 los puntos h, j,
o y m se encuentran al mismo lado de la lnea de conjugacin.
Un fundido de composicin e cristaliza como sigue: a lo largo de e-b se separa A, en b
comienza a cristalizar AB y a disolverse A (la interseccin de la tangente a la lnea jbo
intercepta una extensin de la lnea AB-A), este proceso continua hasta alcanzar o debido
a que todas las lneas trazadas desde un punto cualquiera entre b y o y el punto e,
intercepta la lnea A-AB. La cristalizacin final se realiza cuando la composicin del lquido
y la temperatura del sistema alcancen a o. En este caso, A no se disuelve completamente
y los productos finales son A, AB y C. Si la tangente de la lnea j-o intercepta la lnea A-AB
y no su prolongacin, se incrementara la cantidad de A a lo largo de j-o.
Figura 24. Sistema ternario con un componente binario inestable.
Un fundido de composicin a que se ubica en el otro tringulo de composicin, cristalizar
como sigue: de a a b se separa A; entre b y c se separa AB y A se disuelve; en el punto c
todo A ha desaparecido (la composicin media del slido total separada entre a y c est
representada por AB). El punto de composicin media se mueve de A a AB a lo largo de
la lnea A-AB, a medida que la temperatura cae entre b y c. Desde c la lnea de
cristalizacin deja la frontera j-o y contina hacia d, mientras se separa AB; desde d hasta
m, B y AB se separan juntos y en m cristalizan juntos AB, B y C. Todos los fundidos que se
encuentran en el campo j-o-AB, pasan a travs del campo j-o-m-h; la lnea j-o se llama, en
este caso, una curva de alteracin y se indica con doble flecha.
d) Cristalizacin recurrente: La figura 25 ilustra un caso de cristalizacin recurrente. En
el punto c, en la cristalizacin de un fundido de composicin a, la fase A desaparece y la
curva de cristalizacin sigue la trayectoria recta hasta d, donde de nuevo comienza a
separarse A. A lo largo de d-o, A contina cristalizando y AB se reabsorbe (la tangente a
d-o intercepta la extensin de AB-A). En el punto o, A se disuelve con la separacin
simultnea de C y AB. La temperatura se mantiene constante hasta que A se disuelva
completamente. A lo largo de o-m se separan C y AB y los productos finales de
cristalizacin en m sern C, AB y B ya que el punto original se encontraba al interior del
tringulo B, C, AB.
44
Discusin General sobre Diagramas de Fase
Figura 25. Cristalizacin recurrente.
Un fundido e cristaliza como sigue: a lo largo de e-b se separa A; entre b y p cristaliza AB
y A se reabsorbe parcialmente; de p hasta d la tangente a la curva de cristalizacin (la
lnea de amarre) intercepta a la lnea A-AB y no su extensin, por lo tanto A y AB se
separan juntos. Desde d hasta o, la tangente intercepta la extensin de AB-A y por lo tanto
A se reabsorbe lentamente; en o A contina disolvindose hasta que C y AB se separan y
los productos finales de cristalizacin son A, AB y C.
5.3.2 Resumen de la cristalizacin en los sistemas ternarios que no contienen
soluciones slidas:
a) Cuando se enfra un lquido, la primera fase que aparece es la fase primaria para
aquella parte del sistema en la cual se representa la composicin del fundido.
b) La curva de cristalizacin sigue la frontera ms cercana segn la longitud de la lnea
recta que conecta la composicin del lquido original con la fase primaria de ese campo.
La composicin del lquido en los campos primarios est representada por puntos en la
curva de cristalizacin. Esta curva es la interseccin de un plano (perpendicular a la base
del tringulo y que contiene las composiciones del fundido original y la fase primaria) con
la superficie lquidus.
c) En la lnea de frontera aparece una nueva fase, la cual es la fase primaria del campo
adyacente. Las dos fase se separan juntas a lo largo de esta frontera, conforme disminuye
la temperatura.
d) Podran aparecer dos condiciones que alteraran la cristalizacin a lo largo de la
frontera. En un caso la fase primaria se incrementar, como en el caso donde la tangente
a la curva de frontera intercepta la lnea que conecta las composiciones de las dos fases
que se separan; o puede ser que se disminuya (siendo reabsorbida) si esta tangente
intercepta la prolongacin de esta lnea. En el otro caso la lnea de cristalizacin saldr de
la curva de frontera cuando la primera fase se ha reabsorbido completamente, dejando
solamente la segunda fase slida. Esto puede inferirse de un estudio de composicin
media del slido que se separa entre puntos sucesivos de la curva de cristalizacin.
45
Oscar Jaime Restrepo Baena
e) La curva de cristalizacin siempre termina en un punto invariante, el cual representa el
equilibrio de un lquido con tres fases slidas de los tres componentes del tringulo de
composicin en el cual se estudi el lquido original.
f) La composicin media del slido que est cristalizando en cualquier punto en una lnea
de frontera se obtiene por la interseccin de la tangente, en ese punto, con la lnea que une
la composicin de las dos fases slidas que estn cristalizando en el punto dado.
g) La composicin media del slido total que ha cristalizado en cualquier punto de la curva
de cristalizacin, se encuentra extendiendo la lnea que conecta el punto dado con la
composicin del lquido original, conectando las composiciones de las dos fases que se
han separado.
h) La composicin media del slido que se ha separado entre dos puntos en una frontera,
se encuentra en la interseccin de una lnea que pasa por estos dos puntos, con la lnea
que conecta las composiciones de las dos fases slidas que se separan a lo largo de esta
frontera.
6. DIAGRAMAS TERNARIOS NO METALICOS. CASOS PARTICULARES
Para conocer la naturaleza y el comportamiento de algunos materiales no metlicos vidrios, escorias, cementos, etc.- se hace necesario el empleo de diagramas ternarios. Su
utilidad apunta ms al conocimiento de las propiedades de estos materiales cermicos a
temperaturas elevadas, que a la deduccin de una estructura microgrfica resultado de la
solidificacin.
Muchos de estos materiales se obtienen por tcnicas de sinterizado a temperaturas en
que los constituyentes no llegan a alcanzar el estado lquido. Interesa, por ejemplo,
conocer la temperatura a la que una mezcla slida de composicin determinada
empezara a fundir; o bien la cantidad de fundente CaO que es necesario adicionar a una
ganga cida de mineral para lograr que funda la ganga dando una escoria de temperatura
de solidificacin lo ms baja posible.
Existe un abundante catlogo de diagramas ternarios cuyos componentes son materiales
cermicos. Sus reglas de interpretacin son similares a las expuestas en los apartados
anteriores.
La figura 31 corresponde al diagrama ternario ms fecundo (SiO2 - Al2O3 - CaO), seala
las regiones correspondientes a cementos Portland, escorias de horno alto, vidrios,
ladrillos refractarios siliciosos, ladrillos de chamota, ladrillos de almina, y porcelanas.
Es oportuno comentar el sistema SiO2 - Al2O3 - CaO. Por una parte el beneficio de los
metales exige la utilizacin de escorias adecuadas, a fin de eliminar la ganga asociada
46
Discusin General sobre Diagramas de Fase
con la mena en el mineral; por otro lado la solidificacin de aleaciones supone el empleo
de refractarios en hornos, bebederos, canales, mazarotas, etc.
6.1 CONSTITUYENTES SiO2 - Al2O3 - CaO - Mg0
La slice - SiO2 - funde a 1723C. En estado slido presenta tres formas alotrpicas
cristalinas (cuarzo, tridimita y cristobalita) y una amorfa (slice vtrea).
El cuarzo - de densidad 2,65 - es la variedad estable por debajo de 867 C. La tridimita de densidad 2,27 - es estable entre 867 y 1470C. La cristobalita -densidad 2,33 - es
estable por encima de 1470C.
Las transformaciones de una a otra forma alotrpica son tan lentas que prcticamente no
tienen lugar si no existe una accin nucleante heterognea proporcionada por Ca0 y FeO;
incluso en este caso, las transformaciones se realizan con gran lentitud. Por ello, una slice
transformada en cristobalita por coccin suele tener siempre cuarzo y tridimita.
Con otros calentamientos y enfriamientos se producen nuevas variaciones en las
proporciones de los tres tipos, mortificndose las dimensiones y, por tanto, la densidad
del conjunto. De hecho, la densidad proporciona una orientacin sobre el grado de
transformacin.
La slice tiene un carcter cido, en cuanto que tiene capacidad de reaccin con xidos
bsicos, como son el Ca0 y el MgO, para formar silicatos.
El Al2O3, funde a 2020C. Tiene muchas variedades alotrpicas. La ms estable
(irreversible) es el corindn ( Almina) que no presenta transformaciones cristalinas en
estado slido. Tiene bajo coeficiente de dilatacin lineal y posee alta resistencia a los
choques trmicos. Su densidad es 3,9. Es de carcter anftero: reacciona con xidos
metlicos bsicos para dar aluminatos, y con xidos cidos (Si02) para dar silicatos.
La magnesia, MgO, funde a 2800 C. Se obtiene por calcinacin de la magnesita (C03Mg)
- o a partir del Mg (OH)2 obtenido del agua de mar. No experimenta variaciones
cristalogrficas en estado slido. Su densidad es 3,3. Tiene un alto coeficiente de
dilatacin. La magnesia una vez calcinada, pierde su capacidad de hidratacin (a
diferencia de lo que ocurre con la cal) y puede ser almacenada sin dificultad. Puede
admitir tambin en solucin slida otros xidos.
La cal, Ca0, funde a 2570C. No presenta variaciones de sistema cristalino al cambiar la
temperatura en estado slido. Su densidad es aproximadamente 1,3. Puede obtenerse
por descomposicin de la caliza (CO3Ca). Al xido de calcio obtenido por calcinacin de
CO3Ca se le llama cal viva, y se emplea en procesos metalrgicos para formacin de
escorias, etc.
47
Oscar Jaime Restrepo Baena
La cal viva vuelve a hidratarse con gran facilidad a temperatura ambiente. Este es un
inconveniente para su almacenamiento y para el empleo como revestimiento refractario de
hornos, ya que los refractarios Ca0 llegan a desintegrarse en forma de polvo durante los
perodos de parada del horno por hidratacin del Ca0 a temperatura ambiente.
La aptitud hidratante de la cal viva es, en cambio, el fundamento de los morteros de cal; la
cal viva se hace reaccionar con agua en cilindros rotatorios, y forma el hidrxido Ca(OH)2,
o cal apagada. Esta cal apagada, ms arena, ms agua, es lo que se conoce con el
nombre de mortero de cal, empleado en la construccin: al reaccionar el hidrxido de
calcio con el CO2 del aire, endurece por formacin de carbonato clcico.
En la naturaleza aparecen asociadas la cal y la magnesia en las rocas denominadas
dolomticas: constituidas por CO3Ca Y CO3 Mg con una pequea cantidad de impurezas
de FeO, Si02, Al203-- Por calcinacin se obtiene una mezcla de composicin aproximada
58% CaO, 42% MgO.
A partir del estado fundido, la cal puede admitir en solucin slida otros xidos, en
cantidades superiores a las admisibles por Mg0 en las periclasas; estas soluciones
slidas en Ca0 reciben el nombre de limas.
Evidentemente, el carcter del xido de calcio - al igual que el de Magnesio - es bsico.
En la figura 26 se indica el diagrama de fases del sistema formado por un fundido de
CaO-MgO, que -para composiciones superiores a los lmites de solubilidad de la lima y la
periclasa- solidifica con formacin de una eutctica cuya temperatura de solidificacin es
2370C.
El diagrama indica que una fina mezcla de partculas slidas de Ca0 y Mg0 en
proporciones superiores a 10% de CaO, o inferiores a 85 % de sta, resisten sin fundir
durante el calentamiento hasta alcanzar la temperatura de 2370C; en que se obtendr un
fundido eutctico, y unos granos dispersos de CaO, o de MgO, segn que la composicin
sea hiper, o hipoeutctica, en CaO.
48
Discusin General sobre Diagramas de Fase
Figura 26. Sistema MgO-CaO.
6.2 SISTEMAS BINARIOS SiO2-CaO, SiO2-Al203, CaO-Al203
6.2.1 Sistema binario SiO2-CaO
En la figura 27 puede verse el diagrama binario SiO2-CaO. Entre las fases intermedias del
sistema hay varios compuestos:
- CaO.SiO2, que presenta dos variedades cristalogrficas: Wollastonita (a temperaturas
inferiores a 1125C), y Pseudowollastonita a temperaturas superiores. La temperatura de
fusin del SiO3Ca es 1544C.
Figura 27. Sistema SiO2-CaO.
49
Oscar Jaime Restrepo Baena
- 3CaO.2SiO2, que recibe el nombre de Rankinita, estable hasta la temperatura de
1464C.
- 2CaO.SiO2, denominado Larmita, cuya temperatura de fusin es 2130C.
- 3CaO.SiO2, denominado Alita, no estable para temperaturas inferiores a 1250C.
Las estructuras que se obtienen a partir de un fundido, de composicin determinada,
pueden deducirse fcilmente, por aplicacin de las reglas generales de interpretacin de
diagramas. En la figura 27 se sealan dichos constituyentes. El diagrama permite prever
la temperatura de fusin durante el calentamiento para una fina mezcla de partculas
slidas de Si02 y CaO, segn sea su proporcin en peso.
6.2.2 Sistemas binarios SiO2-Al203
En la figura 28 puede verse el diagrama SiO2-Al203. El sistema presenta una fase
intermedia, 3Al203.2SiO2, que recibe el nombre de Mullita.
Las distintas microestructuras que pueden obtenerse a partir de un fundido, para
contenidos en Al203 superiores a 80% (por ejemplo, refractarios electrofundidos), finalizan
su solidificacin a 1840C, con formacin de un constituyente matriz eutctico de mullita y
Al203.
Figura 28. Sistema SiO2-Al2O3.
Para contenidos en Al203 inferiores a la mullita, los refractarios del sistema slice-almina
empiezan a formar fase lquida, en el calentamiento, al alcanzar la temperatura eutctica
de 1595C, como puede verse en el diagrama (figura 28).
50
Discusin General sobre Diagramas de Fase
6.2.3 Sistema binario CaO-Al203
La figura 29 corresponde al diagrama binario CaO-Al203. Es la seccin del diagrama
ternario SiO2-Al203 para 0% de SiO2; y, por lo tanto junto con los anteriores (SiO2-Al203 y
SiO2-CaO) permite conocer la topografa del diagrama ternario SiO2-CaO-Al203.
Figura 29. Sistema CaO-Al203.
6.3 DIAGRAMA TERNARIO SiO2-CaO-Al203
En la figura 30 pueden verse en planta las proyecciones de las napas, los mximos de
este sistema, las trayectorias de las eutcticas binarias y las eutcticas y peritcticas
ternarias. Parece conveniente hacer notar la presencia de dos compuestos ternarios:
Anortita:
2SiO2.CaO.Al203 de temperatura de fusin 1533C, y
Gehlenita: SiO2.2CaO.Al203 de temperatura de fusin 1593C.
En la figura 31 se indican las reas de composicin de diversos productos tales como:
Cemento Portland, escorias de horno alto, vidrios, ladrillos siliciosos, ladrillos de chamota
-silicoaluminosos- y ladrillos de almina. Los materiales cermicos suelen clasificarse,
segn su composicin, en cidos, bsicos o neutros.
La basicidad suele expresarse -a modo de ndice numrico I- de varios modos: por la
relacin
CaO
SiO2
o por
CaO + MgO ,
CaO ,
SiO2 + Al203
SiO2 + Al203
51
Oscar Jaime Restrepo Baena
Figura 30. Sistema SiO2-CaO-Al203
etc. Conviene sealar que Al203 por su carcter anftero deber figurar en el numerador de
estas relaciones cuando las cantidades de xidos cidos son grandes; puesto que en ese
caso se comportar como bsico.
Los materiales encuadrados en el diagrama de la figura 31 se denominan bsicos o
cidos, segn que el ndice I sea mayor o menor que la unidad. Los vidrios son el prototipo
de escoria cida; la eutctica ternaria (1170C) de Tridimita, Pseudowollastonita y
Anortita (figura 30) es cida, los cementos son bsicos, etc.
6.3.1 Cementos.
El cemento Portland (as llamado por su coloracin gris, similar a las rocas de la localidad
de Portland) es un material bsico. Sus materias primas son caliza, y arcilla sistema
AI2O3, SiO2). Por sinterizacin en horno tubular a unos 1500C se obtiene un clnker de
cemento -granulado oscuro de dimetros variables desde unos mm a unos cm- que,
enfriado rpidamente, molido, y adicionando yeso para evitar fraguados prematuros, es la
materia prima del cemento.
Cuando al cemento se le adiciona agua, forma una pasta que endurece (fraguado), debido
a que sus componentes reaccionan con el agua formando, entre otros, el disilicato clcico
hidratado, aluminato tetraclcico hidratado, etctera.
52
Discusin General sobre Diagramas de Fase
Figura 31. Composiciones de diversos productos.
6.3.2 Escorias en la elaboracin de aceros.
En la figura 31 se enmarcan en un crculo las composiciones de las escorias de horno alto.
Una de las finalidades de la escoria es captar por fusin la ganga del mineral. Puesto que
el material de Fe tiene abundante ganga cida (SiO2, etc.), las escorias deben ser
bsicas. Sin embargo si se emplea demasiada basicidad para neutralizar la ganga cida
- adicionando un exceso de cal - se obtendran escorias que solidificaran, a temperatura
excesivamente alta. La escoria fundida conviene que tenga una temperatura de
solidificacin baja de otro modo, entre otros inconvenientes derivados de la falta de
fluidez, se produciran atascos al colar la aleacin.
Las composiciones de la escoria a obtener en horno alto varan entre amplios lmites (ver
zona rayada); una composicin representativa es 35% SiO2, 40% CaO, 10% MgO, 10%
Al203, 4% SCa, 1% FeO. Una vez determinada la composicin de la ganga del mineral
(arcilla, slice, caliza, magnesita, etc.) y fijada la temperatura T1 para fusin de la escoria (o
lo que es lo mismo, fijada su composicin final segn el diagrama ternario) pueden
determinarse por un sencillo clculo, las cantidades de fundente (generalmente caliza y
algo de doloma) a adicionar para poder formar esa escoria.
Las escorias de horno alto en forma granulada obtenida por enfriamiento con agua, se
emplean como materia prima -parte de la carga de los hornos- para obtencin de
cemento. Las escorias, enfriadas al aire y trituradas, se emplean tambin en los firmes de
autopista en sustitucin (con ventaja) de la piedra caliza.
53
Oscar Jaime Restrepo Baena
El revestimiento refractario de los convertidores en las zonas de contacto con la escoria
lquida deber ser necesariamente bsico ya que, para eliminar P, contienen escorias
bsicas en el interior del fundido en agitacin.
En la elaboracin del acero, adems de la fusibilidad de la escoria, interesan tambin
otras caractersticas de sta; concretamente su aptitud defosforante y desulfurante.
En la actualidad en los aceros obtenidos en horno elctrico hay siempre dos etapas en la
elaboracin del acero y dos escorias, bsicas (una oxidante y otra reductora),
acompaando a cada etapa.
La primera es una etapa oxidante cuya finalidad es oxidar los elementos menos nobles
que el Fe y en particular el P. Pero para poder eliminar los xidos de Fsforo se precisa
una escoria rica en CaO, bsica, que retenga el Fsforo en forma de fosfato (P 205.3Ca0 y
P205.4CaO). Una vez efectuado el primer desescoriado -la escoria es negra y espesa- el
bao lquido queda muy oxidado y con bajos porcentajes de C, Mn, Si, P. Por ello, antes
de la segunda etapa se efecta, a veces, una carburacin del bao, cuando se desean
fabricar aceros de alto contenido en C, mediante la adicin de carbono o sumergiendo los
electrodos en el bao.
La segunda etapa es reductora para eliminar el S en forma de SCa (por la accin
reductora de C2Ca y Si2Ca, CaO) por lo que se precisa una escoria tambin bsica.
Cuanto ms bsica es la escoria, ms completa es la eliminacin del S.
El revestimiento refractario de las zonas del horno en contacto con la escoria debe ser
bsico. Hornos con revestimiento cido exigiran escorias cidas para evitar el ataque
qumico del revestimiento y, en consecuencia, sera imposible la eliminacin del P y del S.
Las temperaturas de colada de los aceros varan entre 1575C y 1650C. Las
temperaturas de solidificacin de las escorias deben ser, por tanto, unos 25 superiores a
aquellas, es decir, entre 1600C y 1675C.
6.3.3 Refractarios.
Se suelen denominar refractarios a los materiales capaces de mantener sus propiedades
fsicas y qumicas a altas temperaturas.
El orden de temperaturas a superar sin ablandamiento suele fijarse por lo menos en
1350C. Los componentes simples del sistema Si02-Al203-Ca0 superan este nivel de
temperaturas. En efecto, como ya se indic, el Si02 funde a 1723C, el Al203 funde a
2020C y el Ca0 a 2570C. El Mg0 funde a 2800C.
El material refractario no puede estar constituido exclusivamente por uno slo de estos
constituyentes; generalmente, se necesita adems un aglomerante que aglutine los
grnulos del constituyente principal, dndole cohesin.
54
Discusin General sobre Diagramas de Fase
La eleccin de un material como refractario est determinada no slo por la temperatura
que es necesario alcanzar sin que se produzca ablandamiento, sino tambin -como se ha
indicado ya a propsito de las escorias- por su resistencia a la accin qumica de los
fundidos, o de los gases, que hayan de estar en contacto con el material refractario. Por
ello, los refractarios suelen denominarse cidos, cuando su composicin tiene una
cantidad de xidos cidos superior a la de xidos bsicos.
6.3.3.1 Ladrillos.
Entre los refractarios cidos, se encuentran (ver figura 31) los ladrillos siliciosos, los
ladrillos de chamota (o ladrillos silicoaluminosos) y los ladrillos aluminosos y de almina (a
veces llamados neutros si son de almina pura).
Los ladrillos siliciosos son aquellos constituidos casi exclusivamente por Si02. Es
preciso conferir a los grnulos de Si02 una cierta compacidad, y por ello estos ladrillos
suelen obtenerse por mezcla de SiO2 con una pequea cantidad de Ca0 (1,5 a 2% de
CaO): que por coccin a 1475C sinteriza los grnulos de Si02 "dispersos". Debido a su
composicin empiezan a fundir -en servicio- por encima de 1436C; (ver figura 27), pero
dado que este deterioro afecta slo a las zonas perifricas del ladrillo, el resto sigue con
compacidad suficiente para aguantar temperaturas de trabajo
Los ladrillos siliciosos presentan buena resistencia a comprensin (ensayo TA) hasta
temperaturas prximas a la de fusin (en cambio, los ladrillos silicoaluminosos se
desmoronan a partir de 1350C), son ms baratos que los bsicos, y se utilizan
principalmente como elementos arquitecturales para bvedas de horno, cmaras de
hornos de coque, salidas de gases, etctera.
Se denominan ladrillos de chamota o silicoaluminosos, los constituidos por SiO2 y
25% a 45% de Al2O3, es decir, formados a base de arcillas. El mtodo de fabricacin
suele consistir en mezclar varias arcillas con agua y cocer el conjunto ya prensado a unos
1300C. El constituyente disperso -si as pudiera denominarse, ya que durante la coccin
en realidad no llegan a alcanzarse los 1595C necesarios segn diagrama para obtener
por fusin una matriz eutctica- es Mullita. Los ladrillos de 32% de Al2O3 se emplean
hasta temperaturas de 1250C y los de 45 % Al2O3 hasta 1400C. En todos los ladrillos
silicoaluminosos de menos de 72% Al2O3, un calentamiento en servicio a temperatura
superior a 1595C producira una fusin eutctica en la intercara de Mullita y SiO2; con
mayor cantidad de eutctica cuanto menor sea el % de Al2O3. Por consiguiente, cuando
los ladrillos silicoaluminosos son expuestos a temperaturas superiores a 1595C, no slo
ablandan sino que se inicia una fusin (ver diagrama 28) con cantidad de lquido suficiente
para producir el desmoronamiento del material.
Los ladrillos silicoaluminosos tienen buena resistencia al choque trmico, son los ms
baratos, y los de mayor consumo (75% del total). Pero no resisten bien la accin de
55
Oscar Jaime Restrepo Baena
escorias ni de metales fundidos. Se usan para hornos de recalentamiento, de laminacin,
de forja, etc.
Ladrillos aluminosos y de almina. Suelen denominarse aluminosos los que tienen ms
de 50% de almina, pero no mullita. Considerando el sistema SiO2- Al2O3, los ladrillos con
ms de 90% de Al2O3, obtenidos por electrofusin de almina, resisten en servicio hasta
temperaturas ms altas que los aluminosos y por eso se emplean en lugares del horno
sometidos a muy alta temperatura. El diagrama de equilibrio muestra que la fusin de los
contornos de Al2O3 no se inicia hasta alcanzar 1840C.
Tienen un bajo coeficiente de expansin trmica -aproximadamente la mitad de los
silicoaluminosos-, alta resistencia a choques trmicos y son muy resistentes a la erosin
por desgaste. A pesar de su precio elevado, se utilizan cada vez ms. No pueden estar
en contacto con escorias bsicas por el riesgo de formar aluminatos; ni con cidos por la
posibilidad de eutcticas. Se utilizan, a veces, frente a escorias dbilmente bsicas (por
ejemplo, cucharas).
6.3.3.2 Refractarios bsicos.
Para resistir la accin de escorias bsicas, es necesario un revestimiento bsico. Sus
temperaturas de ablandamiento son ms altas que las de los revestimientos cidos. Sin
embargo, no pueden emplearse refractarios constituidos exclusivamente por CaO; sta,
por mucho que se calcine, se hidrata con el agua y producira un desmoronamiento del
refractario (la cal se utiliza slo como escorificante). Por fortuna, segn se ha indicado
ms arriba, el Ca0 aparece asociado naturalmente con el Mg0 en las rocas dolomticas y
por ello un tipo de refractario bsico es la doloma obtenida por calcinacin de la roca, con
posterior molido y apisonado hasta formar un bloque.
La doloma calcinada y granulada, suele utilizarse tambin para reparar revestimientos
bsicos en las zonas de desgaste. Normalmente, la doloma se comporta muy bien
durante el trabajo del horno, aunque le afectan de modo importante -como ya se ha
indicado- las paradas prolongadas a temperatura ambiente: por la higroscopicidad del
CaO. Por otro lado, un inconveniente de la doloma es que parte de Ca0 se combina
durante la coccin, o bien en el horno, con algo de Si02 para dar 2CaO-SiO2, que en el
enfriamiento experimenta una gran dilatacin al transformarse en otra variedad cristalina;
esta dilatacin tiende a desintegrar la masa de doloma.
Los refractarios bsicos de magnesia proporcionan mejor comportamiento que los de
doloma frente a las escorias bsicas, si bien a costa de un precio muy superior. La
magnesita (CO3Mg) calcinada a temperaturas superiores a 1000C produce Mg0 no
hidratable. Este Mg0 si es muy puro, no tiene ninguna tendencia a aglomerarse por
coccin, como aglomerante suele emplearse Fe en forma de sulfato, fosfato u xido que por fusin a 1600C- forma un constituyente matriz complejo del tipo de las espinelas. La
coccin de los ladrillos de magnesita suele hacerse entre 1600 y 1700C.
56
Discusin General sobre Diagramas de Fase
La magnesia tiene un alto coeficiente de dilatacin, lo cual es un inconveniente frente a los
cambios de temperatura en servicio. Presenta, en cambio, claras ventajas como son la
capacidad de absorber -en forma de solucin slida- cantidades importantes de xido de
cal y de hierro de las escorias bsicas, antes que se produzca el deterioro del refractario.
6.3.3.3 Refractarios neutros.
Estn constituidos por 40% Cr2O3 (cromita). l5%MgO, 20% Al2O3 y 15% de xidos de
hierro. Se colocan en hornos que tienen ladrillos de slice y de magnesia, entre ellos, para
evitar un contacto que producira su destruccin por reaccin entre aqullos. Son
refractarios muy pesados - peso especfico 3,1-, su resistencia bajo carga y su resistencia
a los cambios trmicos son bajos.
Para terminar la referencia a los materiales cermicos de la figura 31, cabe sealar que la
composicin de las porcelanas -cida- es parecida a la de los ladrillos silicoaluminosos;
obtenindose tambin a partir de arcillas.
Figura 32. Sistema SiO2-Mullita-Leucita.
En la figura 32 se indican varios tipos de "porcelanas" en un diagrama ternario SiO2 Mullita- Leucita. Algunas de las porcelanas -como la dental- no se obtienen por coccin,
sino por fusin, debido a su baja temperatura de solidificacin.
57
Oscar Jaime Restrepo Baena
7. BIBLIOGRAFA
VALENCIA, Asdrbal. Metalurgia fsica. Universidad de Antioquia. 1987. 534 p.
FLINN, Richard, TROJAN, Paul. Engineering Materials and their applications. 2 ed.
Houghton Mifflin Company. Boston, 1981. 698 p.
PERO SANZ, Jos A. Ciencia e Ingeniera de Materiales. Metalurgia fsica: estructura y
propiedades. Ed. Dossat. Madrid, 1993
GORDON, Paul. Principles of phase diagrams in materials systems. McGraw Hill. New
York, 1968. 232 p.
FERMI, Enrico. Thermodynamics. Dover Publications. INC. New York, 1936. 160 p.
LANDON, Palatnik. Phase equilibria in multicomponent systems. Holt Rimehart and Wiston
Inc. New York, 1964. 454 p.
RHINES, Frederick. Phase diagrams in metallurgy. Their development and application. Mc
Graw Hill, New York, 1956. 340 p.
MARSH, J. S. Principles of phase diagrams. Mc Graw Hill, New York, 1935. 191 p.
PAVLOV, P. V. Fsica del estado slido. Editorial MIR, Madrid, 1992.431 p.
FINDLAY, Alexander. Phase rule and its applications. Dover publications, Inc. 1951. 494 p.
VERDEJA, L. F. Siderurgia. Universidad de Oviedo, Oviedo, 1993.
LEVIN, E. y otros. Phase diagrams for ceramists Vols. I-II. The American Ceramic Society
Inc. Columbus, Ohio, 1956-1959.
CASTELLAN, G. Fisicoqumica. Fondo Educativo Interamericano, Mxico, 1976. 835 p.
GASKELL, D. Introduction to metallurgical Thermodynamics. Mc graw Hill, Washington
D.C. , 1973. 520 p.
58
Discusin General sobre Diagramas de Fase
Diagrama de fases del H 2O
Diagrama de fases del hierro.
59
Oscar Jaime Restrepo Baena
Diagrama de fases del azufre
Sistema binario MgO-Al2O3
60
También podría gustarte
- Corrección Respuesta (V Ó F)Documento4 páginasCorrección Respuesta (V Ó F)Luzmila Numbela ZuritaAún no hay calificaciones
- ADA 9. Reporte de Investigación Sobre Aspectos de La Organización Social en México.Documento4 páginasADA 9. Reporte de Investigación Sobre Aspectos de La Organización Social en México.Luis Ángel Mézquita DíazAún no hay calificaciones
- Ejercicios Del Método IntegralDocumento3 páginasEjercicios Del Método IntegralNicol RT100% (1)
- La Era de Las Imágenes en EscalaDocumento26 páginasLa Era de Las Imágenes en EscalaCarlo Magno100% (1)
- GUIA N° 2-Fuerza y CampoDocumento3 páginasGUIA N° 2-Fuerza y CampoHarry Daniel Watson100% (1)
- PRÁCTICA 5-CAPACITANCIA. Eq. 5Documento8 páginasPRÁCTICA 5-CAPACITANCIA. Eq. 5LUIS HUMBERTO B�RCENAS GARC�AAún no hay calificaciones
- Diagramas de FaseDocumento106 páginasDiagramas de FaseSantiagoVargasAún no hay calificaciones
- Transferencia de CalorDocumento24 páginasTransferencia de CalorWilson RsmAún no hay calificaciones
- Cuadernillo de Trabajo Unidad1Documento10 páginasCuadernillo de Trabajo Unidad1Carlos Martinez ReyesAún no hay calificaciones
- Cronologia Del Petróleo 1783-2008Documento10 páginasCronologia Del Petróleo 1783-2008Carlos Alberto Ramirez PascualliAún no hay calificaciones
- TalleresDocumento20 páginasTalleresLuis Alfns MolinaAún no hay calificaciones
- Resumen de Petroquimica IDocumento6 páginasResumen de Petroquimica IWilliams AE100% (1)
- Informe de Difusion de MetafisicaDocumento39 páginasInforme de Difusion de MetafisicaSamed Maraza JaliriAún no hay calificaciones
- Fluidizacion Concepto GeneralDocumento15 páginasFluidizacion Concepto Generaljlls21Aún no hay calificaciones
- 1.2 Normas de ConstrucciónDocumento4 páginas1.2 Normas de ConstrucciónJuan Guillermo Rivera Berrío67% (3)
- Aplicaciones de Las Ecuaciones Diferenciales de Primer Orden, Crecimento y DecrecimientoDocumento31 páginasAplicaciones de Las Ecuaciones Diferenciales de Primer Orden, Crecimento y Decrecimientohildelbrando correasalcedo100% (2)
- Sintesis de Nanoparticulas de Silicio Por Metodo Sol-GelDocumento11 páginasSintesis de Nanoparticulas de Silicio Por Metodo Sol-GelJOSE ANTONIOAún no hay calificaciones
- Cálculo de La Conductividad TermicaDocumento10 páginasCálculo de La Conductividad TermicaDiana CoronadoAún no hay calificaciones
- Ensayo - Composicion en La Película Petroleo Sangriento PDFDocumento5 páginasEnsayo - Composicion en La Película Petroleo Sangriento PDFCarlosAún no hay calificaciones
- Fenómenos de TransporteDocumento5 páginasFenómenos de TransporteLenny QuinteroAún no hay calificaciones
- Ejercicios Resueltos Estructuras Cristal PDFDocumento9 páginasEjercicios Resueltos Estructuras Cristal PDFEmmanuel Martinez HernandezAún no hay calificaciones
- Determinacion Crioscopica Del Peso Molecular FinalDocumento13 páginasDeterminacion Crioscopica Del Peso Molecular FinalPier Navarro100% (1)
- Diagrama de FaseDocumento5 páginasDiagrama de FaseKevin Perez YalleAún no hay calificaciones
- PIA FCQ Eq10Documento11 páginasPIA FCQ Eq10Judi SandovalAún no hay calificaciones
- Tarea 1 LabiiDocumento8 páginasTarea 1 LabiiYesenia FelixAún no hay calificaciones
- Gases Reales - ECUACION DE ESTADO - PITZERDocumento17 páginasGases Reales - ECUACION DE ESTADO - PITZERDaniel TovarAún no hay calificaciones
- Gas NaturalDocumento24 páginasGas NaturalAny Sanchez100% (1)
- Segunda Serie de Equilibrio y Cinética Grupo 01 2019-1Documento2 páginasSegunda Serie de Equilibrio y Cinética Grupo 01 2019-1Luigi HernándezAún no hay calificaciones
- Consulta Produccion y Consumo de PolimerosDocumento2 páginasConsulta Produccion y Consumo de PolimerosjimboAún no hay calificaciones
- Bitacora 2 - Acosta de La Cruz Edwin 2FM1Documento6 páginasBitacora 2 - Acosta de La Cruz Edwin 2FM1Edwin LuDwInAún no hay calificaciones
- Rutenio TrabajoDocumento12 páginasRutenio TrabajomaritzaAún no hay calificaciones
- Síntesis y Caracterización de Nanoparticulas de TiO2 Por Espectroscopia RamanDocumento4 páginasSíntesis y Caracterización de Nanoparticulas de TiO2 Por Espectroscopia RamanEZEQUIEL BRANDAN100% (1)
- Boletin Obtencion EtilenoDocumento2 páginasBoletin Obtencion EtilenoJ Gonzalo Chuquimia MuñozAún no hay calificaciones
- Begg 218Documento28 páginasBegg 218Franz Gustavo Vargas MamaniAún no hay calificaciones
- Documental Una Verdad IncomodaDocumento2 páginasDocumental Una Verdad IncomodaCarly Ximena Diaz PerezAún no hay calificaciones
- Estudio Teórico y Experimental de Un Sistema de Desalinización de Agua de Mar Basado en La Técnica de Humidificación DeshumidificaciónDocumento22 páginasEstudio Teórico y Experimental de Un Sistema de Desalinización de Agua de Mar Basado en La Técnica de Humidificación DeshumidificaciónGispertCamonesMarzanoAún no hay calificaciones
- Iagenesis, Catagenesis y MetagenesisDocumento61 páginasIagenesis, Catagenesis y MetagenesisdiegoAún no hay calificaciones
- Determinación Del Punto de EquilibrioDocumento5 páginasDeterminación Del Punto de EquilibrioIridianaaGómeez'Aún no hay calificaciones
- Aplicación A Las Ecuaciones Diferenciales A La Ingenieria de PetroleosDocumento3 páginasAplicación A Las Ecuaciones Diferenciales A La Ingenieria de PetroleosJussef Fuentes Quintero100% (2)
- Gibbs HelmholtzDocumento1 páginaGibbs HelmholtzkidmauricioAún no hay calificaciones
- Taller Desti Laci OnDocumento3 páginasTaller Desti Laci Onpaolavera12Aún no hay calificaciones
- Sistema de Masa de ControlDocumento17 páginasSistema de Masa de ControlRoberto Chucuya H100% (1)
- Diagrama de FasesDocumento4 páginasDiagrama de FasesNorma ItoAún no hay calificaciones
- Guía Equilibrio Líquido VaporDocumento3 páginasGuía Equilibrio Líquido VaporLa AndreaAún no hay calificaciones
- Absorcion Por Aceite LigeroDocumento34 páginasAbsorcion Por Aceite LigeroRobertoCarlosDazaAún no hay calificaciones
- Fenómenos de TransporteDocumento12 páginasFenómenos de TransporteMaribel OtoyaAún no hay calificaciones
- Subenfriamiento ConstitucionalDocumento5 páginasSubenfriamiento ConstitucionalIsaac ZTAún no hay calificaciones
- Ciclo DieselDocumento5 páginasCiclo DieselFelipeDiazAún no hay calificaciones
- MARCO TEÓRICO Intercambiador de CalorDocumento4 páginasMARCO TEÓRICO Intercambiador de CalorJuan ApzAún no hay calificaciones
- Tabla 2Documento8 páginasTabla 2Joel RodrigoAún no hay calificaciones
- Proceso Bayer, Hall-HeroultDocumento7 páginasProceso Bayer, Hall-HeroultRoybestia Ruiz100% (1)
- Antecedentes Cinetica Quimica (Hidrolisis)Documento6 páginasAntecedentes Cinetica Quimica (Hidrolisis)Aleex Cas100% (1)
- Equilibrio de Fases en Sistemas ÍgneosDocumento14 páginasEquilibrio de Fases en Sistemas ÍgneosEvelyn ArcevAún no hay calificaciones
- Ejercicios ViscosidadDocumento1 páginaEjercicios ViscosidadItzel López Eugenio100% (1)
- Temperatura CríticaDocumento2 páginasTemperatura CríticaSaul PjAún no hay calificaciones
- Fluidos DesigDocumento101 páginasFluidos DesigRicardo MateoAún no hay calificaciones
- BronceDocumento11 páginasBronceliscandroAún no hay calificaciones
- ViscosidadDocumento4 páginasViscosidadJP NavarroAún no hay calificaciones
- Examen Final Transferencia de MasaDocumento17 páginasExamen Final Transferencia de MasaSasha EspinosaAún no hay calificaciones
- Unidad 6Documento20 páginasUnidad 6Alejandra Pineda AmayaAún no hay calificaciones
- Cerámicos Unidad III DIAGRAMASDocumento21 páginasCerámicos Unidad III DIAGRAMASTino ZavalaAún no hay calificaciones
- Introduccion Ciencia Ingenieria Materiales CallisterDocumento11 páginasIntroduccion Ciencia Ingenieria Materiales CallisterJulian DiazAún no hay calificaciones
- Guia Energia FisicaDocumento5 páginasGuia Energia FisicaNicolasDonosoLopezAún no hay calificaciones
- Apuntes de Reiki PDFDocumento15 páginasApuntes de Reiki PDFjatubio0% (1)
- El ÁtomoDocumento2 páginasEl ÁtomoAlex Ronaldy Araujo Gonzales100% (1)
- 5) El Contactor (Ok) PDFDocumento24 páginas5) El Contactor (Ok) PDFmvadamuzAún no hay calificaciones
- Electricidad BasicaDocumento15 páginasElectricidad BasicaIcaro.RedwarriorAún no hay calificaciones
- Taller de Fisica de Noveno Periodo IIDocumento1 páginaTaller de Fisica de Noveno Periodo IIBreidys FortichAún no hay calificaciones
- Proyecto Final de CAF2Documento22 páginasProyecto Final de CAF2NadelAún no hay calificaciones
- Plano Inclinado de Galileo FIZ112 UCDocumento7 páginasPlano Inclinado de Galileo FIZ112 UCSandra Lorena Tovar NavarreteAún no hay calificaciones
- FormaDocumento4 páginasFormabenja heatsAún no hay calificaciones
- Fisica Agujeros NegrosDocumento3 páginasFisica Agujeros NegrosIVANNA GISEL NAAún no hay calificaciones
- Fisica Recreativa Libro 2 - Jakov Perelman PDFDocumento213 páginasFisica Recreativa Libro 2 - Jakov Perelman PDFJoseph LainoAún no hay calificaciones
- Examen Diagnóstico Solución ElectromagnetismoDocumento8 páginasExamen Diagnóstico Solución ElectromagnetismoRich MgAún no hay calificaciones
- Diseño de Estucturas Metalicas Aplicando SAP2000-Parte 1Documento16 páginasDiseño de Estucturas Metalicas Aplicando SAP2000-Parte 1dgd3640% (5)
- Pendulo BalisticoDocumento5 páginasPendulo BalisticoRichiboys CLAún no hay calificaciones
- Modelamiento de Maquinas SincronasDocumento45 páginasModelamiento de Maquinas SincronasAndréVelazcoAún no hay calificaciones
- 01 IntroduccionDocumento29 páginas01 IntroduccionDarwinPgAún no hay calificaciones
- Guía de Laboratorio 3 - Caida LibreDocumento8 páginasGuía de Laboratorio 3 - Caida Libremiguel angel BRAVO QUILCAAún no hay calificaciones
- T2.2 No Linealidades y Linealización1213Documento31 páginasT2.2 No Linealidades y Linealización1213teresa alvarez alvarezAún no hay calificaciones
- Orihuela Orihuela Ronaldo (Solucionario de La Tercera Evaluacion de Masa I)Documento5 páginasOrihuela Orihuela Ronaldo (Solucionario de La Tercera Evaluacion de Masa I)Ronaldo OrihuelaAún no hay calificaciones
- Ley de Krichhoff 2016Documento9 páginasLey de Krichhoff 2016Alejandra OviedoAún no hay calificaciones
- Cambio de FaseDocumento16 páginasCambio de Fasecursostang100% (3)
- Preinforme 03 - ReologíaDocumento5 páginasPreinforme 03 - ReologíaCristian Humberto Badillo AgredoAún no hay calificaciones
- Red de FlujoDocumento10 páginasRed de FlujoUriel HernandezAún no hay calificaciones
- 02 Taller de Fisica PendulosDocumento5 páginas02 Taller de Fisica PendulosJAIME USECHAún no hay calificaciones
- Propiedades de La MateriaDocumento4 páginasPropiedades de La MateriaWILSON GÓMEZ100% (1)
- Arboles y EjesDocumento142 páginasArboles y EjesChristian Fernando Puma PilamungaAún no hay calificaciones