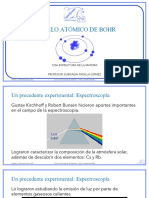
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Modelo atómico de Bohr y sus principios
Cargado por
Raul Martinez0 calificaciones0% encontró este documento útil (0 votos)
216 vistas5 páginasEl modelo atómico de Bohr propuso que los electrones orbitan alrededor del núcleo en órbitas circulares permitidas con energías específicas. Los electrones solo pueden ganar o perder energía al saltar entre estas órbitas, absorbiendo o emitiendo radiación. Este modelo resolvió problemas en el modelo de Rutherford y explicó las líneas espectrales atómicas.
Descripción original:
Título original
Modelos de Bohr y Lewis
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PPTX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl modelo atómico de Bohr propuso que los electrones orbitan alrededor del núcleo en órbitas circulares permitidas con energías específicas. Los electrones solo pueden ganar o perder energía al saltar entre estas órbitas, absorbiendo o emitiendo radiación. Este modelo resolvió problemas en el modelo de Rutherford y explicó las líneas espectrales atómicas.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
216 vistas5 páginasModelo atómico de Bohr y sus principios
Cargado por
Raul MartinezEl modelo atómico de Bohr propuso que los electrones orbitan alrededor del núcleo en órbitas circulares permitidas con energías específicas. Los electrones solo pueden ganar o perder energía al saltar entre estas órbitas, absorbiendo o emitiendo radiación. Este modelo resolvió problemas en el modelo de Rutherford y explicó las líneas espectrales atómicas.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
Modelo atómico de Bohr
En 1913, Niels Bohr desarrolló su modelo atómico de acuerdo a tres postulados
fundamentales:
Primer postulado
Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía.
Segundo postulado
Las únicas órbitas permitidas para un electrón son aquellas para las cuales el momento
angular, L, del electrón sea un múltiplo entero de h
Tercer postulado
El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En
dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre
ambos niveles.
Modelo atómico de Bohr
El modelo de Bohr resolvió las fallas que este encontró en el modelo de Rutherford
indicando que los electrones orbitan alrededor del núcleo pero en ciertas orbitas permitidas
con una energía específica proporcional a la constante de Planck. Estas órbitas definidas se
les refirió como niveles de energía. Estos niveles están etiquetados con el número cuántico
n (n = 1, 2, 3, etc.)
Este modelo de niveles de energía, significaba que los electrones solo pueden ganar o
perder energía saltando de una órbita permitida a otra y al ocurrir esto, absorbería o
emitiría radiación electromagnética en el proceso.
La configuración electrónica en este modelo se lleva a cabo en 9 niveles u orbitales, en el
primero tiene un máximo de 2 electrones, el segundo de 8, el tercero de 18, el cuarto y
quinto de 32, el sexto de 18 y el séptimo de 8
Principios básicos del modelo atómico de
Bohr.
Las partículas con carga positiva se encuentran en un volumen muy pequeño comparado
con el tamaño del átomo y contienen la mayor parte de la masa del átomo.
Los electrones con carga eléctrica negativa, giran alrededor del núcleo en órbitas circulares.
Los electrones orbitan el núcleo en órbitas que tienen un tamaño y energía establecidos. Por
lo tanto, no existen en un estado intermedio entre las órbitas.
La energía de la órbita está relacionada con su tamaño. La energía más baja se encuentra en
la órbita más pequeña. Cuanto más lejos esté el nivel de energía del núcleo, mayor será la
energía que tiene.
Los niveles de energía tienen diferentes números de electrones. Cuanto menor sea el nivel
de energía, menor será la cantidad de electrones que contenga, por ejemplo, el nivel 1
contiene hasta 2 electrones, el nivel 2 contiene hasta 8 electrones, y así sucesivamente.
La energía se absorbe o se emite cuando un electrón se mueve de una órbita a otra.
Modelo atómico de Lewis
En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce
por compartición de pares de electrones, mecanismo por el que cada uno individualmente
podría alcanzar ocho electrones en su capa más externa.
El fundamento de este principio hay que buscarlo en la denominada regla del octeto,
consecuencia del desarrollo del modelo de Bohr y del descubrimiento de los gases nobles,
sustancias de notable inercia química y ocho electrones en su capa de valencia. Para
alcanzar el octeto electrónico los átomos pueden compartir más de un par de electrones
(enlace simple), dando lugar a enlaces múltiples.
En este modelo atómico, los electrones de valencia se encuentran ubicados en los vértices
de un hipotético cubo, que representa el átomo en cuestión.
Según Lewis, los átomos pueden obtener configuración electrónica estable por
compartición de electrones. un átomo obtiene configuración estable de gas noble cuando
posee en su última capa 8 electrones.
Modelo atomico de Lewis
Para representar las moléculas mediante diagrama de Lewis, se debe presentar un
átomo central, en algunos casos el átomo central es el carbono debido a que es el
elemento más electropositivo, luego este queda rodeado por los demás átomos que
constituyen la molécula. En moléculas compuestas por varios átomos de un
mismo elemento y un átomo de otro elemento distinto, este último se utiliza como
el átomo central, lo cual se representa en el diagrama con 4 átomos de hidrógeno
y uno de silicio. El átomo central en lo posible debe ser el menos electronegativo
y el hidrógeno siempre será un átomo terminal.
El número total de electrones representados en un diagrama de Lewis es igual a la
suma de los electrones de valencia de cada átomo.
También podría gustarte
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Modelo Atómico de BohrDocumento10 páginasModelo Atómico de BohrEmmanuel Tandaypán Farfán0% (1)
- La Estructura de LewisDocumento27 páginasLa Estructura de Lewiskris cogly0% (1)
- Modelos AtómicosDocumento6 páginasModelos Atómicosmatuteoll06Aún no hay calificaciones
- Quimica Modelo Atomico de BohrDocumento3 páginasQuimica Modelo Atomico de BohrEduardo LesseyAún no hay calificaciones
- Examen Átomo y EnlaceDocumento11 páginasExamen Átomo y EnlaceNaroa RguezAún no hay calificaciones
- Modelo AtomicoDocumento6 páginasModelo AtomicoKatia NinaAún no hay calificaciones
- Quimica 1.Documento28 páginasQuimica 1.Miguel ACOSTAAún no hay calificaciones
- Modelo Atómico de BohrDocumento8 páginasModelo Atómico de BohrwillAún no hay calificaciones
- Modelo Atomico ActualDocumento6 páginasModelo Atomico ActualDiegoAún no hay calificaciones
- Principios Básicos Del Modelo Atómico de BohrDocumento2 páginasPrincipios Básicos Del Modelo Atómico de BohrAle RodríguezAún no hay calificaciones
- El Modelo Atómico de Demócrito Tiene Los Siguiente EnunciadosDocumento10 páginasEl Modelo Atómico de Demócrito Tiene Los Siguiente EnunciadosNashely PereyraAún no hay calificaciones
- Modelo Atomico de BohrDocumento6 páginasModelo Atomico de BohrLuis AraujoAún no hay calificaciones
- Tarea de QumicaDocumento5 páginasTarea de QumicaAneudis JavierAún no hay calificaciones
- Estructura Atómica, Tabla Periódica y Enlace QuímicoDocumento12 páginasEstructura Atómica, Tabla Periódica y Enlace QuímicoCamiloAún no hay calificaciones
- DocumentoDocumento5 páginasDocumentoDaniela FabregasAún no hay calificaciones
- Modelo AtómicoDocumento13 páginasModelo Atómicojavi jimenezAún no hay calificaciones
- Modelo Atomico de BohrDocumento14 páginasModelo Atomico de BohrJackson RamirezAún no hay calificaciones
- Modelos AtómicosDocumento17 páginasModelos AtómicosElizabeth Flores OropezaAún no hay calificaciones
- Modelos AtomicosDocumento4 páginasModelos AtomicosLissette Espinoza MoralesAún no hay calificaciones
- Modelos AtómicosssDocumento6 páginasModelos Atómicosssedhit82coriaAún no hay calificaciones
- Tarea de QuimicaDocumento3 páginasTarea de Quimicafrancisco javierAún no hay calificaciones
- M AtomicosDocumento6 páginasM AtomicosKarla perezAún no hay calificaciones
- Modelo Atomico de BohrDocumento15 páginasModelo Atomico de BohrAlexander MoranAún no hay calificaciones
- Quimica DuvanDocumento9 páginasQuimica DuvanDiego BoadaAún no hay calificaciones
- Unidades 3 y 4Documento7 páginasUnidades 3 y 4elainydelacruzAún no hay calificaciones
- Modelos atómicos y estructura del átomoDocumento6 páginasModelos atómicos y estructura del átomoAinhoa BernardoAún no hay calificaciones
- Guía de QuímicaDocumento4 páginasGuía de QuímicaSara Elisa Arenas VázquezAún no hay calificaciones
- Estructura Atómica 2Documento29 páginasEstructura Atómica 2u20231212683Aún no hay calificaciones
- Estructura y Propiedades Quimica OrganicaDocumento45 páginasEstructura y Propiedades Quimica Organicahevelu100% (2)
- Teorias AtómicaDocumento22 páginasTeorias AtómicaAngela EspañaAún no hay calificaciones
- Estructura atómica: electrones, núcleo y números cuánticosDocumento87 páginasEstructura atómica: electrones, núcleo y números cuánticosluis sandovalAún no hay calificaciones
- Química Orgánica Facultad de Ciencias UNIANDESDocumento86 páginasQuímica Orgánica Facultad de Ciencias UNIANDESMelissa Rincon GalvizAún no hay calificaciones
- Estructura AtomicaDocumento30 páginasEstructura Atomicaanya gascaAún no hay calificaciones
- Antecedentes Del Modelo Atomico ActualDocumento7 páginasAntecedentes Del Modelo Atomico Actualroberto ferneliAún no hay calificaciones
- Estructura Del Átomo ModernoDocumento8 páginasEstructura Del Átomo Modernoarnaldo simon sirpa laricoAún no hay calificaciones
- Tema 0. Conocimientos de Química.Documento10 páginasTema 0. Conocimientos de Química.Natalia Milla LopezAún no hay calificaciones
- Teorías atómicas: postulados claveDocumento16 páginasTeorías atómicas: postulados claveLuis HernandezAún no hay calificaciones
- Modelos atómicos: Dalton, Thomson, Rutherford y BohrDocumento6 páginasModelos atómicos: Dalton, Thomson, Rutherford y BohrKarla perezAún no hay calificaciones
- Química básica: Estructura atómica y estado sólidoDocumento116 páginasQuímica básica: Estructura atómica y estado sólidoGarcia Saldaña Brayan AdolfoAún no hay calificaciones
- Modelos AtomicosDocumento4 páginasModelos Atomicosalansalas34erAún no hay calificaciones
- El At0m0 y Su Estructura IDocumento7 páginasEl At0m0 y Su Estructura IMichaeljoel MoqueteAún no hay calificaciones
- Tema 3. Teorias AtomicasDocumento46 páginasTema 3. Teorias AtomicasRubianoIchoAún no hay calificaciones
- Guia Quimica Organica 1Documento21 páginasGuia Quimica Organica 1Luis CamposAún no hay calificaciones
- Presentacion 2.3Documento4 páginasPresentacion 2.3jdavidmedina11Aún no hay calificaciones
- A.A. 1Documento5 páginasA.A. 1cahnel00003984Aún no hay calificaciones
- Tema 7 y 8 Apuntes Fyq4eso Estructura de La Materia y Tabla PeriodicaDocumento9 páginasTema 7 y 8 Apuntes Fyq4eso Estructura de La Materia y Tabla PeriodicajarodrigueztemblecoAún no hay calificaciones
- Quimica Colegio Peña 3° Año Unidad 1Documento10 páginasQuimica Colegio Peña 3° Año Unidad 1Sofia LandoniAún no hay calificaciones
- Distribución ElectrónicaDocumento7 páginasDistribución ElectrónicaWïllïåm Bg MeLkkAún no hay calificaciones
- Teorias Atómicas 2021Documento73 páginasTeorias Atómicas 2021EDUCAMOS BarillasAún no hay calificaciones
- Expo FisicaDocumento2 páginasExpo FisicaNicolas GarciaAún no hay calificaciones
- Trabajo de Quimica NAIRYNDocumento7 páginasTrabajo de Quimica NAIRYNclub de esgrima monagasAún no hay calificaciones
- Química Iacc Control2Documento6 páginasQuímica Iacc Control2Anonymous z6n6OfcpAún no hay calificaciones
- Atomo CuanticoDocumento9 páginasAtomo CuanticoVilchis Granados Axel MaximilianoAún no hay calificaciones
- Modelo AtómicoDocumento25 páginasModelo AtómicoDAnielAún no hay calificaciones
- El ÁtomoDocumento5 páginasEl ÁtomoRicardo Celita Nuestra BodaAún no hay calificaciones
- Modelos atómicos 3o ESODocumento3 páginasModelos atómicos 3o ESODiegoAún no hay calificaciones
- Modelo Atómico Señalado Con Sus Partes de de Thomson y RutherfordDocumento9 páginasModelo Atómico Señalado Con Sus Partes de de Thomson y RutherfordCesar Simanca MartinezAún no hay calificaciones
- La Estructura Atómica. DefinitivoDocumento18 páginasLa Estructura Atómica. DefinitivoPedro FigueroaAún no hay calificaciones
- Reporte 4Documento2 páginasReporte 4Raul MartinezAún no hay calificaciones
- Procedimieto Reporte #4Documento2 páginasProcedimieto Reporte #4Raul MartinezAún no hay calificaciones
- Procedimieto Reporte #1Documento2 páginasProcedimieto Reporte #1Raul MartinezAún no hay calificaciones
- Reporte 8Documento4 páginasReporte 8Raul MartinezAún no hay calificaciones
- Procedimieto Reporte #3Documento2 páginasProcedimieto Reporte #3Raul MartinezAún no hay calificaciones
- Materiales y reactivos para determinar puntos de fusiónDocumento2 páginasMateriales y reactivos para determinar puntos de fusiónRaul MartinezAún no hay calificaciones
- Ejemplo de EspectrofotometriaDocumento3 páginasEjemplo de EspectrofotometriaRaul MartinezAún no hay calificaciones
- Reporte 3 1Documento7 páginasReporte 3 1Raul MartinezAún no hay calificaciones
- Reporte de Laboratorio5 - Equipo2Documento5 páginasReporte de Laboratorio5 - Equipo2Raul MartinezAún no hay calificaciones
- Reporte 4 Avance Discusiones..Documento5 páginasReporte 4 Avance Discusiones..Raul MartinezAún no hay calificaciones
- Reporte 3 1Documento7 páginasReporte 3 1Raul MartinezAún no hay calificaciones
- Reporte de Laboratorio - 1 Practica - Equipo - 2Documento5 páginasReporte de Laboratorio - 1 Practica - Equipo - 2Raul MartinezAún no hay calificaciones
- Absorción Atómica ConclusiónDocumento1 páginaAbsorción Atómica ConclusiónRaul MartinezAún no hay calificaciones
- Corrosión Del AceroDocumento1 páginaCorrosión Del AceroRaul MartinezAún no hay calificaciones
- Ley General para La Prevención y Gestión General de Los ResiduosDocumento1 páginaLey General para La Prevención y Gestión General de Los ResiduosRaul MartinezAún no hay calificaciones
- Descubrimientos Edad MediaDocumento1 páginaDescubrimientos Edad MediaRaul MartinezAún no hay calificaciones
- Problemas AmbientalesDocumento2 páginasProblemas AmbientalesRaul MartinezAún no hay calificaciones
- Actividad Tutorias 1Documento2 páginasActividad Tutorias 1Raul MartinezAún no hay calificaciones
- Ética, moral y religión según Emilio Martínez NavarroDocumento5 páginasÉtica, moral y religión según Emilio Martínez NavarroRaul MartinezAún no hay calificaciones
- Tratamiento y representación gráfica de datos experimentalesDocumento106 páginasTratamiento y representación gráfica de datos experimentalesRaul MartinezAún no hay calificaciones
- Deber 1 Quimica UpsDocumento4 páginasDeber 1 Quimica UpsPaola Alejandra GuerreroAún no hay calificaciones
- Cruz Garritz Amp Chamizo Estructura Atomica Un Enfoque Quimico PDFDocumento824 páginasCruz Garritz Amp Chamizo Estructura Atomica Un Enfoque Quimico PDFLucia Díaz100% (1)
- Segundo PARCIAL QUIMICA 4º A SoluciónDocumento4 páginasSegundo PARCIAL QUIMICA 4º A SoluciónCristina PandoAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosOrlando Rangel RomeroAún no hay calificaciones
- Modelos atómicos evoluciónDocumento19 páginasModelos atómicos evoluciónMaga BridAún no hay calificaciones
- Quimica 222Documento15 páginasQuimica 222Alexander Cubi BoniAún no hay calificaciones
- ACTIVIDADES DE C3 2o TRIMDocumento26 páginasACTIVIDADES DE C3 2o TRIMLety SilvaAún no hay calificaciones
- Estructura atómica: modelos atómicos y radiación electromagnéticaDocumento21 páginasEstructura atómica: modelos atómicos y radiación electromagnéticaNievesAún no hay calificaciones
- ModelosDocumento42 páginasModelosBriam Arnold Estrella RojasAún no hay calificaciones
- El Átomo Resumen III ExamenDocumento6 páginasEl Átomo Resumen III ExamenSofi ArayaAún no hay calificaciones
- Física para Ingeniería: Introducción a la Física ModernaDocumento42 páginasFísica para Ingeniería: Introducción a la Física ModernaOSMAN JAVIER GUILLERMO MAYAún no hay calificaciones
- Proyecto 2Documento10 páginasProyecto 2Maryale VazquezAún no hay calificaciones
- Actividad de Aprendizaje 2 Fase 1 PDFDocumento9 páginasActividad de Aprendizaje 2 Fase 1 PDFBetty Johanna Pinargote BravoAún no hay calificaciones
- Modelo AtomicoDocumento19 páginasModelo AtomicoEISTEINAún no hay calificaciones
- 01 Antologia Unidad 1 IgeDocumento25 páginas01 Antologia Unidad 1 IgeDaniel OrtaAún no hay calificaciones
- Fisica Nuclear Problemas ResueltosDocumento166 páginasFisica Nuclear Problemas ResueltosOsmar RG100% (6)
- Evolucion Modelo AtomicoDocumento5 páginasEvolucion Modelo AtomicoAzInes02Aún no hay calificaciones
- Notas Modelo BohrDocumento3 páginasNotas Modelo BohrEleazar NAún no hay calificaciones
- Guia Nº1 - Periodo 3 - Quim - 7º - 2021Documento7 páginasGuia Nº1 - Periodo 3 - Quim - 7º - 2021Deiber Manuel Argumedo RamosAún no hay calificaciones
- Mapa Consetual Sobre Las Teorias AtomicasDocumento1 páginaMapa Consetual Sobre Las Teorias Atomicasdavid100% (3)
- Anexo - Propiedades del CarbonoDocumento36 páginasAnexo - Propiedades del Carbonoyenny valenciaAún no hay calificaciones
- Tema 1Documento10 páginasTema 1maria reverteAún no hay calificaciones
- Movimiento Circular UniformeDocumento39 páginasMovimiento Circular UniformeClaudia AcevedoAún no hay calificaciones
- Modelo atómico actualDocumento14 páginasModelo atómico actualFáti BarrionuevoAún no hay calificaciones
- Análisis de química clínicaDocumento191 páginasAnálisis de química clínicaCamila Dini0% (1)
- Teoria CuanticaDocumento68 páginasTeoria CuanticaMariel BazánAún no hay calificaciones
- Em - Modelo Atómico de BohrDocumento21 páginasEm - Modelo Atómico de BohrJuan Emilio Canales FigueroaAún no hay calificaciones
- Química CuánticaDocumento247 páginasQuímica CuánticaCarmen SonccoAún no hay calificaciones
- CH38-La Fisica Moderna y El AtomoDocumento14 páginasCH38-La Fisica Moderna y El AtomoHemerson LópezAún no hay calificaciones
- Ciencia y Tecnologia-3b - Sandoval Avila - Lesly AnaitDocumento4 páginasCiencia y Tecnologia-3b - Sandoval Avila - Lesly AnaitLesly Anait Sandoval AvilaAún no hay calificaciones