Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Formulario Termodinámica
Formulario Termodinámica
Cargado por
Maximiliano RamosTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Formulario Termodinámica
Formulario Termodinámica
Cargado por
Maximiliano RamosCopyright:
Formatos disponibles
Formulario Termodinámica 1 UdeC
Fuerza Presión Hidrostá2ca Trabajo Cap. Calorífica Calor
!" %⃗ ( (+) 𝑁 = 1,2,3
𝐹⃗ = $ !#⃗ % 𝑃=& Δ𝑃 = 𝜌𝑔ℎ 𝑑𝑊 = 𝐹𝑑𝑥 = −𝑃𝑑𝑉 𝐶' = ) 𝑅 𝐶* = 𝑅 𝑑𝑄 = 𝑛𝐶'/* 𝑑𝑇
)
𝑓 = 3,5,7
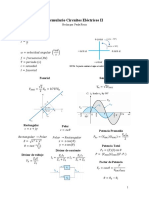
Potencial Resorte Potencial Altura Ciné2ca
Fuerza 𝐹 = 𝐾𝐿 𝐹 = 𝑚𝑔
Energía 𝑑𝐸* = 𝐾𝐿𝑑𝐿 𝑑𝐸* = 𝑚𝑔𝑑ℎ 𝑑𝐸- = 𝑚𝑣𝑑𝑣
1era Ley 2ª Ley
!.
Sist. Cerrado 𝑑𝑈 = 𝑑𝑄 + 𝑑𝑊 𝑑𝑆 =
/
+ 𝑑𝑆012
4
!3 !78 .̇
Sist. Abierto F6 + 𝑛̇ 1 𝑈
+ 𝑛̇ 6 𝑈 F1 = 𝑄̇ + 𝑊̇ + 𝑛̇ 6 𝑆G6 + 𝑛̇ 1 𝑆G1 = / + 𝑆012
̇ (puede ser 𝑛 o 𝑚)
!5 !5
F = 𝐶' 𝑑𝑇
𝑑𝑈 𝑑𝑆G = 𝐶* 𝑑𝑙𝑛𝑇 − 𝑅 𝑑𝑙𝑛𝑃
Para Gas Ideal
F = 𝑑𝑈
𝑑𝐻 F + 𝑃𝑉 = 𝐶* 𝑑𝑇
Media Entálpica Media Entrópica 𝑻𝒎 𝒚 𝑻𝒎𝒍
:! : @ :! @ /" +/# / +/
Cp 〈 〉<= = 𝐴 + 𝐵𝑇< + (4𝑇<) − 𝑇? 𝑇) ) + / / 〈 〉<7 = 𝐴 + 𝐵𝑇< + 𝑇< 𝑇<A (𝐶) + 𝑇< = " #
; 𝑇<A = DE (/
; > " # ; (/ / )# " # ) // )
" #
Expresión Z Parámetros
Gas Ideal 𝑃𝑉R = 𝑅𝑇 1 --
? K$%" L
𝑍 = 1 + 𝐵)G 𝑃 + 𝐵>G 𝑃) + ⋯ 𝐵-G = (HI?)! + $KM$%" % + ⋯ (Berlin)
Gas Virial 𝑃𝑉R = 𝑍𝑅𝑇
? K$%" L
𝑍 = 1 + 𝐵) 𝜌 + 𝐵> 𝜌) + ⋯ 𝐵- = (HI?)! + $KN$%"% + ⋯ (Leiden)
O O& IO## O' I>O# O& +)O##
Conversiones virial 𝐵)G = ;/# 𝐵>G = (;/)#
𝐵PG = (;/)&
; /Q
𝐵) = (𝐵R + 𝑤 𝐵? ) 𝐵- = 𝑏-I? + 𝑄-
U V $%#
MQ
B por R.P))
;/
𝐵R = 0.083 − /# ".) B por EoS * $%"
?IW*#X
Abbot y van Ness R.?T) 𝑄- = (−1)-I? 𝑐?-I) "
*
𝐵? = 0.139 − ?I #
*"
/# '.#
Expresión Original Expresión Desarrollada
;/ U
𝑃= 4IV
Y
− (Y4+Q 4 +Q# V)
" V)(Y
(; /* )# 𝑃𝑉R > + [(𝑐? + 𝑐) − 1)𝑃𝑏 − 𝑅𝑇]𝑉R ) + [𝑐? 𝑐) 𝑃𝑏) − (𝑐? + 𝑐) )(𝑃𝑏) +
𝑎 = ΩU 𝛼
M* 𝑅𝑇𝑏) + 𝑎]𝑉R − 𝑏[𝑐? 𝑐) (𝑃𝑏) + 𝑏𝑅𝑇) + 𝑎] = 0
; /*
Eos Cúbica 𝑏 = ΩV
M*
M M
𝐴= 𝑎 (;/)# = ΩU /+# 𝛼
+ 𝑍 > + [(𝑐? + 𝑐) − 1)𝐵 − 1]𝑍 ) + [𝑐? 𝑐) 𝐵) − (𝑐? + 𝑐) )(𝐵) + 𝐵) + 𝐴]𝑍 −
M
𝐵 = 𝑏 ;/ = ΩV /
M+ 𝐵[𝑐? 𝑐) (𝐵) + 𝐵) + 𝐴] = 0
+
Si 𝒄𝟏 = 𝒄𝟐 = 𝟎 Si 𝒄𝟏 𝒐 𝒄𝟐 ≠ 𝟎
F#
𝐻 𝐴 𝑑𝑙𝑛 𝑎 F#
𝐻 𝐴 𝑑𝑙𝑛 𝑎 𝑍 + 𝑐? 𝐵
Entalpía = 𝑍 − 1 − a1 − 𝑇 b =𝑍−1− a1 − 𝑇 b ln a b
𝑅𝑇 𝑍 𝑑𝑇 𝑅𝑇 𝐵(𝑐? − 𝑐) ) 𝑑𝑇 𝑍 + 𝑐) 𝐵
𝑆G# 𝐴 𝑑𝑙𝑛 𝑎 𝑆G# 𝐴 𝑑𝑙𝑛 𝑎 𝑍 + 𝑐? 𝐵
Entropía = ln(𝑍 − 𝐵) + 𝑇 a b = ln(𝑍 − 𝐵) + 𝑇a b ln a b
𝑅 𝑍 𝑑𝑇 𝑅 𝐵(𝑐? − 𝑐) ) 𝑑𝑇 𝑍 + 𝑐) 𝐵
Algoritmo de Cardan, resolución de: 𝒂𝟑 𝒙𝟑 + 𝒂𝟐 𝒙𝟐 + 𝒂𝟏 𝒙 + 𝒂𝟎 = 𝟎
1) Normalizar Coeffs: 2) Calcular: 3) Calcular:
3
𝑎′Z = 𝑎Z /𝑎> 𝑝 = 𝑎′) /3; 𝑞 = 𝑎′? /3; 𝑟 = 𝑎′R /2 𝛾 = 𝑞 − 𝑝) ; 𝛽 = 𝑝> − 𝑝𝑞 + 𝑟; Δ = 𝛽) + 𝛾 >
2
⎡\]^^_`a %, b ⎤
⎛⎢ -%.& )c ⎥ ⎞ Id
Δ ≤ 0 → 3 raíces 𝑥[ = 2√−𝛾 cos ⎜⎢ >
− (𝑖 − 1) > ⎥ − 𝑝⎟ con arccos a &b en rad y 𝑖 = 1, 2 𝑜 3
eIf
⎢ ⎥
⎝⎣ ⎦ ⎠
Δ > 0 → 1 raíz 𝑥 = 𝑚?/> + 𝑛?/> − 𝑝 con 𝑚 = −𝛽 + √Δ y 𝑛 = −𝛽 − √Δ
𝛀 𝛀∗𝒋
Áreas de Maxwell: 𝑷𝒔𝒂𝒕 𝒋 𝒔𝒂𝒕
𝒋+𝟏 = 𝑷𝒋 − (𝒅𝛀 /𝒅𝑷 ) o 𝑷𝒋+𝟏 = 𝑷𝒋 − ∗
(𝒅𝛀𝒋 /𝒅𝑷𝒋 )
iterar hasta Psat constante.
𝒋 𝒋
Si 𝒄𝟏 = 𝒄𝟐 = 𝟎 Si 𝒄𝟏 𝒐 𝒄𝟐 ≠ 𝟎
Y IV U 4 ? ? !o Y IV 4 U (Y +Q V)(Y +Q V) 4 4
Ω = 𝑃‚𝑉R' − 𝑉RA ƒ − 𝑅𝑇𝑙𝑛 $Y41IV% − ;/ $Y4 − Y4 % = 𝑉R' − 𝑉RA Ω = 𝑃‚𝑉R' − 𝑉RA ƒ − 𝑅𝑇𝑙𝑛 $Y41IV % + V(Q IQ ) ln $(Y41+Q#V)(Y42+Q"V)%
2 1 2 !M 2 " # 1 " 2 #
L IO ? ? !o∗ L1 IL2 L IO & L +Q O)(L +Q O)
Ω∗ = (𝑍' − 𝑍A ) − 𝑙𝑛 $ L1IO % − 𝐴 $L − L % = Ω∗ = (𝑍' − 𝑍A ) − 𝑙𝑛 $ L1IO % + O(Q ln $(L1 +Q# O)(L2 +Q" O)%
2 1 2 !M M 2 " IQ#) 1 " 2 #
6 6 #
M+345 U+Qq r+1q r
7+ 7+
ln $ /+
%= 6 6 # 6 &
?+Vq r+!q r +(q r
7+ 7+ 7+
Ec. Antoine (mmHg;K) Ec. Clappeyron Correlación Watson Ec. Riedel Ec. Rackeb
𝐵 𝑑𝑃 F
𝑑𝐻 ?I/
R.>s 4:
∆= ?.Ru)(A2M* I?.R?>) #
ln(𝑃) = 𝐴 − = ∆𝐻(𝑇) = ∆𝐻R a?I/ + b = FA 6U5 = 𝑉Q 𝑍Q(?I/+);
𝑉
𝑇+𝐶 𝑑𝑇 𝑇Δ𝑉R +,9 ;/: R.u>RI/+,:
v1 4 Iw
w 42 4
(?Ix)Y Y
Propiedades en ELV F = Ψ' 𝑀
𝑀 F' + ΨA 𝑀
FA Ψ' = v = 1 − ΨA = w4 42
2
para cilindros Ψ' = (?Ix)Y4 +xY4
2
𝜙 = Y +Y
1 +v2 1 Iw 2 1 2 1
𝑊̇ 𝑄̇(
Eficiencia ciclo potencia 𝜂= COP 𝐶𝑂𝑃 =
𝑄̇ 𝑄̇( + 𝑄̇Q
Cambios de unidades
P= 1 atm 1.01325 bar 101325 Pa 760 Torr 14.7 Psi
R= 8.314 Pa m3/mol K 0.0820 bar L /mol K 1.987 cal/mol K
U/H/E = 1 Kcal 4.184 KJ
N= 1 mol 6.023 x 1023 molec
T= 0 °C 273.15 K
Formulario asignatura termodinámica 1 Prof. Gerard Alonso
También podría gustarte
- Actividad 4.3 - Procesos TermodinámicosDocumento9 páginasActividad 4.3 - Procesos TermodinámicosÁngel Ayala GonzalezAún no hay calificaciones
- Modelo Del Gas Ideal - FisicoquímicaDocumento12 páginasModelo Del Gas Ideal - FisicoquímicaIngrid Alejandra Magdaleno Chávez100% (1)
- Teorias de FallasDocumento5 páginasTeorias de FallasLUIS ANTONIO MARTINEZ REYESAún no hay calificaciones
- 1 C2 6 Circuitos CC 6Documento4 páginas1 C2 6 Circuitos CC 6Yadira Callisaya QuispeAún no hay calificaciones
- Presentación HelmholtzDocumento26 páginasPresentación HelmholtzDani PerezAún no hay calificaciones
- Iiº Matematica - Retroalimentacion Guia Nº7 y Guia Nº8 - 25 Al 29 MayoDocumento7 páginasIiº Matematica - Retroalimentacion Guia Nº7 y Guia Nº8 - 25 Al 29 MayoJackson VivasAún no hay calificaciones
- Formulario Correlación de Aziz & Fogarasi para Tubería VerticalDocumento1 páginaFormulario Correlación de Aziz & Fogarasi para Tubería VerticalMaría Fernanda RosalesAún no hay calificaciones
- Taller 5Documento5 páginasTaller 5Juan David Yara CruzAún no hay calificaciones
- Formulario Circuitos Eléctricos IIDocumento5 páginasFormulario Circuitos Eléctricos IIjasic martinezAún no hay calificaciones
- H°A°2 - Introducción (Zapata Combinada Rectangular Con Presiones Uniformes)Documento10 páginasH°A°2 - Introducción (Zapata Combinada Rectangular Con Presiones Uniformes)cristhian baltazar cruzAún no hay calificaciones
- 1 C5 1 Pot. Electrica 1Documento4 páginas1 C5 1 Pot. Electrica 1Angel VillavisencioAún no hay calificaciones
- 1 C2 4 Circuitos CC 4Documento4 páginas1 C2 4 Circuitos CC 4Yadira Callisaya QuispeAún no hay calificaciones
- Temario 2da Retrasada Hidráulica 2do Sem 2023Documento2 páginasTemario 2da Retrasada Hidráulica 2do Sem 2023yoselin luchAún no hay calificaciones
- 3M C4 2 F.M.M. 2Documento5 páginas3M C4 2 F.M.M. 2LUISAún no hay calificaciones
- Demandas Optima de Consumo Marshallianas y Compensadas. ExposicionDocumento6 páginasDemandas Optima de Consumo Marshallianas y Compensadas. ExposicionMarlene Santiana MirabaAún no hay calificaciones
- EXAMEN PARCIAL DE CONCRETO ARMADO I-OkDocumento16 páginasEXAMEN PARCIAL DE CONCRETO ARMADO I-OkCristianHerbasPillacaAún no hay calificaciones
- U4 Simonetti y Niño. Introd. Al Anál. Cuant. en Cs Soc. Cap. 3.Documento14 páginasU4 Simonetti y Niño. Introd. Al Anál. Cuant. en Cs Soc. Cap. 3.Lucía MelAún no hay calificaciones
- Guia Nº1 Integrales TrigonometricasDocumento2 páginasGuia Nº1 Integrales TrigonometricasRozasReyesGermánAún no hay calificaciones
- Presentación Unidad II Física IVDocumento19 páginasPresentación Unidad II Física IVChristian CabralAún no hay calificaciones
- Geo$sica General - GF3001 Clase #1: Semestre OTOÑO 2023Documento40 páginasGeo$sica General - GF3001 Clase #1: Semestre OTOÑO 2023Diego Ignacio Gonzalez FloresAún no hay calificaciones
- Condensacion PDFDocumento21 páginasCondensacion PDFKenia ManzanoAún no hay calificaciones
- VASCONEZ - GR8 - 2022A - Formas de Expresar ConcentraciónDocumento2 páginasVASCONEZ - GR8 - 2022A - Formas de Expresar ConcentraciónNicolas Vasconez TorresAún no hay calificaciones
- FORMULARIO VIOLETA LOPEZ DefinitivoDocumento2 páginasFORMULARIO VIOLETA LOPEZ DefinitivoVioleta LopezAún no hay calificaciones
- H°A°2 - Introducción (Zapata Combinada Trapezoidal Con Presiones Uniformes)Documento12 páginasH°A°2 - Introducción (Zapata Combinada Trapezoidal Con Presiones Uniformes)cristhian baltazar cruzAún no hay calificaciones
- Formulario Hidraulica IIDocumento1 páginaFormulario Hidraulica IIVictoria MartinezAún no hay calificaciones
- Áreas y Volúmenes de Cuerpos en El Espacio 2Documento1 páginaÁreas y Volúmenes de Cuerpos en El Espacio 2Andy MejiaAún no hay calificaciones
- Losa Llena en Una Direccion FormularioDocumento7 páginasLosa Llena en Una Direccion Formulariocristhian baltazar cruzAún no hay calificaciones
- Guia de Gay LussacDocumento2 páginasGuia de Gay LussacGEILBEN GINO CCAHUA PALOMINOAún no hay calificaciones
- Principio de Arquímedes: Practica N°6Documento7 páginasPrincipio de Arquímedes: Practica N°6yohjan mirandaAún no hay calificaciones
- FoÌ Rmulas Contrastes de HipoÌ TesisDocumento3 páginasFoÌ Rmulas Contrastes de HipoÌ TesisAlberto HidalgoAún no hay calificaciones
- Lechuga 12Documento4 páginasLechuga 12Manu sorAún no hay calificaciones
- 3ra Clase. Razones y Proporciones PDFDocumento3 páginas3ra Clase. Razones y Proporciones PDFPilar GarciaAún no hay calificaciones
- Integración de Fucciones ParcialesDocumento14 páginasIntegración de Fucciones ParcialesNilber Jhony Terán DíazAún no hay calificaciones
- FORMULARIO Estadistica I (2022)Documento2 páginasFORMULARIO Estadistica I (2022)victorAún no hay calificaciones
- Formulario-Examen 202223Documento7 páginasFormulario-Examen 202223alvaro calvente villanuevaAún no hay calificaciones
- Guia de Gay LussacDocumento2 páginasGuia de Gay LussacgonzaloyllaqAún no hay calificaciones
- Hoja de Formulas Quimica CBC 164272 Downloable 1151881 1Documento7 páginasHoja de Formulas Quimica CBC 164272 Downloable 1151881 1malenaroldan2019Aún no hay calificaciones
- Capacidad Última de CargaDocumento2 páginasCapacidad Última de CargaAlexander J. Cesar UbaldoAún no hay calificaciones
- Modelo Keynesiano SimpleDocumento1 páginaModelo Keynesiano SimpleGonzalo TassanoAún no hay calificaciones
- Ejercicios de PrácticaDocumento4 páginasEjercicios de PrácticaHector VillalobosAún no hay calificaciones
- Resortes Helicoidales1Documento71 páginasResortes Helicoidales1Yilver SerranoAún no hay calificaciones
- El Modelo de Crecimiento Económico Harrod-DomarDocumento15 páginasEl Modelo de Crecimiento Económico Harrod-DomarAbiithz Priicess CoreAún no hay calificaciones
- 2023 - Tarea - 2 - Parcial - 1Documento8 páginas2023 - Tarea - 2 - Parcial - 1Josue HernandezAún no hay calificaciones
- SucesionesDocumento5 páginasSucesionesDiego VargasAún no hay calificaciones
- Cuadro CRL ElectriDocumento2 páginasCuadro CRL ElectriSinueAún no hay calificaciones
- Formulario FísicaDocumento3 páginasFormulario FísicaMichael EstradaAún no hay calificaciones
- Formulario FSQ I 2021BDocumento4 páginasFormulario FSQ I 2021BAlan PalaciosAún no hay calificaciones
- Convertidor Buck-Boost ModificadoDocumento2 páginasConvertidor Buck-Boost ModificadoNixon JaramilloAún no hay calificaciones
- Deber 13Documento3 páginasDeber 13Ammy YugchaAún no hay calificaciones
- Taller Algebra Actividad 10 22052020Documento10 páginasTaller Algebra Actividad 10 22052020Alejandro OrtegaAún no hay calificaciones
- GAyV1 UnidadVIII Solucionario8 1Documento3 páginasGAyV1 UnidadVIII Solucionario8 1Jazmin RoaAún no hay calificaciones
- Escala de GastosDocumento1 páginaEscala de GastosBrandon A CastilloAún no hay calificaciones
- Funciones Vectoriales de Variable Real Resumen1.1Documento3 páginasFunciones Vectoriales de Variable Real Resumen1.1JAMES ALDAHIR LOPEZ RODRIGUEZAún no hay calificaciones
- Losa Nervurada en Una Direccion FormularioDocumento9 páginasLosa Nervurada en Una Direccion Formulariocristhian baltazar cruzAún no hay calificaciones
- Semana - 1 ÁlgebraDocumento12 páginasSemana - 1 ÁlgebraLyco Ceykhann RamosAún no hay calificaciones
- S01.s2 - MaterialDocumento13 páginasS01.s2 - MaterialAilyn Carquin MendocillaAún no hay calificaciones
- Formulario Análisis CualitativoDocumento3 páginasFormulario Análisis CualitativoAnaAún no hay calificaciones
- Areas y Volumenes de Cuerppos en El EspacioDocumento1 páginaAreas y Volumenes de Cuerppos en El EspacioyaninaAún no hay calificaciones
- 1 C4 1 Ctos Trifasicos 1Documento4 páginas1 C4 1 Ctos Trifasicos 1brandonAún no hay calificaciones
- Gases IdealesDocumento8 páginasGases IdealesToaque Miranda DeysiAún no hay calificaciones
- Bloque I. Materiales U1 Estructura de Los Materiales para PDFDocumento42 páginasBloque I. Materiales U1 Estructura de Los Materiales para PDFAna VillenaAún no hay calificaciones
- TermodinamicaDocumento11 páginasTermodinamicaJender AlexanderAún no hay calificaciones
- Apuestas HandicapDocumento13 páginasApuestas HandicapRonald CoimbraAún no hay calificaciones
- Informe N°1 - Gases Ideale.Documento14 páginasInforme N°1 - Gases Ideale.Wilson Robert Alhuay LeonAún no hay calificaciones
- Laboratorio N1Documento13 páginasLaboratorio N1AlekatAún no hay calificaciones
- Unidad 01 Fisico QuimicaDocumento30 páginasUnidad 01 Fisico QuimicaJoan Huaman CastilloAún no hay calificaciones
- Clase 2.3. EdE - SeminarioDocumento10 páginasClase 2.3. EdE - SeminarioVale IturraAún no hay calificaciones
- Unidad 1 Bio MBR Nov 2023Documento86 páginasUnidad 1 Bio MBR Nov 2023meilicristin97Aún no hay calificaciones
- U6 Ejercicios Adicionales y RespuestasDocumento2 páginasU6 Ejercicios Adicionales y RespuestasTomás VillaAún no hay calificaciones
- Actividad 7 Quimica Jaime Nelson 12°HDocumento4 páginasActividad 7 Quimica Jaime Nelson 12°HLisi AlvarezAún no hay calificaciones
- Funciones-De-Particion 2 PDFDocumento16 páginasFunciones-De-Particion 2 PDFfredyzAún no hay calificaciones
- Fec 7 GidealcuanticoDocumento70 páginasFec 7 GidealcuanticoDaniela RodriguezAún no hay calificaciones
- El Estado Gaseoso - QUimica UTNDocumento14 páginasEl Estado Gaseoso - QUimica UTNMartin AbramowiczAún no hay calificaciones
- Hoy Laboratorio Gases Ideales FisicaDocumento7 páginasHoy Laboratorio Gases Ideales FisicaFermin CorderoAún no hay calificaciones
- Paradoja Del CumpleañosDocumento4 páginasParadoja Del CumpleañosKEVIN MEJIAAún no hay calificaciones
- 3er. Parcial - Proyecto Final Sem 3.2019 - ADocumento10 páginas3er. Parcial - Proyecto Final Sem 3.2019 - AFranciscoCamberoAún no hay calificaciones
- Tema 2 Profundizacion de QDocumento17 páginasTema 2 Profundizacion de Qesteban herreraAún no hay calificaciones
- Ley de GasesDocumento23 páginasLey de GasesEdward Cabrera GuizadoAún no hay calificaciones
- Guia de Ejercicios Sobre Gases - MarioGutierrez - 20191000748Documento10 páginasGuia de Ejercicios Sobre Gases - MarioGutierrez - 20191000748Raul MartinezAún no hay calificaciones
- Fase 2 Propiedades de Las Sustancias Puras A'22Documento23 páginasFase 2 Propiedades de Las Sustancias Puras A'22David TerceroAún no hay calificaciones
- Psem R45 01Documento8 páginasPsem R45 01Nelson DiazAún no hay calificaciones
- 3.gases Ideales, Reales y Mezcla de Gases IdealesDocumento14 páginas3.gases Ideales, Reales y Mezcla de Gases IdealesMagui SaitAún no hay calificaciones
- 4 GASES 1parte PDFDocumento14 páginas4 GASES 1parte PDFconiAún no hay calificaciones
- Guia de Problemas de Quimica General Unpsjb CR 13Documento8 páginasGuia de Problemas de Quimica General Unpsjb CR 13Nahuel YurquinaAún no hay calificaciones
- Práctica Clase N°3 y N°4 - GasesDocumento6 páginasPráctica Clase N°3 y N°4 - Gasesmaxifacultad20Aún no hay calificaciones
- Fisica Estadistica Unmsm 2023 IDocumento3 páginasFisica Estadistica Unmsm 2023 IVale ReyesAún no hay calificaciones
- Anexo 2.Documento5 páginasAnexo 2.Edna CardozoAún no hay calificaciones
- Laboratorio #3, Compresible - KG, LG, JC, SNDocumento8 páginasLaboratorio #3, Compresible - KG, LG, JC, SNleydis gonzalezAún no hay calificaciones
- Física II: Gases IdealesDocumento14 páginasFísica II: Gases IdealesRuben JuarezAún no hay calificaciones