Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Apuntes
Apuntes
Cargado por
elias ormeñoDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Apuntes
Apuntes
Cargado por
elias ormeñoCopyright:
Formatos disponibles
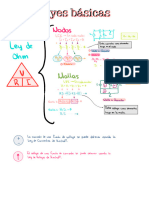
Obtener número de oxidación
Ej:H20 es una molécula neutra.
es decirla suma de los no debe ser O
2(1 ) 1) 2) 0
=
-
+ +
MOy
= IMnOyI
X
x 4) 2) 1
=
=
+ - -
x 7
=
(n.o del Mgl
POn [PO4]5
-
un
X x 4) 2) 3
= =
+ - -
x 0(n.0P)
=
Método del Ión-electrón
· se puede aplicar en medio ácido o básico.
reacción:BrOs
-
Ej:nos dan la +
I Br Iz
-
+
· notar que ya estáseparada en sus iones (paso 1)
2 Analizamos
-
los nos de oxidación.
BrOs +
I Br Iz
-
+
⑧A ⑪ ⑪ ⑳
3
Ajustamos las semiecuaciones (de los que variaron su n.Ox
I -> Iz
Br05 >Br
-
en medio ácido, por
Hacemos ajuste de masas:
Cada 0 se coloca
Un H20 Y POr
2I >Iz
⑧ Cada H un Ht
⑧
↑ Br05 6H >1Br
-
H20
+
Hacemos ajuste de cargas:
recibir
>debe ze-
2 I sIz +
ze(se oxidal
Br05 6H >Br
+
+
eH20.+ 6e (se reduce)
5 t -
1
4
Cancelamos e-
2 I < Iz 2e-
+
·3
Br05 6Ht >Br
+
8H20+ 6e-
6 I >eIz Ge
+
Br05 +6H+ >
Br-+3H20+Se
6I Br05 6H+ 3I2 Br 0H20 ecuacion balanceada
-
+ >
es la
+ + +
en medio ácido.
para llevarla A medio básico:
6I +
Br05 +bH+ >
312 + Br-+ PH20 /cancelamos HT, usando el
equilibrio del H20/. 6.
+
+
6 H20 >6 H 60H-
6I Br05 H+ 312 Br & H20
-
+ +
> + +
-6H
+
6 H20 6OH-
+
+
6I Br05+OH2O 3 Ic+Br+GOH es la ecuacion balanceada
en medio básico.
* Es más fácil balancear primero en medio ácido.
También podría gustarte
- Pauta Tarea 1Documento6 páginasPauta Tarea 1Gabriela AlvaradoAún no hay calificaciones
- Taller 1Documento8 páginasTaller 1ANNY ZURLEY DIOSSA CASTAÑEDAAún no hay calificaciones
- Compuestos Inorgánicos - Con ApuntesDocumento60 páginasCompuestos Inorgánicos - Con Apuntesleonoraballestera.2909Aún no hay calificaciones
- Ejercicio 1 PH QMDocumento2 páginasEjercicio 1 PH QMManu AlejandroAún no hay calificaciones
- Ficha 7 NomenclaturaDocumento27 páginasFicha 7 NomenclaturaINGRID SHOMARA VARGAS YUCAAún no hay calificaciones
- UntitledDocumento80 páginasUntitledjosejavierfdezAún no hay calificaciones
- Leyes BásicasDocumento1 páginaLeyes Básicasmario-200Aún no hay calificaciones
- Ficha 7 NomenclaturaDocumento27 páginasFicha 7 NomenclaturaCARLA LOUREN ALVAREZ ESCOBARAún no hay calificaciones
- Resumen Completo Mecánica de Máquinas - UC3MDocumento7 páginasResumen Completo Mecánica de Máquinas - UC3MCésar BarrioAún no hay calificaciones
- S11Documento5 páginasS11Veronica SibajaAún no hay calificaciones
- Q Jiaoi:) Ao 9 N O - 3 O - 4 O JlaoiDocumento2 páginasQ Jiaoi:) Ao 9 N O - 3 O - 4 O JlaoiROYER MATTHEW BONIFACIO JULIANAún no hay calificaciones
- Química IIDocumento12 páginasQuímica IILuis De LeonAún no hay calificaciones
- Ejercicio MuxDocumento2 páginasEjercicio MuxRodrigo MateosAún no hay calificaciones
- Teoria SeñalesDocumento3 páginasTeoria SeñalesJuan Esteban Salazar AlturoAún no hay calificaciones
- II BIM - QUIM - Guía #4 - Nomenclatura QuímicaDocumento6 páginasII BIM - QUIM - Guía #4 - Nomenclatura QuímicaomarAún no hay calificaciones
- Propuestas de Talleres PautasDocumento3 páginasPropuestas de Talleres Pautasclaudio duboAún no hay calificaciones
- Solución Control Vigas 2024Documento2 páginasSolución Control Vigas 2024ANTONIO JOSE MORENO CHECAAún no hay calificaciones
- Nomenclatura InórganicaDocumento8 páginasNomenclatura InórganicaRommel Paye PizarroAún no hay calificaciones
- RedoxDocumento6 páginasRedoxLucia ToribioAún no hay calificaciones
- Actividad 3 Ing. de ProcesamientoDocumento1 páginaActividad 3 Ing. de Procesamientocarlosrg01712Aún no hay calificaciones
- Nomenclatura Inorganica para Segundo de SecundariaDocumento6 páginasNomenclatura Inorganica para Segundo de SecundariaVilma PACHAS DE LA CRUZAún no hay calificaciones
- Apuntes Clase PDFDocumento7 páginasApuntes Clase PDFCarla Garcia EsquivaAún no hay calificaciones
- Tarea SO2Documento1 páginaTarea SO2Laura Blazquez MiguelAún no hay calificaciones
- Tarea 2, Equipo 7Documento7 páginasTarea 2, Equipo 7Montserrat GutierrezAún no hay calificaciones
- Teoría Atómica 1°Documento14 páginasTeoría Atómica 1°orihuelamikaelaAún no hay calificaciones
- Ejercicios Final 2Documento30 páginasEjercicios Final 2Santi FerreiraAún no hay calificaciones
- FormularioDocumento2 páginasFormulariocata.godoy.alfaroAún no hay calificaciones
- 8 Asentamiento Por Consolidacion PDFDocumento6 páginas8 Asentamiento Por Consolidacion PDFMarilia GalindoAún no hay calificaciones
- Microeconomía Greatest HitsDocumento36 páginasMicroeconomía Greatest HitsPablo GuitartAún no hay calificaciones
- Tema 4Documento1 páginaTema 4joaquin hernandezAún no hay calificaciones
- Steerin: Sfe+1Mnoy - ZDocumento2 páginasSteerin: Sfe+1Mnoy - ZAlyson RevolledoAún no hay calificaciones
- Ejercicios de QuímicaDocumento2 páginasEjercicios de QuímicaAlyson RevolledoAún no hay calificaciones
- Analisis Matricial de Un Marco MathcadDocumento8 páginasAnalisis Matricial de Un Marco MathcadBenhjaAún no hay calificaciones
- Clase 9 - Equilibrio de Cuerpos Rígidos ESR115Documento14 páginasClase 9 - Equilibrio de Cuerpos Rígidos ESR115karlaAún no hay calificaciones
- Mate II 24-0Documento6 páginasMate II 24-0pamela arlet zamora osscoAún no hay calificaciones
- Circuito 3Documento18 páginasCircuito 3Jean Alberto Quintero JimenezAún no hay calificaciones
- Ex MyM Julio 2019Documento14 páginasEx MyM Julio 2019Pablo Gil MárquezAún no hay calificaciones
- Formulario Elasticidad PDFDocumento2 páginasFormulario Elasticidad PDFPaola FdezAún no hay calificaciones
- Integrales Triples 2 PDFDocumento8 páginasIntegrales Triples 2 PDFPedRo Mijael CastilloAún no hay calificaciones
- Del Colegio A La Universidad!!: I.E.P. "Peruano Español"Documento8 páginasDel Colegio A La Universidad!!: I.E.P. "Peruano Español"MARIA ALEJANDRA VASQUEZ GONZALES100% (1)
- Circuitos Lineales 8Documento3 páginasCircuitos Lineales 8NERYAún no hay calificaciones
- GR 14Documento4 páginasGR 14Kevin JonathanAún no hay calificaciones
- Conceptos Previos de La Nomenclatura Inorganica para Quinto de SecundariaDocumento4 páginasConceptos Previos de La Nomenclatura Inorganica para Quinto de SecundariaJose luis Huaman gasparAún no hay calificaciones
- Treboles Resueltos MatematicasDocumento7 páginasTreboles Resueltos MatematicasCarol CachaldoraAún no hay calificaciones
- Ejercicios Resueltos para RepasarDocumento7 páginasEjercicios Resueltos para RepasarsantiagoAún no hay calificaciones
- Formulario Mat 102Documento1 páginaFormulario Mat 102René CondoriAún no hay calificaciones
- Pauta Auxiliar 24Documento5 páginasPauta Auxiliar 24natashaAún no hay calificaciones
- e7acfd1685931744NOMENCLATURAINORGANICA PERUANOESPAÑOL 2023Documento42 páginase7acfd1685931744NOMENCLATURAINORGANICA PERUANOESPAÑOL 2023MARIA ALEJANDRA VASQUEZ GONZALESAún no hay calificaciones
- Resolución de Problemas PracticosDocumento6 páginasResolución de Problemas PracticosGenesis CarrilloAún no hay calificaciones
- Rocio, BurbujaDocumento15 páginasRocio, BurbujaRicardoAún no hay calificaciones
- Integral de Riemann. Ejercicios PropuestodDocumento1 páginaIntegral de Riemann. Ejercicios Propuestodcpp31145292Aún no hay calificaciones
- Tema3 Campos EstaticosDocumento20 páginasTema3 Campos EstaticosMiassssAún no hay calificaciones
- Radiactividad IiDocumento6 páginasRadiactividad IiJaneth Briceño AlayoAún no hay calificaciones
- Electro TareaDocumento1 páginaElectro TareageovannyAún no hay calificaciones
- Ejercicios DesarrolladosDocumento5 páginasEjercicios DesarrolladosRosas MaryAún no hay calificaciones
- ? Práctica 1Documento17 páginas? Práctica 1jeanpremium0Aún no hay calificaciones
- 04 04 FraccionesAlgebraicasDocumento3 páginas04 04 FraccionesAlgebraicasminuch00newsAún no hay calificaciones
- Pizarra Invope I LM 2023-2 m1Documento4 páginasPizarra Invope I LM 2023-2 m1j.ladera303Aún no hay calificaciones
- Ayudantía 1 LinealDocumento7 páginasAyudantía 1 LinealDaniela Andrea Osorio GonzálezAún no hay calificaciones
- CARACTERISTICAS QUIMICAS DE LA MATERIA VIVIENTE Lab #3Documento15 páginasCARACTERISTICAS QUIMICAS DE LA MATERIA VIVIENTE Lab #3kiaraAún no hay calificaciones
- Practica #14 AminasDocumento5 páginasPractica #14 AminasCarlos JuarezAún no hay calificaciones
- PH Actividad - Acidos y Bases FuertesDocumento2 páginasPH Actividad - Acidos y Bases FuertesAsfn KskAún no hay calificaciones
- Clase 9 Geometria MolecularDocumento64 páginasClase 9 Geometria MolecularSofia MartínezAún no hay calificaciones
- Fidel Solis TareaS3Documento7 páginasFidel Solis TareaS3Fidel Heriberto Solis NovaAún no hay calificaciones
- Hoja de Repaso Nomenclatura 2019Documento3 páginasHoja de Repaso Nomenclatura 2019Yasuo SireitonAún no hay calificaciones
- Cuestionario Laboratorio 5Documento4 páginasCuestionario Laboratorio 5Noelia Alondra MartinezAún no hay calificaciones
- Sintesis y Propiedades Quimicas de Los EsteresDocumento4 páginasSintesis y Propiedades Quimicas de Los EsteresandresfelipeAún no hay calificaciones
- Nomenclatura Derivados de Acido 2k12Documento9 páginasNomenclatura Derivados de Acido 2k12Jannette TziánAún no hay calificaciones
- 7.1 Solubilidad-Fuerza IntermolecularDocumento15 páginas7.1 Solubilidad-Fuerza IntermolecularDaniel Felipe Aguilar LozadaAún no hay calificaciones
- Tarea 1S. AlbaidaDocumento3 páginasTarea 1S. AlbaidaYnnavoy ArdevaasAún no hay calificaciones
- Compuestos NitrogenadosDocumento61 páginasCompuestos Nitrogenadosjeanny floresAún no hay calificaciones
- BQ Doc - Gen.Documento511 páginasBQ Doc - Gen.Gilson ValenciaAún no hay calificaciones
- Oxoacidos Meta Piro Di OrtoDocumento5 páginasOxoacidos Meta Piro Di OrtoGema Gómez0% (2)
- Recursos Archivos 72378 72378 482 Capitulo-6-121217Documento9 páginasRecursos Archivos 72378 72378 482 Capitulo-6-121217Edinson CaicedoAún no hay calificaciones
- Sintesis Nitroacetanilida - JULIO 2017Documento6 páginasSintesis Nitroacetanilida - JULIO 2017Leonela Herrera DuqueAún no hay calificaciones
- NOMENCLADocumento316 páginasNOMENCLAGega123Aún no hay calificaciones
- Tarea Gpos FunDocumento32 páginasTarea Gpos FunKadath OoAún no hay calificaciones
- Quimica Analitica Unidad 2Documento9 páginasQuimica Analitica Unidad 2Gilberto EugenioAún no hay calificaciones
- Química Del MagnesioDocumento1 páginaQuímica Del MagnesioROMERO ANNIE FIKRE DE JESUSAún no hay calificaciones
- Informe HidrocarburosDocumento10 páginasInforme HidrocarburosFranco DavidAún no hay calificaciones
- Prueba Diagnóstica Noveno 2020Documento3 páginasPrueba Diagnóstica Noveno 2020MI TFAún no hay calificaciones
- Analsis CualitativoDocumento8 páginasAnalsis CualitativoArq Javier ParésAún no hay calificaciones
- Seminario 2Documento25 páginasSeminario 2Shirley ProañoAún no hay calificaciones
- Informe de Neutralización de Ácido - BaseDocumento7 páginasInforme de Neutralización de Ácido - Basepablo martin perezAún no hay calificaciones
- Reporte P8. Extracción Ácido-Base - Equipo 6 - 1101 - BQD - Lab. QO IDocumento39 páginasReporte P8. Extracción Ácido-Base - Equipo 6 - 1101 - BQD - Lab. QO Ileonardo Ibañez PardinesAún no hay calificaciones
- Biologia 8 Guia 2Documento3 páginasBiologia 8 Guia 2René Nicolás LópezAún no hay calificaciones
- Unidad 3Documento9 páginasUnidad 3Eavt AdvAún no hay calificaciones
- Quimica 2 Segundo ParcialDocumento44 páginasQuimica 2 Segundo Parcialleonardo josue arevalo arcosAún no hay calificaciones