Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica Dirigida 9
Cargado por
Roxana LiuTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practica Dirigida 9
Cargado por
Roxana LiuCopyright:
Formatos disponibles
FISICOQUIMICA
9na PRACTICA DIRIGIDA
1. Considere una máquina de vapor que usa focos a 800 y 0 °C.
a) Calcule el máximo rendimiento posible.
b) Si qc es 1000 J, halle el máximo valor de w y el mínimo valor de qf
2. Suponga que el foco más frio del que disponemos esta a 10 °C. Si queremos una máquina térmica con un
rendimiento de al menos el 90 %, ¿cuál debe ser la temperatura mínima del foco caliente?
3. Una máquina térmica basada en el ciclo de Carnot efectúa un trabajo de 2.50 KJ por ciclo y tiene un
rendimiento del 45 %. Calcule w, qc y qf para un ciclo.
4. Halle S cuando 2 moles de O2 se calientan de 27 °C a 127 °C a una Presión constante de 1 atm.
Cp,m = a + bT, donde a = 6.15 cal/mol °K y b = 0.00310 cal/mol °K-2.
5. Calcule S para convertir 1 mol de hielo a 0 °C y 1 atm a 1 mol de vapor de agua a 100 °C y 0.5 atm.
Calor latente de fusión del agua = 79.7 cal/g
Calor latente de vaporización del agua = 539.4 cal/g
Cp agua liquida = 1 cal/g °K
6. Calcule S cuando 1 mol de vapor de agua inicialmente a 200 °C y 1 bar, efectúa un proceso cíclico con q
= - 145 J
7. 200 g de oro [Cp = 0.013 cal/ g °C] a 120 °C se depositan sobre 25 g de agua a 10 °C, y el sistema alcanza
el equilibrio en un recipiente adiabático. Calcule:
a) La temperatura final
b) SAu
c) S H2O
d) SAu + S H2O
8. Calcule S en la mezcla de 10 g de He a 120 °C y 1.5 bar con 10 g de O2 a 120 °C y 1.5 bar
Para una mezcla de gases, usar:
S = na R ln[(na + nb)/na] + nb R ln [(na + nb)/nb]
Ing° Carlos E. Bernal Aybar
FISICOQUIMICA
9. Una masa de 10 g de hielo a 0 °C se pone en contacto con una fuente térmica a 350 °K, hasta que alcanza
un nuevo estado de equilibrio. Determinar la variación de entropía del agua y del universo sabiendo que
el calor específico del agua líquida a presión constante es de 1 cal/g °K y su calor latente de fusión de 80
cal/g.
10.Un mol de gas ideal se comprime isotérmicamente aplicándole una presión constante de 15 atm, desde
un volumen de 18.2 L hasta un volumen de 9.85 L a la temperatura de 13.2 ºC. Determinar el incremento
de entropía que experimenta el gas.
11.Calcular la entropía molar de un gas B a 300 °K y una atmósfera de presión, sabiendo que ese compuesto
es sólido por debajo de 100 °K, y que sublima a esa temperatura cuando la presión es de 1 bar, con una
entalpía de sublimación de 2000 cal/mol.
Datos: Cp(s) = 2.5x10-4 T3 - 2.4x10-10 T6 cal/mol °K
Cp(g) = 6 cal/mol °K
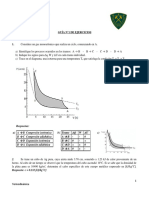
12.Un mol de gas ideal monoatómico recorre un ciclo de Carnot reversible, como el indicado en la figura, con
V1 = 20 L, V2 = 40 L, T1 = 300 K y T3 = 200 K.
Calcúlense Δp, ΔV, ΔT, ΔU, ΔH y ΔS en cada etapa del ciclo.
Ing° Carlos E. Bernal Aybar
FISICOQUIMICA
13.Un ciclo de Carnot trabaja con 0,908 kg de aire, entre los límites de 21°C y 260 °C. La presión al principio
de la expansión isotérmica es de 30 bar abs. y al final de la expansión isotérmica de 15 bar abs. Calcular:
a) El volumen al final de la compresión isotérmica, en m3.
b) El calor añadido y rechazado, en kJ.
c) El trabajo neto del ciclo, en kJ.
d) El rendimiento térmico.
Ing° Carlos E. Bernal Aybar
También podría gustarte
- FISICOQUIMICA: Cálculos de entropía y ciclos de CarnotDocumento3 páginasFISICOQUIMICA: Cálculos de entropía y ciclos de CarnotBryan Calderon OcampoAún no hay calificaciones
- Practica Dirigida 8Documento1 páginaPractica Dirigida 8Ariana Garcia uwuAún no hay calificaciones
- Ejercicios 2do Principio Termodinámica 2019-IDocumento2 páginasEjercicios 2do Principio Termodinámica 2019-IRai Delgado Torres100% (1)
- Ejercicios Segunda Ley 2020-IIDocumento2 páginasEjercicios Segunda Ley 2020-IIStefany Elizabeth Crisostomo QuispeAún no hay calificaciones
- Ejercicios Segunda Ley 2020-IIDocumento2 páginasEjercicios Segunda Ley 2020-IIStefany Elizabeth Crisostomo QuispeAún no hay calificaciones
- Guias2y4FisicoquimicaIDocumento4 páginasGuias2y4FisicoquimicaIKaren González OrtuyaAún no hay calificaciones
- 2da Ley ENTROPIADocumento3 páginas2da Ley ENTROPIAStefany Elizabeth Crisostomo QuispeAún no hay calificaciones
- PROBLEMAS I UnidadDocumento3 páginasPROBLEMAS I UnidadJorge VillegasAún no hay calificaciones
- 1ra Ley Termodinàmica. Octubre 2016 - Marzo 2017Documento3 páginas1ra Ley Termodinàmica. Octubre 2016 - Marzo 2017Wendy Dávila ArteagaAún no hay calificaciones
- Ejerccios Fisicoquimica Taller 1ra LeyDocumento2 páginasEjerccios Fisicoquimica Taller 1ra LeyBielka Pérez ʚïɞAún no hay calificaciones
- Termodinamica 2 C 15Documento8 páginasTermodinamica 2 C 15Giovani Butron BordaAún no hay calificaciones
- Problemas Tema 2Documento2 páginasProblemas Tema 2José Rafael GuillénAún no hay calificaciones
- Problemas de termodinámica química para entregarDocumento1 páginaProblemas de termodinámica química para entregarJesús NequisAún no hay calificaciones
- 12prob - Termodinámica Con SolsDocumento2 páginas12prob - Termodinámica Con SolsalterlaboroAún no hay calificaciones
- Practica 1 Fisqca UcbDocumento4 páginasPractica 1 Fisqca UcbalexofigurinAún no hay calificaciones
- Guía 2 TermodinámicaDocumento3 páginasGuía 2 TermodinámicaJosé Barrera CovarrubiasAún no hay calificaciones
- MetodologiaDocumento1 páginaMetodologiaLUCERO100% (1)
- Gua N1 Termodinmica 2015Documento9 páginasGua N1 Termodinmica 2015Elías Raphael Rubilar BugueñoAún no hay calificaciones
- 2do Parcial FQDocumento15 páginas2do Parcial FQCamila Zapata AriasAún no hay calificaciones
- ProblemasDocumento5 páginasProblemasGaston AlarconAún no hay calificaciones
- Hoja 3Documento3 páginasHoja 3Jony GarciaAún no hay calificaciones
- Taller FQ Exam30f5Documento2 páginasTaller FQ Exam30f5Bryan BeleñoAún no hay calificaciones
- Fisicoquímica: taller para examen parcial de gases, termoquímica y solucionesDocumento3 páginasFisicoquímica: taller para examen parcial de gases, termoquímica y solucionesKANDERMORADOAún no hay calificaciones
- Serie de Ejercicios Segunda LeyDocumento3 páginasSerie de Ejercicios Segunda LeyLuisCharrisAún no hay calificaciones
- Term Odin A MicaDocumento10 páginasTerm Odin A MicaVictor GomezAún no hay calificaciones
- Lab s07 Jbenitez Termodinamica 2023 1Documento12 páginasLab s07 Jbenitez Termodinamica 2023 1MILAGROS ALEJANDRAAún no hay calificaciones
- Química General II Tarea Problemas TermodinámicaDocumento15 páginasQuímica General II Tarea Problemas TermodinámicaGianpierre Rojas AgapitoAún no hay calificaciones
- Ejercicios Segunda Ley TermodinámicaDocumento2 páginasEjercicios Segunda Ley TermodinámicaLORENZO MARIANO RODRIGUEZ GONZALESAún no hay calificaciones
- PROBLEMAS I LeyDocumento1 páginaPROBLEMAS I LeyDENNIS ALBERTO DIAZ ESPINOZAAún no hay calificaciones
- Calorimetria 1Documento4 páginasCalorimetria 1Aldair ArpasiAún no hay calificaciones
- Ejercicios de calor y cambio de estadoDocumento6 páginasEjercicios de calor y cambio de estadoMAIRA ALEJANDRA BARRIOS GAMEZAún no hay calificaciones
- Ejercicios Semana 1 FisioquimicaDocumento14 páginasEjercicios Semana 1 FisioquimicaOscar CalaguaAún no hay calificaciones
- Practica #3 - Tercer Parcial (Sin Respuestas) PDFDocumento11 páginasPractica #3 - Tercer Parcial (Sin Respuestas) PDFCarlos LopezAún no hay calificaciones
- Guia Termo TecnoDocumento5 páginasGuia Termo TecnoMiguel DominguezAún no hay calificaciones
- Termodinámica: Procesos de gases ideales y realesDocumento5 páginasTermodinámica: Procesos de gases ideales y realesJanela MostaceroAún no hay calificaciones
- Guía de TermodinámicaDocumento9 páginasGuía de TermodinámicaJavier CortésAún no hay calificaciones
- Problemario Termo 2Documento4 páginasProblemario Termo 2Hector SustaitaAún no hay calificaciones
- Cálculos de rendimiento y cambios de entropía para procesos termodinámicosDocumento6 páginasCálculos de rendimiento y cambios de entropía para procesos termodinámicosDaniel NoreñaAún no hay calificaciones
- Guia de SA y SC 2021 - F - Q para EntregarDocumento7 páginasGuia de SA y SC 2021 - F - Q para EntregarLeandro PonceAún no hay calificaciones
- Boletin n1Documento2 páginasBoletin n1ImaneAún no hay calificaciones
- Ejercicios de termodinámica y cálculos de calorDocumento7 páginasEjercicios de termodinámica y cálculos de calorMonXEmoAún no hay calificaciones
- MMMMMDocumento3 páginasMMMMMCristina GranizoAún no hay calificaciones
- Calcule El Calor Necesario para Calentar 200Kg de N2O de 20Documento2 páginasCalcule El Calor Necesario para Calentar 200Kg de N2O de 20GABRIELAAún no hay calificaciones
- FisicoquimicaDocumento3 páginasFisicoquimicaWilmer Huamani cupeAún no hay calificaciones
- S01.s1-Resolver Ejercicios FisioquimicaDocumento9 páginasS01.s1-Resolver Ejercicios FisioquimicaOscar CalaguaAún no hay calificaciones
- ACTIVIDAD N 02 (Autoguardado)Documento17 páginasACTIVIDAD N 02 (Autoguardado)Dalliana Malu Soplapuco Aguilar0% (1)
- Guia de Problemas Quimica General y Laboratorio QMC111Documento45 páginasGuia de Problemas Quimica General y Laboratorio QMC111JULIO CESAR ESPINOZA RIBERAAún no hay calificaciones
- Ejercicios Primera Ley TermodinámicaDocumento9 páginasEjercicios Primera Ley TermodinámicabrayanfloresmerinoAún no hay calificaciones
- Primer Taller TermoDocumento10 páginasPrimer Taller Termobookgalindo0404Aún no hay calificaciones
- Taller 2 FQDocumento2 páginasTaller 2 FQBielka Pérez ʚïɞAún no hay calificaciones
- Verano Qmctpp2Documento2 páginasVerano Qmctpp2tenoriojantonioAún no hay calificaciones
- Examen Balance de M y EDocumento8 páginasExamen Balance de M y EFRITZ ANTHONY ATOCCSA MOLINAAún no hay calificaciones
- Problemas Bis 2013Documento3 páginasProblemas Bis 2013Emanuel TejadaAún no hay calificaciones
- Segunda Ley TermodinamicaDocumento3 páginasSegunda Ley Termodinamicacarlos danielAún no hay calificaciones
- Taller TermodinamicaDocumento5 páginasTaller Termodinamicaapi-241769574Aún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- P02. Cuestionario y Contraste FisicoquímicaDocumento1 páginaP02. Cuestionario y Contraste FisicoquímicaDDanii MoraLes RanGeelAún no hay calificaciones
- TERMODocumento23 páginasTERMOlorenaAún no hay calificaciones
- Actividades de Recuperación de Física y Química de 2º eDocumento18 páginasActividades de Recuperación de Física y Química de 2º emikelAún no hay calificaciones
- AGUA - Teoría 1Documento14 páginasAGUA - Teoría 1Agustin TuroneAún no hay calificaciones
- Informe de Química Orgánica - 4Documento13 páginasInforme de Química Orgánica - 4Anonymous AXUHgGelGZAún no hay calificaciones
- Problemas Propuestos de Destilacion Diferencial 2020 IDocumento2 páginasProblemas Propuestos de Destilacion Diferencial 2020 IJessica Cristina Navarro RaveloAún no hay calificaciones
- 4 Estados de Vapor Que Representan Las Combinaciones RelativasDocumento5 páginas4 Estados de Vapor Que Representan Las Combinaciones RelativasSebastian CorderoAún no hay calificaciones
- Ensayo Unidad IiDocumento9 páginasEnsayo Unidad IiAbril GarcíaAún no hay calificaciones
- Presiones en fluidos estáticos y atmósferasDocumento18 páginasPresiones en fluidos estáticos y atmósferasYeisver PeraltaAún no hay calificaciones
- Actividad IndividualDocumento12 páginasActividad IndividualDiana MartinezAún no hay calificaciones
- Procesos Girbotol y SelexolDocumento6 páginasProcesos Girbotol y SelexolJUANAún no hay calificaciones
- Naturales 10Documento4 páginasNaturales 10jaider graciaAún no hay calificaciones
- Informe RecristalizaciónDocumento7 páginasInforme RecristalizaciónJuan Jose HermosaAún no hay calificaciones
- VAPORDocumento11 páginasVAPORJoe GallAún no hay calificaciones
- 1 Seccion. Propiedades de Los Fluidos C3 PDFDocumento43 páginas1 Seccion. Propiedades de Los Fluidos C3 PDFRonald Cuenta MamaniAún no hay calificaciones
- Atmosfera PresentacionDocumento17 páginasAtmosfera Presentacionyeny moralesAún no hay calificaciones
- Practica N 2 288455 - Quimica General - 2023-01 - Fc-Preiam02a1mhDocumento7 páginasPractica N 2 288455 - Quimica General - 2023-01 - Fc-Preiam02a1mhAlessandro PerezAún no hay calificaciones
- Gas Ideal-Gas RealDocumento7 páginasGas Ideal-Gas RealJessi Cam-Eli100% (1)
- Prueba de UbicaciónDocumento11 páginasPrueba de UbicaciónAna MezaAún no hay calificaciones
- Tema 2 1 CONCEPTOS FUNDAMENTALES DE HUMIDIFICACIyiNDocumento15 páginasTema 2 1 CONCEPTOS FUNDAMENTALES DE HUMIDIFICACIyiNCarlos Av.Aún no hay calificaciones
- TP Quimica Electronegatividad y Enlaces QuimicosDocumento7 páginasTP Quimica Electronegatividad y Enlaces QuimicosCastillo MartinaAún no hay calificaciones
- Hidrostática PascalDocumento14 páginasHidrostática PascalMina GuillerminaAún no hay calificaciones
- Practica 5. Geometria MolecularDocumento13 páginasPractica 5. Geometria MolecularGiovanni RodriguezAún no hay calificaciones
- Uniones QuímicasDocumento3 páginasUniones QuímicasAna RossiAún no hay calificaciones
- Unidad 5. Diagramas y Transformaciones de Fases. 3. Variaciones Microestructurales Por Transformación de FasesDocumento13 páginasUnidad 5. Diagramas y Transformaciones de Fases. 3. Variaciones Microestructurales Por Transformación de Fasesllll.cccAún no hay calificaciones
- Ficha Estados de La MateriaDocumento1 páginaFicha Estados de La MateriaBALBINO SOBREVIELA JIMÉNEZAún no hay calificaciones
- Ejercicios Concepto de MolDocumento4 páginasEjercicios Concepto de MolSonia SanhuezaAún no hay calificaciones
- Problemas Propuestos Unidad 5Documento6 páginasProblemas Propuestos Unidad 5Alondra Aguilar VargasAún no hay calificaciones
- Guía No.02 Determinación de Densidad y Viscosidad QuimicaDocumento12 páginasGuía No.02 Determinación de Densidad y Viscosidad QuimicaNayeli QuinatoaAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa Conceptualargelio arroyoAún no hay calificaciones