Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Preparacion de Soluciones - Mapa Conceptual
Cargado por
elcrack awcDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Preparacion de Soluciones - Mapa Conceptual
Cargado por
elcrack awcCopyright:
Formatos disponibles
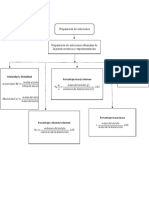
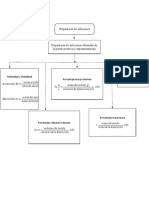
Preparacion
Preparacion Por pesada directa: Se parte de un
soluciones
solido que se disuelve en disolvente
Por dilución: Se parte de una soluicion
y se agrega solvente
Son mezclas homogeneas ~Volumen de solucion
(son una sola fase que estan necesitada
Soluto: compuestos de un soluto y un solvente) ~Concentracion deseada
Es la sustancia que se Disolvente:
~Precision y exactitud en
disuelve, dispersa. Se Es aquella que disuelve
el valor deseado
encuentra en menor al soluto. Se encuentra Medicion
proporcion ya sea peso en mayor proporcion.
o volumen.
Pesada directa:
Medir:
Mol=masa/pm Masa de soluto
Molaridad=# de moles/L Volumen de solución
Normalidad: equivalente-gramos/L
Por dilución:
Ejemplos Medir: volumen de solucion
Concentracion:
Es la relacion que inicial
existe entre estas 2 volumen de solucion final
%m/m= (masa de soluto(g)/ masa
de disolución(g))*100
Solventes polares: %m/v=(masa de soluto(g)/Volumen
~agua(H2O) de disolucion(mL))*100
~alcohol etilico(C2H5OH)
~amoniaco(NH3) Se expresa en:
%v/v=(volumen de
soluto(mL)/volumen de
Solventes no polares:
~Benceno(C6H6) disolución(mL))*100
~eter(R-O-R)
~tetracloruro de carbono
(CCL4)
Porcentaje(%m/m y %m/v)
Molaridad(M)
Molalidad(m)
Normalidad(N)
ppm(Partes por Millon)
También podría gustarte
- SOLUCIONESDocumento2 páginasSOLUCIONESedudavila16Aún no hay calificaciones
- Guía de Unidades Físicas de Concentración Uesm 2022Documento8 páginasGuía de Unidades Físicas de Concentración Uesm 2022CESAR EDUARDO CAÑARTE VERAAún no hay calificaciones
- Disoluciones 1Documento18 páginasDisoluciones 1LESLI SARITA FERNANDEZ BECERRAAún no hay calificaciones
- Cuadro de Formulas DigitalizadoDocumento1 páginaCuadro de Formulas DigitalizadoBleidis CamposAún no hay calificaciones
- Fotocopias DisolucionesDocumento7 páginasFotocopias Disolucionesapi-3810262Aún no hay calificaciones
- Reporte # 2 Química GeneralDocumento6 páginasReporte # 2 Química GeneralAzul HernándezAún no hay calificaciones
- DisolucionesDocumento48 páginasDisolucionesJhonatan Gironda ugarteAún no hay calificaciones
- Soluciones y ConcentracionesDocumento2 páginasSoluciones y ConcentracionesApurimac RunningAún no hay calificaciones
- Laboratorio 7 QuímicaDocumento3 páginasLaboratorio 7 Químicalaura mAún no hay calificaciones
- DILUCIONESDocumento9 páginasDILUCIONESAdaluisa OchaetaAún no hay calificaciones
- DISOLUCIONESDocumento18 páginasDISOLUCIONESMARTHAAún no hay calificaciones
- SOLUCIONESDocumento3 páginasSOLUCIONESFranciscoAún no hay calificaciones
- Disoluciones 1Documento18 páginasDisoluciones 1AndrésAún no hay calificaciones
- Mentefactos SolucionesDocumento1 páginaMentefactos SolucionesAna Cecilia Bonilla EstupiñanAún no hay calificaciones
- 9-Resumen Unidades de ConcentraciónDocumento2 páginas9-Resumen Unidades de ConcentraciónAndrea MirAún no hay calificaciones
- Formulario para ConcentraciónDocumento3 páginasFormulario para ConcentraciónEmmi Visant SandovalAún no hay calificaciones
- SOLUCIONES PREPERACION Y TITULACION NuevoDocumento15 páginasSOLUCIONES PREPERACION Y TITULACION NuevoZayrha AcostaAún no hay calificaciones
- Resumen de Formulas para El Seminario IDocumento10 páginasResumen de Formulas para El Seminario IJosue R Atanacio VeliAún no hay calificaciones
- Soluciones I y IIDocumento2 páginasSoluciones I y IISamira RIAún no hay calificaciones
- Química General: Preparación Al Más Alto NivelDocumento2 páginasQuímica General: Preparación Al Más Alto NivelCarlos Choqueapaza CalizayaAún no hay calificaciones
- Unidad 4 Disoluciones y Las Diferentes Medidas de Su Concentración. JorjhanaDocumento29 páginasUnidad 4 Disoluciones y Las Diferentes Medidas de Su Concentración. Jorjhanajorge ortizAún no hay calificaciones
- Disoluciones y Las Diferentes Medidas de Su ConcentraciónDocumento28 páginasDisoluciones y Las Diferentes Medidas de Su ConcentraciónRocio Diana Ibarrola CTA-QI100% (1)
- Felipe Castro Yahir 5IM06 TripticoDocumento1 páginaFelipe Castro Yahir 5IM06 TripticoyahirAún no hay calificaciones
- DisolucionesDocumento35 páginasDisolucionesBenjamínAún no hay calificaciones
- Disoluciones y Las Diferentes Medidas de Su ConcentraciónDocumento28 páginasDisoluciones y Las Diferentes Medidas de Su ConcentraciónGabriela MolinaAún no hay calificaciones
- Gradodecimo Gua Soluciones 130813153320 Phpapp02Documento6 páginasGradodecimo Gua Soluciones 130813153320 Phpapp02alfAún no hay calificaciones
- TSQuímica I Bloque III Sesión 1 y 2solucionesDocumento36 páginasTSQuímica I Bloque III Sesión 1 y 2solucionesSem Fabricio Vásquez SánchezAún no hay calificaciones
- Guia Disoluciones (Tema 3)Documento12 páginasGuia Disoluciones (Tema 3)Gabriela ContrerasAún no hay calificaciones
- Disoluciones y Las Diferentes Medidas de Su ConcentraciónDocumento28 páginasDisoluciones y Las Diferentes Medidas de Su Concentraciónclaudio valerioAún no hay calificaciones
- INFORME 1 Ejercicios para La Preparación de Soluciones Estándares y DilucionesDocumento6 páginasINFORME 1 Ejercicios para La Preparación de Soluciones Estándares y DilucionesDronizo OhAún no hay calificaciones
- Preparación de Soluciones de Diferentes ConcentracionesDocumento22 páginasPreparación de Soluciones de Diferentes ConcentracionesRubén Gabriel Calderón GarcíaAún no hay calificaciones
- Soluciones QuimicasDocumento22 páginasSoluciones QuimicasvilwashintongAún no hay calificaciones
- 2 Soluciones QuimicasDocumento22 páginas2 Soluciones QuimicasEdgar velascoAún no hay calificaciones
- Objetivo de Soluciones QuímcaDocumento4 páginasObjetivo de Soluciones QuímcaRubén Michca HuayllaniAún no hay calificaciones
- Preparacion de Soluciones Informe-1Documento8 páginasPreparacion de Soluciones Informe-1Valeria CamargoAún no hay calificaciones
- Concentraciones QuímicasDocumento29 páginasConcentraciones QuímicasdarmarielAún no hay calificaciones
- Concen Traci OnesDocumento7 páginasConcen Traci OnesMAURICIO ALFONSO RODRIGUEZ SARRIAAún no hay calificaciones
- SolucionesDocumento28 páginasSolucionesSergio GaonaAún no hay calificaciones
- Unidades de ConcentraciónDocumento4 páginasUnidades de ConcentraciónJesus SloAún no hay calificaciones
- Guia Disoluciones TeoríaDocumento12 páginasGuia Disoluciones TeoríaFrancis A. SalazarAún no hay calificaciones
- Marco Teórico - SolucionesDocumento3 páginasMarco Teórico - SolucionesJuan Ubaldo100% (9)
- Unidades de ConcentracionDocumento1 páginaUnidades de ConcentracionJoseph Jorge Jr.Aún no hay calificaciones
- Diagrama de Flujo SolucionesDocumento1 páginaDiagrama de Flujo SolucionesEdwin TulcanAún no hay calificaciones
- Diagrama de Flujo SolucionesDocumento1 páginaDiagrama de Flujo SolucionesEdwin TulcanAún no hay calificaciones
- CAP 3 DISOLUCION Y PROPIEDADES COLIGATIVAS Parte 2 Unidades Que Expresan ConcentracionDocumento24 páginasCAP 3 DISOLUCION Y PROPIEDADES COLIGATIVAS Parte 2 Unidades Que Expresan ConcentracionAlexander Baldivieso NinaAún no hay calificaciones
- Soluciones y ConcentracionesDocumento30 páginasSoluciones y ConcentracionesJaira GalloAún no hay calificaciones
- Solucionesquimicas 120602171917 Phpapp01Documento20 páginasSolucionesquimicas 120602171917 Phpapp01Cecilia Parraga AlavaAún no hay calificaciones
- Soluciones Q1029 AD2022Documento27 páginasSoluciones Q1029 AD2022Victor MartinezAún no hay calificaciones
- Resumen de Formulas para El Seminario IDocumento9 páginasResumen de Formulas para El Seminario IDelia Norali Bautista GutierrezAún no hay calificaciones
- Mapa Conceptual Unidad de Concentracion de La DisolucionesDocumento2 páginasMapa Conceptual Unidad de Concentracion de La DisolucionesRonald ChambiAún no hay calificaciones
- Soluciones Químicas 2.0 - 2Documento36 páginasSoluciones Químicas 2.0 - 2Jose GuillenAún no hay calificaciones
- Quimica Sem 11 - 2022 IiiDocumento4 páginasQuimica Sem 11 - 2022 Iiimaria caycho rodriguezAún no hay calificaciones
- Mapa Mental de Las Distintas Formas de Expresar La Concentracion en SolucionesDocumento1 páginaMapa Mental de Las Distintas Formas de Expresar La Concentracion en Solucionesjorge0% (1)
- Unidades de Concentración 2Documento2 páginasUnidades de Concentración 2Sebastián MejiaAún no hay calificaciones
- Resumen de Formulas para El Seminario IDocumento9 páginasResumen de Formulas para El Seminario IPLC8Aún no hay calificaciones
- Diapositivas Disoluciones MolalidadDocumento19 páginasDiapositivas Disoluciones MolalidadVALAún no hay calificaciones
- Soluciones - Tabla (2021-3)Documento1 páginaSoluciones - Tabla (2021-3)Cristian carrilloAún no hay calificaciones