Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Práctica N8 - TERMODINÁMICA
Cargado por
Jose Chavez VargasDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Práctica N8 - TERMODINÁMICA
Cargado por
Jose Chavez VargasCopyright:
Formatos disponibles
Universidad Nacional de Trujillo
Escuela de Ing. Zootecnia
Dinámica Aplicada a los Procesos Pecuarios
Práctica N°8: CALORIMETRÍA Y TERMODINÁMICA
1. La presión manométrica de un gas dentro de un depósito es 25 kPa. Determínese la altura vertical del líquido
del manómetro acoplado al sistema del fluido, a temperatura ambiente, es (a) agua, (b) mercurio ( 13 600
kg/m3), y (c) aceite de densidad relativa 0.88, con g = 9.75 m/s2
2. Un termómetro de gas a volumen constante se pone en contacto con un sistema de temperatura desconocida
T y a continuación en contacto con agua en el punto triple. La columna de mercurio unida al termómetro da
unas lecturas de 29,6 y -12,6 cm, respectivamente. La presión barométrica es de 97,5 kPa y la densidad
relativa del mercurio es 13,6. Encuéntrese el valor de la temperatura desconocida en kelvin.
3. Un depósito de oxigeno de 20 L está a una presión de 0.3 Patm y otro de nitrógeno de 30 L está a una presión
de 0,60 Patm. La temperatura de cada gas es 300 K. a continuación, el oxígeno se transporta al depósito de 30
L que contiene el nitrógeno, donde ambos se mezclan. ¿Cuál es la presión de la mezcla si su temperatura es
300 K?
4. Un vaso de vidrio de 25 g contiene 200 mL de agua a 24 °C. si echamos en el vaso dos cubos de hielo de 15
g cada uno a la temperatura de -3°C, ¿cuál es la temperatura final de la mezcla? Despreciar la conducción
térmica entre el vaso y la habitación.
5. En un balde que contiene una mezcla de hielo y agua con una masa total de 1,2 kg se deja caer un bloque de
cobre de 3,5 kg a una temperatura de 80°C. cuando se alcanza el equilibrio térmico, la temperatura del agua
es 8°C. ¿Cuánto hielo existía en el balde antes de que el bloque de cobre se situara en él? (despreciar la
capacidad calorífica del balde)
6. Si un gas absorbe 84 J de calor mientras está realizando 30 J de trabajo, ¿cuál es el cambio en la energía
interna del gas?
7. Un gas inicialmente ocupa 0.020 m3 a 1 MPa se expande cuasiestaticamente en un dispositivo cilindro-
embolo a presión constante hasta que el volumen es 0.040 m3. A continuación se mantiene a volumen
constante y se enfría hasta que la presión es la mitad de la inicial. Después se comprime cuasiestaticamente
hasta el estado original siguiendo el camino PV = constante. Determínese el trabajo neto del ciclo en
kilojulios.
8. Para cada uno de los siguientes casos correspondientes a procesos de sistemas cerrados, complétense los
datos que faltan (ver Tabla 01).
Tabla N° 01: Procesos Termodinámicos
Q W E1 E2 ΔE Q W E1 E2 ΔE
A 24 -15 -8 D 16 27 12
B -8 62 -18 E -9 15 29
C 17 -14 20 F -10 6 -10
9. Una maquina consume 200 J de un foco caliente a 373 K, realiza trabajo y cede 152 J a un foco frio a 273 K.
¿Cuánto trabajo se pierde por ciclo debido a la irreversibilidad de la maquina?
10.Una máquina que utiliza 1 mol de un gas ideal inicialmente a V1 = 24,6 L y T = 400 K funciona en un ciclo
que consta de 4 pasos: (1) expansión Isotérmica a T = 400 K hasta dos veces su volumen inicial, (2)
enfriamiento a volumen constante hasta T = 300 K, (3) Compresión Isotérmica hasta su volumen original, y
(4) calentamiento a volumen constante hasta su temperatura original de 400 K. supóngase que cv = 21 J/K.
Dibujar el ciclo en un diagrama P-V y calcular su rendimiento.
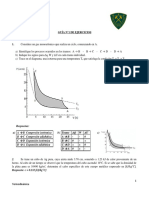
11.En el ciclo que muestra en la Figura 01, 1 mol de un gas ideal diatómico se encuentra inicialmente a una
presión de 1 atm y una temperatura de 0°C. el gas se calienta a volumen constante hasta T2 = 150°C y luego
se expansiona adiabáticamente hasta que su presión vuelve a ser 1 atm. Luego se comprime a presión
constante hasta su estado original. Calcular (a) la temperatura T3 después de la expansión adiabática, (b) el
calor absorbido o cedido por el sistema durante cada proceso, (c) el rendimiento de este ciclo y (d) el
rendimiento de un ciclo de Carnot que opere entre las temperaturas extremas del ciclo.
Ms. Ernesto Noriega Díaz Pá gina 1
Universidad Nacional de Trujillo
Escuela de Ing. Zootecnia
Dinámica Aplicada a los Procesos Pecuarios
Figura 1
12.Hallar la variación que experimenta la entropía al transformarse 10 g de hielo a -20°C en vapor a 100°C.
13.Se mezcla 1 kg de agua a la temperatura T1 = 30°C con 2 kg de agua a T2 = 90°C en un calorímetro de
capacidad calorífica despreciable a una presión constante de 1 atm. (a) Determinar la variación de entropía
del sistema, (b) hallar la variación de entropía del universo.
Ms. Ernesto Noriega Díaz Pá gina 2
También podría gustarte
- 2da Ley ENTROPIA 2020Documento4 páginas2da Ley ENTROPIA 2020Jose Vásquez GómezAún no hay calificaciones
- Ejercicios de La Segunda Ley y Ciclo de CarnotDocumento37 páginasEjercicios de La Segunda Ley y Ciclo de Carnotafrunp518677% (35)
- Autoevaluacion Cap 5 de HimmelblauDocumento9 páginasAutoevaluacion Cap 5 de HimmelblauAle OsbertoAún no hay calificaciones
- Cuestionario 1Documento9 páginasCuestionario 1RONDAN PEREZ FABRICIO WILERAún no hay calificaciones
- Taller 2 Química Física.........................Documento12 páginasTaller 2 Química Física.........................OM TfaAún no hay calificaciones
- Ejercicios Capitulo 6Documento6 páginasEjercicios Capitulo 6Fabian ChaconAún no hay calificaciones
- Problemas de FisicaDocumento12 páginasProblemas de FisicaAle RojasAún no hay calificaciones
- Practica n8 para ResolverDocumento5 páginasPractica n8 para ResolverAllison FgsAún no hay calificaciones
- U1901 Guia de Trabajos Prácticos Módulo III y IV 2020Documento22 páginasU1901 Guia de Trabajos Prácticos Módulo III y IV 2020Sebastian Lizarazo SotoAún no hay calificaciones
- Unidad 2 - Termodinámica - EjerciciosDocumento10 páginasUnidad 2 - Termodinámica - Ejerciciosʙʀᴀɴᴅᴏɴ ᴀᴅᴜᴠɪʀɪAún no hay calificaciones
- Informe de TermoquimicaDocumento15 páginasInforme de TermoquimicapanachosaurioAún no hay calificaciones
- Hoja Tema 8 Primer PrincipioDocumento2 páginasHoja Tema 8 Primer PrincipioManolo EldelbomboAún no hay calificaciones
- 07-1 - Práctica Primer PpioDocumento3 páginas07-1 - Práctica Primer PpioEmilia TamantiniAún no hay calificaciones
- Determinacion Capacidad CalorificaDocumento3 páginasDeterminacion Capacidad CalorificaCesarCocuyAún no hay calificaciones
- Guia de TP N 3 Con ExplicacionesDocumento7 páginasGuia de TP N 3 Con ExplicacionesaleinAún no hay calificaciones
- FFII-enunciados Tema 8Documento5 páginasFFII-enunciados Tema 8Pepe loanAún no hay calificaciones
- Termoquimica y Primera Ley de La TermodinamicaDocumento4 páginasTermoquimica y Primera Ley de La TermodinamicaMariel :vAún no hay calificaciones
- Ejercicios Primera Ley TermodinámicaDocumento9 páginasEjercicios Primera Ley TermodinámicabrayanfloresmerinoAún no hay calificaciones
- Informe de Laboratorio 7 PDFDocumento22 páginasInforme de Laboratorio 7 PDFFrank Perez ChavezAún no hay calificaciones
- TermoQca Taller No. 4 2018-1Documento1 páginaTermoQca Taller No. 4 2018-1Mauricio Taborda MontañoAún no hay calificaciones
- Guia Lab No 3 TermoquimicaDocumento11 páginasGuia Lab No 3 TermoquimicaGaravito Castillo Adriel SebastianAún no hay calificaciones
- Guia de Trabajos Prácticos 2do Módulo 2do Semestre 2018Documento23 páginasGuia de Trabajos Prácticos 2do Módulo 2do Semestre 2018genaradolores texeiraAún no hay calificaciones
- Informe TP de Laboratorio TermoquímicaDocumento8 páginasInforme TP de Laboratorio TermoquímicaNadia SolarAún no hay calificaciones
- Guia de Prob Termometria y Calorimetria - Principio de La TermoDocumento3 páginasGuia de Prob Termometria y Calorimetria - Principio de La TermoSanti KeslerAún no hay calificaciones
- Trabajo Práctico #5Documento4 páginasTrabajo Práctico #5Carli CastilloAún no hay calificaciones
- S16. s2 Ejercicios - MAQUINASDocumento2 páginasS16. s2 Ejercicios - MAQUINASJIMMY GABRIELAún no hay calificaciones
- S16.s2 Resolver EjerciciosDocumento2 páginasS16.s2 Resolver EjerciciosARANZA ALIAGA CARHUAMACAAún no hay calificaciones
- Colección de Problemas TTyTC - 2020 - 2021Documento12 páginasColección de Problemas TTyTC - 2020 - 2021Laura VercherAún no hay calificaciones
- Balance Masico y Energetico-Tarea 5Documento19 páginasBalance Masico y Energetico-Tarea 5Angelo LopezAún no hay calificaciones
- Discusion 5Documento3 páginasDiscusion 5elbetoavila0% (2)
- Taller Termodinamica Preguntas y ProblemasDocumento11 páginasTaller Termodinamica Preguntas y ProblemasAnna RobbinsAún no hay calificaciones
- 3-Guia Determinacion Capacidad CalorificaDocumento4 páginas3-Guia Determinacion Capacidad CalorificaJhony PosadaAún no hay calificaciones
- Calorimetria MiaDocumento6 páginasCalorimetria MiaEliecer GonzalezAún no hay calificaciones
- Física 2 - Guía 7 - 1er Principio TermoDocumento4 páginasFísica 2 - Guía 7 - 1er Principio TermoTamara FigueroaAún no hay calificaciones
- FQ1 - Relación General de Problemas - 2014!09!09Documento25 páginasFQ1 - Relación General de Problemas - 2014!09!09scrjonAún no hay calificaciones
- Gua N1 Termodinmica 2015Documento9 páginasGua N1 Termodinmica 2015Elías Raphael Rubilar BugueñoAún no hay calificaciones
- Cambios Termicos de Un Sistema 1Documento12 páginasCambios Termicos de Un Sistema 1Jesus Durango100% (1)
- Guía de TermodinámicaDocumento9 páginasGuía de TermodinámicaJavier CortésAún no hay calificaciones
- Prob. Cap 1.3Documento2 páginasProb. Cap 1.3Erika ElizabethAún no hay calificaciones
- Problem As MinasDocumento17 páginasProblem As MinasDaniel GaeteAún no hay calificaciones
- Taller 3 - TermodinámicaDocumento4 páginasTaller 3 - TermodinámicavanegasmarinAún no hay calificaciones
- Serie de Ejercicios Segunda LeyDocumento3 páginasSerie de Ejercicios Segunda LeyLuisCharrisAún no hay calificaciones
- Practica 3 TermoquimicaDocumento9 páginasPractica 3 TermoquimicaLiAún no hay calificaciones
- Informe de Laboratorio FisicoquimicaDocumento10 páginasInforme de Laboratorio FisicoquimicaCARMENZAAún no hay calificaciones
- Termodinamica 2 C 15Documento8 páginasTermodinamica 2 C 15Giovani Butron BordaAún no hay calificaciones
- Pluginfile PHPDocumento4 páginasPluginfile PHPErwin Brath Sierra0% (1)
- Guía 2 PDFDocumento3 páginasGuía 2 PDFsebastian villegasAún no hay calificaciones
- Quimica Física2Documento22 páginasQuimica Física2Luis Galarreta LedesmaAún no hay calificaciones
- Lt-p5 Capacidad Calor - Fica de Granos ComestiblesDocumento10 páginasLt-p5 Capacidad Calor - Fica de Granos ComestiblesJohan Javier Suarez Tirano0% (1)
- 3er Laboratorio de FisicoquimicaDocumento13 páginas3er Laboratorio de FisicoquimicaElizabeth Troncos100% (1)
- Termofluidos Talleres 2 2019 (1-5)Documento5 páginasTermofluidos Talleres 2 2019 (1-5)Daniel Neira Tapia0% (1)
- Lista 1-F2 - 07 - Temperaura - CalorDocumento2 páginasLista 1-F2 - 07 - Temperaura - CalorGiancarlo CcosccoAún no hay calificaciones
- FQPractica 1-CALORIMETRÍADocumento8 páginasFQPractica 1-CALORIMETRÍAAlfred VGAún no hay calificaciones
- Hoja de Problemas Nº4 2016Documento2 páginasHoja de Problemas Nº4 2016Madrid MadridAún no hay calificaciones
- Informe 1 Qca FisicaDocumento6 páginasInforme 1 Qca FisicaMatilde Santibáñez MéndezAún no hay calificaciones
- Guía de Laboratorio 3Documento11 páginasGuía de Laboratorio 3TIFANNY NICOLE DE LA CRUZ YANACAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Capitulo 8.2 Proyeccion AxonometricaDocumento8 páginasCapitulo 8.2 Proyeccion AxonometricaKlever TiguaAún no hay calificaciones
- B-Diseño Del Producto y ProcesoDocumento21 páginasB-Diseño Del Producto y ProcesoNorka Cecilia Puma MarcosAún no hay calificaciones
- Marco Teorico 1.2Documento32 páginasMarco Teorico 1.2Anonymous a1tsaC6yQiAún no hay calificaciones
- Explorando La Educación CristianaDocumento24 páginasExplorando La Educación CristianaCarolina RodriguezAún no hay calificaciones
- 11.agitación Spciomotora, Tec y Clozapina, Sala Aislamiento, Tamara Camposano y ColsDocumento9 páginas11.agitación Spciomotora, Tec y Clozapina, Sala Aislamiento, Tamara Camposano y ColsGiselle Elizabeth Ordenes PiñaAún no hay calificaciones
- La Nueva Economia Institucional Douglas NorthDocumento6 páginasLa Nueva Economia Institucional Douglas NorthCésar HigaAún no hay calificaciones
- Espuma CloradaDocumento8 páginasEspuma CloradaMiguel AlvarezAún no hay calificaciones
- Portafolio PropuestaDocumento2 páginasPortafolio PropuestaTata RiveraAún no hay calificaciones
- Procedimiento Constructivo Pilotes Preexcavados - GeofortisDocumento5 páginasProcedimiento Constructivo Pilotes Preexcavados - Geofortismarcelo rojas villazon100% (1)
- Mantención de Tarjetas de Crédito: ¿Conoces Sus Cobros?Documento3 páginasMantención de Tarjetas de Crédito: ¿Conoces Sus Cobros?JavieraAún no hay calificaciones
- Semilleros de InvestigaciónDocumento2 páginasSemilleros de Investigaciónfcs20100320Aún no hay calificaciones
- Anamnesis Niños y AdolescentesDocumento11 páginasAnamnesis Niños y AdolescentesAndrea GarcíaAún no hay calificaciones
- Catalogo Aire BluelineDocumento40 páginasCatalogo Aire BluelineJulio Cesar Duque ArévaloAún no hay calificaciones
- 1 - Mapeo Geológico para Estimar Potencial Recursos - J.C.Marquardt - Colegio Geólogos Chile PDFDocumento37 páginas1 - Mapeo Geológico para Estimar Potencial Recursos - J.C.Marquardt - Colegio Geólogos Chile PDFtjuang garces martinezAún no hay calificaciones
- Sistema Tridimensional 2Documento15 páginasSistema Tridimensional 2DAVID ESTEBEN CHAPARRO FOREROAún no hay calificaciones
- COMPETENCIA-Escribe Diversos Tipos de Textos en Lengua MaternaDocumento2 páginasCOMPETENCIA-Escribe Diversos Tipos de Textos en Lengua MaternaNicol Raquel Zegarra Calsina100% (3)
- Mapa Conceptual Derecho ColectivoDocumento2 páginasMapa Conceptual Derecho ColectivoMaria J Hernandez ChavezAún no hay calificaciones
- Ley #545 de Seguridad en La Construcción en BoliviaDocumento49 páginasLey #545 de Seguridad en La Construcción en BoliviaEmilio Jose Andia AbregiAún no hay calificaciones
- Apuntes de Movimiento de Tierras PDFDocumento397 páginasApuntes de Movimiento de Tierras PDFLMAún no hay calificaciones
- Supervia Poniente Anulan AutorizaciónDocumento2 páginasSupervia Poniente Anulan AutorizaciónLuis Fernando GarciaAún no hay calificaciones
- Toaz - Info Manual Guia de Radiestesia y Geobiologia2doc PRDocumento33 páginasToaz - Info Manual Guia de Radiestesia y Geobiologia2doc PRPedro Martínez100% (1)
- Actividad - Extraordinaria - RomanceamientoDocumento4 páginasActividad - Extraordinaria - RomanceamientoMarisa ZepedaAún no hay calificaciones
- 15 AlonsoDocumento12 páginas15 AlonsoSilvia E. Maciel CamachoAún no hay calificaciones
- Clase 1 - Medicina PreventivaDocumento32 páginasClase 1 - Medicina PreventivaMelissa CastañoAún no hay calificaciones
- 12 Transgressions Cap 9-12Documento21 páginas12 Transgressions Cap 9-12William RosadoAún no hay calificaciones
- Tarea #2 de Sociologia de La EducacionDocumento4 páginasTarea #2 de Sociologia de La Educacionjaime jimenez100% (2)
- Tema4 2018 19 AdeDocumento56 páginasTema4 2018 19 AdeleontaiperAún no hay calificaciones
- Guía de Calc (Segunda Edición)Documento144 páginasGuía de Calc (Segunda Edición)Rupert Parsons94% (18)
- Entrevista Con AdolesentesDocumento5 páginasEntrevista Con AdolesentesPatty LopezAún no hay calificaciones
- WeiDocumento1 páginaWeiEnzo Grillo RaffoAún no hay calificaciones