0% encontró este documento útil (0 votos)
413 vistas5 páginasEjercicios de Concentración de Soluciones
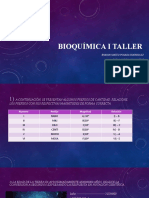
Los problemas propuestos involucran cálculos de concentración (molaridad, porcentaje en masa, gramos por litro) para diversas disoluciones. Se pide determinar estas cantidades a partir de la masa del soluto y volumen de la disolución, o a partir de la densidad de la disolución, considerando las masas atómicas de los elementos involucrados.
Cargado por
PetterDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
413 vistas5 páginasEjercicios de Concentración de Soluciones
Los problemas propuestos involucran cálculos de concentración (molaridad, porcentaje en masa, gramos por litro) para diversas disoluciones. Se pide determinar estas cantidades a partir de la masa del soluto y volumen de la disolución, o a partir de la densidad de la disolución, considerando las masas atómicas de los elementos involucrados.
Cargado por
PetterDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd