Documentos de Académico
Documentos de Profesional
Documentos de Cultura
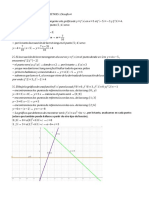
Solución:: Z P X:1s N 4 Periodo 4 Subnivel SD 2+8 10 Grupo VIII B
Cargado por
ANTHONY MICHAEL ROJAS ALIAGADescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Solución:: Z P X:1s N 4 Periodo 4 Subnivel SD 2+8 10 Grupo VIII B
Cargado por
ANTHONY MICHAEL ROJAS ALIAGACopyright:
Formatos disponibles
18.
Dada la configuración electrónica del ion:
X3+: 1s2 2s2 2p6 3s2 3p6 4s2 3d5
¿El número atómico y grupo al que pertenece el elemento X es?
−¿+3= (2+ 2+ 6+ 2+6 +2+ 5) +3=28¿
Solución: z= p+¿=e ¿
X :1 s 2 2 s 2 2 p6 3 s 2 3 p6 4 s2 3 d 8→ n=4 → periodo=4
subnivel=sd
→ 2+ 8=10 → grupo=VIII B
∴ z=28 , pertenece al grupo VIII B
19.El número de orbitales atómicos vacíos que presenta un elemento que se encuentra en el
grupo IIIA y tercer periodo de la tabla periódica, es:
Solución:
periodo=3 → n=3
−¿=3 ¿
grupo IIIA → e valencia
subnivel=sp
2 2 6 2 1
X :1 s 2 s 2 p 3 s 3 p
∴ el subnivel p tiene 3 orbitales , con un electrón en él tiene 2 orbitales vacios
20.Un ion dipositivo de un elemento X es isoelectrónico con otro ion Y 4+ que se encuentra en el
quinto periodo y en el grupo VB. El grupo de la tabla periódica moderna donde se encuentra el
elemento X es:
Solución: para Y
periodo=5 → n=5
−¿=5 ¿
grupo VB→ e valencia
subnivel=sd
2 2 6 2 6 2 10 6 2 3
Y :1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d
4 +¿: ¿ −¿=41−4 =37 ¿
−¿=41 →Y e ¿
Y :¿ e
Tenemos que X +2 y Y 4+ ¿¿ son isoelectrónicos, tienen la misma cantidad de electrones
−¿¿
+2 −¿→ X tiene 39 e ¿
X tiene 37 e
2 2 6 2 6 2 10 6 2 1
X :1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d
→ n=5 → periodo=5
subnivel=sd
→ 2+ 1=3 → grupo=III B
∴ pertenece al grupo III B
También podría gustarte
- FORO 2 Ecuaciones DiferencialesDocumento5 páginasFORO 2 Ecuaciones DiferencialesFrancisco Javier Sanchez AriasAún no hay calificaciones
- Tarea 02 - Tabla PeriódicaDocumento8 páginasTarea 02 - Tabla PeriódicaANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Ejercicios Propuestos de QuimicaDocumento5 páginasEjercicios Propuestos de QuimicaDanielAún no hay calificaciones
- Teoria Semana 3Documento3 páginasTeoria Semana 3MIGUEL RIVASPLATAAún no hay calificaciones
- D18 - 2021-2 - Ayg - Secciones Conicas 1Documento22 páginasD18 - 2021-2 - Ayg - Secciones Conicas 1Lennyn AmirAún no hay calificaciones
- Ejercicios Resueltos de Calvache Edicion 2017Documento7 páginasEjercicios Resueltos de Calvache Edicion 2017Mateo Nicolas Tapia Aguirre50% (2)
- Basico 2023 - Ii Sesion 19 - Circun - Parab - 2Documento57 páginasBasico 2023 - Ii Sesion 19 - Circun - Parab - 2Gabriela JQAún no hay calificaciones
- 4 Ecuaciones Dif 2do Orden HomogeneasDocumento22 páginas4 Ecuaciones Dif 2do Orden HomogeneasTobias LeguizamonAún no hay calificaciones
- SolucióndefDocumento5 páginasSolucióndefAinhoa MartínezAún no hay calificaciones
- Solucion 5to Parcial de Álgebra-Prueba EscritaDocumento2 páginasSolucion 5to Parcial de Álgebra-Prueba EscritaniurkaAún no hay calificaciones
- 2do Bachillerato Tronco Comun Proyecto 6 Semana 12Documento13 páginas2do Bachillerato Tronco Comun Proyecto 6 Semana 12Kuri AlvaradoAún no hay calificaciones
- PRACTICA DIRIGIDA #03 Polinomios y OperacionesDocumento1 páginaPRACTICA DIRIGIDA #03 Polinomios y OperacionesIvette RuizAún no hay calificaciones
- Casos de FactorizaciónDocumento6 páginasCasos de Factorizaciónjonathan jaci caleroAún no hay calificaciones
- Miscelanea Mas ProblemasDocumento6 páginasMiscelanea Mas ProblemasBrosskidAún no hay calificaciones
- Matematica Avanzada Ii Práctica Semana 4: Universidad Nacional Del SantaDocumento32 páginasMatematica Avanzada Ii Práctica Semana 4: Universidad Nacional Del SantaGerardo FeijoóAún no hay calificaciones
- M06. Diofant Dalexandria. LAritmètica (DS)Documento12 páginasM06. Diofant Dalexandria. LAritmètica (DS)kakuz4everAún no hay calificaciones
- Módulo #8Documento14 páginasMódulo #8Drastic GamerAún no hay calificaciones
- Nanfuñay Chancafe Jorge GiancarloDocumento5 páginasNanfuñay Chancafe Jorge Giancarloprince zamudioAún no hay calificaciones
- Reducción de Cuádricas A La Forma Normal PDFDocumento2 páginasReducción de Cuádricas A La Forma Normal PDFCarolina RuizAún no hay calificaciones
- Familia de RectasDocumento2 páginasFamilia de RectasCesar DCAún no hay calificaciones
- Taller 4Documento4 páginasTaller 4juan pablo rojasAún no hay calificaciones
- Solución: Paso 1: Hallar Solución ComplementariaDocumento5 páginasSolución: Paso 1: Hallar Solución ComplementariaFranco Joel Pacheco AgapitoAún no hay calificaciones
- Tarea Mate Aplicación MultivariableDocumento26 páginasTarea Mate Aplicación MultivariableJuan Diego Castro ArevaloAún no hay calificaciones
- REPASO PC02 - Verano 2024Documento2 páginasREPASO PC02 - Verano 2024miguelangel201720162015Aún no hay calificaciones
- Álgebra Sem-04Documento2 páginasÁlgebra Sem-04Adriana RaymundoAún no hay calificaciones
- Control8 C3 (PAUTA)Documento3 páginasControl8 C3 (PAUTA)Bastian Vargas RiveraAún no hay calificaciones
- Ejercicio 3Documento3 páginasEjercicio 3Andrea CastilloAún no hay calificaciones
- Actividad #2 de MatemáticasDocumento7 páginasActividad #2 de MatemáticasmelissaAún no hay calificaciones
- Examen Primera Unidad - Matematica Avanzada IDocumento3 páginasExamen Primera Unidad - Matematica Avanzada IANDERSON BOCANEGRA TORREAún no hay calificaciones
- Mate 6 DESAFIO 4 Y 6Documento5 páginasMate 6 DESAFIO 4 Y 6Paolo De Los Santos NonatoAún no hay calificaciones
- Muestra Sup Matem 2020 PDFDocumento9 páginasMuestra Sup Matem 2020 PDFJose GarciaAún no hay calificaciones
- 15 - Ecuaciones Diferenciales de Segundo OrdenDocumento3 páginas15 - Ecuaciones Diferenciales de Segundo Orden5A Caranta PabloAún no hay calificaciones
- 5 Ecuaciones Dif 2do Orden Coef IndetDocumento27 páginas5 Ecuaciones Dif 2do Orden Coef Indetemanuel leivaAún no hay calificaciones
- Hoja de Trabajo 00 Actividad de Repaso - 227841412Documento6 páginasHoja de Trabajo 00 Actividad de Repaso - 227841412Domenica MuñozAún no hay calificaciones
- Módulo 2 Sistemas de CoordenadasDocumento30 páginasMódulo 2 Sistemas de CoordenadasAnthony Villar YallicoAún no hay calificaciones
- Alvaro H SalasDocumento18 páginasAlvaro H SalasDavid ArboledasAún no hay calificaciones
- Calculo Curva en El EspacioDocumento37 páginasCalculo Curva en El Espacioelizabeth paola martinezAún no hay calificaciones
- Guia Tercero Medio Ecuaciones de 2 GradoDocumento1 páginaGuia Tercero Medio Ecuaciones de 2 GradoNelson LaraAún no hay calificaciones
- Taller 1, Tercer CorteDocumento3 páginasTaller 1, Tercer Corteshirley leonAún no hay calificaciones
- Ejercicios de CalculoDocumento5 páginasEjercicios de CalculoCAROLINE FIORELLA BENAVIDES PONCEAún no hay calificaciones
- Examen Matemática BásicaDocumento10 páginasExamen Matemática BásicaCarlos RodriguezAún no hay calificaciones
- d20 2021-2 Ayg Aplicaciones de Secciones ConicasDocumento24 páginasd20 2021-2 Ayg Aplicaciones de Secciones ConicasLennyn AmirAún no hay calificaciones
- 2020-1 - Ayg - Adm - Cónicas - Circunferencia y ParabolaDocumento23 páginas2020-1 - Ayg - Adm - Cónicas - Circunferencia y ParabolaJulio Ernesto Montero BenavidesAún no hay calificaciones
- Wa0003Documento105 páginasWa0003jhezabel belmonteAún no hay calificaciones
- Problemas Resueltos de ElectromagnetismoDocumento5 páginasProblemas Resueltos de ElectromagnetismoLeonardo Messi GuerreroAún no hay calificaciones
- Números CuánticosDocumento10 páginasNúmeros CuánticosCecilia Maribel Rios GarabitoAún no hay calificaciones
- La PárabolaDocumento14 páginasLa PárabolaDARLIN STHEYNER BARDALES GUEVARAAún no hay calificaciones
- Complejos 1Documento6 páginasComplejos 1Samuel PajaroAún no hay calificaciones
- Full Practica Ap 02Documento1 páginaFull Practica Ap 02ESTHER FATIMA HUAYNA HUANCAAún no hay calificaciones
- PEP 3 - Cálculo Avanzado (2009)Documento3 páginasPEP 3 - Cálculo Avanzado (2009)JuanAún no hay calificaciones
- Solución Examen Segundo Bimestre 22 Febrero de 2022Documento5 páginasSolución Examen Segundo Bimestre 22 Febrero de 2022Aaron CuzcoAún no hay calificaciones
- Solucionario 2do Parcial Mat100Documento5 páginasSolucionario 2do Parcial Mat100Emerson Wilgen Apaza LopezAún no hay calificaciones
- Diego Luis Montaño Lovera - Producto Final - Up - DiplomaDocumento16 páginasDiego Luis Montaño Lovera - Producto Final - Up - DiplomaDIEGOAún no hay calificaciones
- Cardan e Ferrari 1Documento2 páginasCardan e Ferrari 1Paulo C CampeloAún no hay calificaciones
- Guía CónicasDocumento26 páginasGuía CónicasNolimar GonzalezAún no hay calificaciones
- Matematica 1 - Rosario Oblitas Melzi MelinaDocumento21 páginasMatematica 1 - Rosario Oblitas Melzi MelinaRoger PalaciosAún no hay calificaciones
- Clases Cal Culo 3Documento61 páginasClases Cal Culo 3Ian HernanAún no hay calificaciones
- Mgan2 U2 A3 V1 NofpDocumento5 páginasMgan2 U2 A3 V1 NofpNorberto FerralesAún no hay calificaciones
- Mvco1 U1 A2 RaicDocumento5 páginasMvco1 U1 A2 RaicRaúl SánchezAún no hay calificaciones
- UmDocumento7 páginasUmangelojosebaeAún no hay calificaciones
- La ecuación general de segundo grado en dos y tres variablesDe EverandLa ecuación general de segundo grado en dos y tres variablesAún no hay calificaciones
- Tarea 1 QuimicaDocumento7 páginasTarea 1 QuimicaANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Tabla Periódica - NeciosupDocumento1 páginaTabla Periódica - NeciosupANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Trabajo-Tics-Grupo y Ligas A Determinar EstadisticasDocumento2 páginasTrabajo-Tics-Grupo y Ligas A Determinar EstadisticasANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Fisica AvanzeDocumento4 páginasFisica AvanzeANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Lab Sesión 02 - Medición y ErroresDocumento2 páginasLab Sesión 02 - Medición y ErroresANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Tarea de Quimica 3.Documento6 páginasTarea de Quimica 3.ANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Fisica Error y MedicionDocumento11 páginasFisica Error y MedicionANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- V = π d V = π (18,22 mm) V =3166,97 mm: - Esfera (Volumen)Documento1 páginaV = π d V = π (18,22 mm) V =3166,97 mm: - Esfera (Volumen)ANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Fisica Imforme 3Documento8 páginasFisica Imforme 3ANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Sesión 04 - Factores y Fases de La CreatividadDocumento24 páginasSesión 04 - Factores y Fases de La CreatividadANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones
- Taller 05cDocumento3 páginasTaller 05cANTHONY MICHAEL ROJAS ALIAGAAún no hay calificaciones