100% encontró este documento útil (1 voto)
2K vistas21 páginasTarea Unidad III Alcoholes
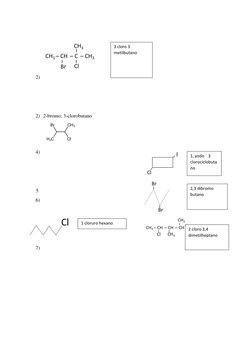
El documento habla sobre halogenuros de alquilo y sus propiedades y usos. Explica la estructura general de los halogenuros de alquilo y cómo se clasifican dependiendo del halógeno y la posición del grupo alquilo. También menciona algunos usos comunes como solventes industriales y plaguicidas.
Cargado por
Ureña Almanzar DarlinaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
100% encontró este documento útil (1 voto)
2K vistas21 páginasTarea Unidad III Alcoholes
El documento habla sobre halogenuros de alquilo y sus propiedades y usos. Explica la estructura general de los halogenuros de alquilo y cómo se clasifican dependiendo del halógeno y la posición del grupo alquilo. También menciona algunos usos comunes como solventes industriales y plaguicidas.
Cargado por
Ureña Almanzar DarlinaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd