Documentos de Académico
Documentos de Profesional
Documentos de Cultura
DILUCIÓN ÁCIDO CLORHÍDRICO
Cargado por
Ezequiel Garcés0 calificaciones0% encontró este documento útil (0 votos)
118 vistas1 páginaTítulo original
Tabla de Conversion de Hcl Al 4%
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
118 vistas1 páginaDILUCIÓN ÁCIDO CLORHÍDRICO
Cargado por
Ezequiel GarcésCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
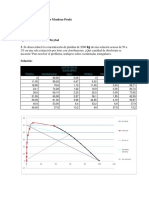
ÁCIDO CLORHÍDRICO Hcl
(Rebajar la concentración al 4%)
Concentración
Densidad Para obtener 100 ml de disolución al 4%
de partida
% ρ : kg/l ml HCL (Químicamente puro) ml Agua destilada
10 1,048 38,88 61,12
20 1,098 18,55 81,45
21 1,103 17,58 82,42
22 1,108 16,71 83,29
23 1,113 15,91 84,09
24 1,118 15,17 84,83
25 1,123 14,50 85,50
26 1,128 13,88 86,12
30 1,148 11,82 88,18
31 1,153 11,39 88,61
32 1,16 10,96 89,04
33 1,165 10,59 89,41
34 1,17 10,23 89,77
35 1,175 9,89 90,11
36 1,18 9,58 90,42
37 1,185 9,28 90,72
38 1,19 9,00 91,00
Conceptos y fórmulas:
Disolución: Soluto + Disolvente
Soluto: Ácido clorhídrico
Disolvente: Agua destilada a añadir
Si multiplicamos la disolución por la densidad tenemos la masa de la disolución.
Si aplicamos el porcentaje de concentración a la masa de la disolución, obtenemos la cantidad de
soluto de la disolución.
masa de soluto
La fórmula general del porcentaje: %= ×100
masade la disolución+ disolvente
Ejemplo: para rebajar al 4% una disolución 14,5 ml de HCl que tiene una concentración del 25%
Masa de la disolución: 14,5 x 1,123 = 16,29 gr
Masa del soluto : 16,29 x 25% = 4,07 gr
De la fórmula despejamos el disolvente (agua destilada)
masa soluto−(0,04⋅masa de disolución) 4,07−(0,04⋅16,29)
Disolvente= =85,5 ml
0,04 0,04
Para 100 ml de disolución al 4 % empleamos esta fórmula:
−400
Disolución=
( 4⋅Densidad)−(Densidad⋅Concentración)−4
al resultado añadimos los ml de agua destilada hasta llegar a los 100 ml
También podría gustarte
- 5 Ejercicios de Molaridad, 5 % PesoDocumento5 páginas5 Ejercicios de Molaridad, 5 % PesoYosmery SánchezAún no hay calificaciones
- Ejerciciso de P/V P/PDocumento5 páginasEjerciciso de P/V P/PSamuel Velasquez Navia100% (2)
- So Luci OnesDocumento17 páginasSo Luci OnesSamantha mesaAún no hay calificaciones
- Tarea 9 Refractometría y PolarimetríaDocumento3 páginasTarea 9 Refractometría y PolarimetríaElena CAún no hay calificaciones
- Lab 3. Soluciones y Expresiones de La ConcentracionDocumento11 páginasLab 3. Soluciones y Expresiones de La Concentraciondilmerarias100% (2)
- Soluciones Quimicas PDFDocumento11 páginasSoluciones Quimicas PDFAlex Arbey Quiroga MedinaAún no hay calificaciones
- Soluciones químicas: concentraciones y dilucionesDocumento11 páginasSoluciones químicas: concentraciones y dilucionesPEDRO LUIS DAJOME ESCOBARAún no hay calificaciones
- Soluciones QuimicasDocumento11 páginasSoluciones QuimicasMartin DiazAún no hay calificaciones
- Soluciones Quimicas PDFDocumento11 páginasSoluciones Quimicas PDFguido colqueAún no hay calificaciones
- Taller 3 QuimicaDocumento4 páginasTaller 3 QuimicaAndrés Tarazona GamboaAún no hay calificaciones
- Soluciones Quimicas PDFDocumento11 páginasSoluciones Quimicas PDFraul portilloAún no hay calificaciones
- Soluciones QuimicasDocumento11 páginasSoluciones QuimicasAlejandra HernandezAún no hay calificaciones
- Soluciones QuimicasDocumento11 páginasSoluciones QuimicasSHARON ANDREA VALENCIA VELANDIAAún no hay calificaciones
- Semana 11 SolucionesDocumento35 páginasSemana 11 SolucionesJhon HSAún no hay calificaciones
- Reducción aw puré sacarosaDocumento5 páginasReducción aw puré sacarosaJuan Molina0% (3)
- 4.2 Concentración de SolucionesDocumento31 páginas4.2 Concentración de SolucionesDanny Bolaños ChavezAún no hay calificaciones
- 10-3 Traybal 7-6 TojoDocumento3 páginas10-3 Traybal 7-6 TojoD01Aún no hay calificaciones
- PorcentajesDocumento8 páginasPorcentajesreny wattsAún no hay calificaciones
- Análisis de concentración de NaHCO3 en Alka-Seltzer y densidad de solucionesDocumento8 páginasAnálisis de concentración de NaHCO3 en Alka-Seltzer y densidad de solucionesYasmin RassoulAún no hay calificaciones
- Ejercicios Molaridad Moladidad NormalidadDocumento10 páginasEjercicios Molaridad Moladidad Normalidadcesar sanchez100% (1)
- Lab. #6 y 7 Preparación de SolucionesDocumento46 páginasLab. #6 y 7 Preparación de SolucionesOscar Solórzano HuancaAún no hay calificaciones
- SOLUCIONES: CLASIFICACIÓN Y CONCENTRACIÓNDocumento6 páginasSOLUCIONES: CLASIFICACIÓN Y CONCENTRACIÓNAlfred YanaAún no hay calificaciones
- JDJDDocumento3 páginasJDJDfrangmez30Aún no hay calificaciones
- Concentracion de Las SolucionesDocumento10 páginasConcentracion de Las SolucionesSharick CaballeroAún no hay calificaciones
- Trabajo de Química: Ejercicios de densidad, masa, volumen y conversión de unidadesDocumento4 páginasTrabajo de Química: Ejercicios de densidad, masa, volumen y conversión de unidadesCarlos FinquinAún no hay calificaciones
- Práctica 4 - Densidad y Curva de CalibraciónDocumento10 páginasPráctica 4 - Densidad y Curva de CalibraciónFERNANDO ALFONSO PATIÑO RODRÍGUEZAún no hay calificaciones
- Inform Eci Clo He XenoDocumento12 páginasInform Eci Clo He XenoManuel MendozaAún no hay calificaciones
- Soluciones y concentracionesDocumento35 páginasSoluciones y concentracionesBetoAún no hay calificaciones
- Determinación de densidades y viscosidades de soluciones salinas y aceiteDocumento9 páginasDeterminación de densidades y viscosidades de soluciones salinas y aceitebeatris sacaAún no hay calificaciones
- Informe 3Documento7 páginasInforme 3Diana Estefania Quillupangui ChAún no hay calificaciones
- Pre Laboratorio 4Documento4 páginasPre Laboratorio 4Malu AndinoAún no hay calificaciones
- SolucionesDocumento13 páginasSolucionesWIDOLSON GERALD ESQUIVIAS TORRESAún no hay calificaciones
- Calibración de material volumétricoDocumento7 páginasCalibración de material volumétricoAl PinoAún no hay calificaciones
- SolucionesDocumento5 páginasSolucionesdidyego256Aún no hay calificaciones
- Cálculos de concentración química: molaridad, molalidad, %p/p y %v/vDocumento8 páginasCálculos de concentración química: molaridad, molalidad, %p/p y %v/vdelfina mariaAún no hay calificaciones
- FMH - Chi - 2014.-SolucionesDocumento96 páginasFMH - Chi - 2014.-SolucionesSergio Leonel Moran StechmannAún no hay calificaciones
- Concentraciones SolucionesDocumento2 páginasConcentraciones Solucionespietroki100% (2)
- Tema 2. LAS SOLUCIONES - PH Y SOLUCIONES REGULADORASDocumento64 páginasTema 2. LAS SOLUCIONES - PH Y SOLUCIONES REGULADORASFrancisco Vega JimenezAún no hay calificaciones
- DensidadLíquidosDocumento8 páginasDensidadLíquidosBeimar PeñaAún no hay calificaciones
- Informe de Sólidos SuspendidosDocumento3 páginasInforme de Sólidos SuspendidosPablo VelásquezAún no hay calificaciones
- Capitulo Iv SolucionesDocumento8 páginasCapitulo Iv SolucionesAna Lourdez Aguilar DiazAún no hay calificaciones
- Guia Tercer Año - Tercer Lapso - NetzareDocumento12 páginasGuia Tercer Año - Tercer Lapso - NetzareJohan ParraAún no hay calificaciones
- Tarea 14 - Problemas Cap7Documento4 páginasTarea 14 - Problemas Cap7EmAún no hay calificaciones
- Soluciones Mezclas HomogeneasDocumento18 páginasSoluciones Mezclas HomogeneasI.E.S.T.P. HIPOLITO UNANUE60% (5)
- Nuestro País Tiene Tres Zonas ImportantesDocumento35 páginasNuestro País Tiene Tres Zonas Importantesrosa arayaAún no hay calificaciones
- Practica 8 "Diagrama de Equilibrio Ternario Del Sistema Tolueno-Agua - Ácido Acético"Documento12 páginasPractica 8 "Diagrama de Equilibrio Ternario Del Sistema Tolueno-Agua - Ácido Acético"Christian Serna TerronesAún no hay calificaciones
- Soluciones (9 12)Documento5 páginasSoluciones (9 12)Gabriel Vigo JaraAún no hay calificaciones
- Taller de Quimica No. 6Documento7 páginasTaller de Quimica No. 6jorge gonzalez33% (3)
- Preparación de Disoluciones QuímicasDocumento13 páginasPreparación de Disoluciones QuímicasIsa MendozaAún no hay calificaciones
- SolucionesDocumento6 páginasSolucionesGabriela DoderoAún no hay calificaciones
- Una Muestra de 135 Gramos de Agua de Mar Se Evapora A Sequedad y Queda Un Residuo de 4Documento11 páginasUna Muestra de 135 Gramos de Agua de Mar Se Evapora A Sequedad y Queda Un Residuo de 4deybi encarnacion beltreAún no hay calificaciones
- TP Contracción de Mezclas Etanol-AguaDocumento4 páginasTP Contracción de Mezclas Etanol-AguaGustavo AuzmendiaAún no hay calificaciones
- Soluciones EmpiricasDocumento18 páginasSoluciones EmpiricasNecrotemor NecrosAún no hay calificaciones
- JKDocumento7 páginasJKCristian Jesus Lopez AvilesAún no hay calificaciones
- Tema N°3Documento7 páginasTema N°3Andres RojasAún no hay calificaciones
- TallDocumento2 páginasTallShirley Maguiña anduhaga100% (1)
- Primer Examen Parcial de Quimica InorganicaDocumento6 páginasPrimer Examen Parcial de Quimica InorganicarFaridAún no hay calificaciones
- EJERCICIOS DE ELASTICIDAD Esfuerzos Minas Fisica 2 UNIVERSIDAD NACIONAL DE PIURADocumento26 páginasEJERCICIOS DE ELASTICIDAD Esfuerzos Minas Fisica 2 UNIVERSIDAD NACIONAL DE PIURARODRIGO LEANDRO NIMA MAZA50% (2)
- Insumos GeneralDocumento2 páginasInsumos GeneralMarlon Andrade VasquezAún no hay calificaciones
- Fia Arquitectura - Especificaciones TecnicasDocumento26 páginasFia Arquitectura - Especificaciones TecnicasBlanca VillalobosAún no hay calificaciones
- Preinforme EstequiometriaDocumento5 páginasPreinforme EstequiometriaJhon Sebastian Rodriguez BeltranAún no hay calificaciones
- HidratosDocumento10 páginasHidratosFelipe EduardoAún no hay calificaciones
- Bomba MoynoDocumento4 páginasBomba MoynoJose Leonel GonzalezAún no hay calificaciones
- Clasificación de NanomaterialesDocumento11 páginasClasificación de NanomaterialesLuis Alberto Romero OrellanaAún no hay calificaciones
- Ladrillo Ecologico-Tijolo PDFDocumento6 páginasLadrillo Ecologico-Tijolo PDFJGNAún no hay calificaciones
- CATALOGO Fresas-2018 PDFDocumento60 páginasCATALOGO Fresas-2018 PDFMaría Luisa Reyes OrtegaAún no hay calificaciones
- Eett Proyecto Mejoramiento Multicancha Rincón Los PeralesDocumento20 páginasEett Proyecto Mejoramiento Multicancha Rincón Los PeralesAlfredo FuentesAún no hay calificaciones
- Trabajo RefrigeracionDocumento14 páginasTrabajo RefrigeracionSteve BryamAún no hay calificaciones
- Catalogo de Conceptos Final Aulas y TalleresDocumento11 páginasCatalogo de Conceptos Final Aulas y TalleresJuan Carlos LaureanoAún no hay calificaciones
- Termodinámica: Procesos y cambios termodinámicosDocumento12 páginasTermodinámica: Procesos y cambios termodinámicosluisAún no hay calificaciones
- Hormigón Armado III - Introducción a ColumnasDocumento16 páginasHormigón Armado III - Introducción a Columnasdennys perezAún no hay calificaciones
- Ficha ThermafiberDocumento2 páginasFicha ThermafiberHenri AlvaradoAún no hay calificaciones
- 4 DamDocumento8 páginas4 DamAnyi SueldoAún no hay calificaciones
- Analisis LitologicoDocumento9 páginasAnalisis Litologicosaul VerverAún no hay calificaciones
- Solemnes InstrumentalDocumento11 páginasSolemnes InstrumentalLeonidas LarrondoAún no hay calificaciones
- Clase 4 Aire AcondicionadoDocumento24 páginasClase 4 Aire AcondicionadoMaria Mercedes MirandaAún no hay calificaciones
- Conarcrom 600 PDFDocumento5 páginasConarcrom 600 PDFDouglas Quinteros AvelarAún no hay calificaciones
- Materiales SemiconductoresDocumento16 páginasMateriales SemiconductoresDiana AlboresAún no hay calificaciones
- Capítulo 15A - Grupo 3 - Ciencia de Los MaterialesDocumento2 páginasCapítulo 15A - Grupo 3 - Ciencia de Los MaterialesRolexAún no hay calificaciones
- Análisis Estructural e Mecánico de ImplantesDocumento4 páginasAnálisis Estructural e Mecánico de ImplantesElmer Moisés Villacorta RevillaAún no hay calificaciones
- Los Jabones - ArticuloDocumento16 páginasLos Jabones - Articulodany100% (1)
- Problemas AQI2020 - Sol2Documento6 páginasProblemas AQI2020 - Sol2Javier hernandez de la rosaAún no hay calificaciones
- Ciiu - Ica BogotaDocumento35 páginasCiiu - Ica BogotaStephany Peña MonsalveAún no hay calificaciones
- Sistema Constructivo Entramados de MaderaDocumento59 páginasSistema Constructivo Entramados de MaderaGianela Phocco MeléndezAún no hay calificaciones
- Balance de La MateriaDocumento11 páginasBalance de La MateriaJUAN CARLOS ROSALES ARANGOAún no hay calificaciones
- Caso Práctico 1 2021 2021Documento8 páginasCaso Práctico 1 2021 2021KL KevinAún no hay calificaciones
- Informe Separadores BifasicosDocumento14 páginasInforme Separadores BifasicosMaher VasquezAún no hay calificaciones