0% encontró este documento útil (0 votos)
707 vistas19 páginas2 BGU Quimica Tarea1
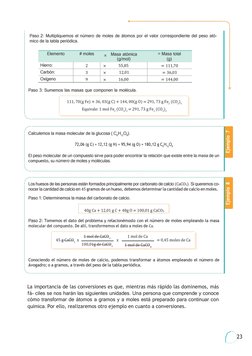
Este documento presenta información sobre química, incluyendo la ecuación de conversión, el mol y el número de Avogadro, conversiones entre gramos, moles y átomos, y balanceo de ecuaciones químicas.
Cargado por
Andy TabaresDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
707 vistas19 páginas2 BGU Quimica Tarea1
Este documento presenta información sobre química, incluyendo la ecuación de conversión, el mol y el número de Avogadro, conversiones entre gramos, moles y átomos, y balanceo de ecuaciones químicas.
Cargado por
Andy TabaresDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd