Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Taller #4 - 2020
Cargado por
Jose LozanoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Taller #4 - 2020
Cargado por
Jose LozanoCopyright:
Formatos disponibles
UNIVERSIDAD DE GUAYAQUIL
FACULTAD DE INGENIERÍA QUÍMICA
INGENIERÍA DE LAS REACCIONES
Ing. Stefanie Bonilla Bermeo, Msc.
TALLER #4
1. Se sabe que la velocidad de descomposición de un óxido de nitrógeno se hace cinco veces
mayor al efectuar la reacción a 50 C en vez de a 10 C. ¿Cuál es la energía de activación de la
reacción? Dato = R = 1,98 cal/mol·K
2. 4. A 300 C la constante de velocidad de la reacción de obtención de H2C=CH-CH3 es 2.41 X 10
-10
s-1 y a 400 C es 1.16 X 10-6 s-1. ¿Cuáles son los valores de la energía de activación y del
factor de Arrhenius para esta reacción? Dato: R = 8,314 J/mol·K.
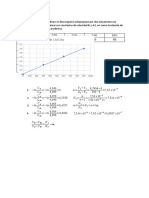
3. Determinar el valor de [I2] para la reacción :
2HI K1 H2+I2
K2
a) Cuando la constante de equilibrio es 0,3 y las concentraciones de un 1 litro de mezcla son HI
= 0,5 mol, H2= 1 mol.
b) Cuál se será la velocidad de desaparición de I2 si la constante de velocidad es 2,5 x 10 -3 L/s
mol
4. La pirólisis del etano tiene lugar con una energía de activación de E= 75000 cal.
Calcúlese el aumento relativo de la velocidad de descomposición a 650 °C con relación
a 500°C
5. La velocidad de una reacción química se cuadriplica cuando pasamos de 290 a 312 K.
(Considerar que las concentraciones permanecen constantes). Cuál es la energía de
activación?
También podría gustarte
- Taller #4 - 2020Documento5 páginasTaller #4 - 2020Ana Arias Torres100% (1)
- Quimica General FRP Utn Guia de Problemas-Cinetica Y Equilibrio Quimico-Tema 8Documento4 páginasQuimica General FRP Utn Guia de Problemas-Cinetica Y Equilibrio Quimico-Tema 8Juan Martín CastroAún no hay calificaciones
- Prob 5Documento4 páginasProb 5Enrique BeckerAún no hay calificaciones
- Tarea 3Documento2 páginasTarea 3jose ospinaAún no hay calificaciones
- Guía de Ejercicios Unidad 4 Julio2023Documento2 páginasGuía de Ejercicios Unidad 4 Julio2023kinteroplayAún no hay calificaciones
- 03 Termoquímica y Equilibrio-2Documento27 páginas03 Termoquímica y Equilibrio-2David Gasco DobonAún no hay calificaciones
- QUI2BAC Tema 2 Cinetica Quimica ProblemasDocumento2 páginasQUI2BAC Tema 2 Cinetica Quimica ProblemasEstela RomeroAún no hay calificaciones
- Tarea 3Documento2 páginasTarea 3BYRON WLADIMIR BOLAÑOS MEJIAAún no hay calificaciones
- Problemas Resueltos Cinetica QuimicaDocumento12 páginasProblemas Resueltos Cinetica QuimicaPedro Ángel AlcántaraAún no hay calificaciones
- Problemas de Cinética QuímicaDocumento6 páginasProblemas de Cinética QuímicaKarima SaidiAún no hay calificaciones
- Guia Ejercicios 3 Certamen IQMADocumento3 páginasGuia Ejercicios 3 Certamen IQMAgisel valdebenitoAún no hay calificaciones
- Deber Entalpia PDFDocumento4 páginasDeber Entalpia PDFkellyAún no hay calificaciones
- Entrenamiento 1 para La PC1-QI-3Documento2 páginasEntrenamiento 1 para La PC1-QI-3DavidCapchaSosaAún no hay calificaciones
- P1 CineticaDocumento7 páginasP1 CineticaAnonymous spna8hAún no hay calificaciones
- Preguntas Quimica - Marzo - 2023Documento8 páginasPreguntas Quimica - Marzo - 2023Kristell MonserrateAún no hay calificaciones
- Taller 5Documento3 páginasTaller 5AndrésAún no hay calificaciones
- Examen Parcial (Seminario)Documento2 páginasExamen Parcial (Seminario)Francis David Cabrejos RamosAún no hay calificaciones
- Ex Parcial 2007 IiDocumento1 páginaEx Parcial 2007 IiLuis Fernando Chalco RamosAún no hay calificaciones
- Práctica N°1.FF-UP-V-22Documento4 páginasPráctica N°1.FF-UP-V-22educ2008Aún no hay calificaciones
- Termoquimica y CineticaDocumento5 páginasTermoquimica y CineticaCayo MartinAún no hay calificaciones
- Equilibrio QuimicoDocumento36 páginasEquilibrio QuimicoMaria Paula Viveros QuintanillaAún no hay calificaciones
- Ejercicios Bloques 3 y 4-1Documento1 páginaEjercicios Bloques 3 y 4-1Tony StarkAún no hay calificaciones
- Taller 1-2ciclo II 2021-2022Documento2 páginasTaller 1-2ciclo II 2021-2022Jose LozanoAún no hay calificaciones
- Guía Cinética QuímicaDocumento2 páginasGuía Cinética Químicatalia sartoriAún no hay calificaciones
- Ep 2021-1Documento6 páginasEp 2021-1Italo Garay TejadaAún no hay calificaciones
- Ejercicios Unidad 1Documento5 páginasEjercicios Unidad 1joayleenAún no hay calificaciones
- Problemas de EquilibrioDocumento4 páginasProblemas de EquilibrioJ . Arturo Corrales HernándezAún no hay calificaciones
- 01 Termoquimica 2014 Abril 2013Documento24 páginas01 Termoquimica 2014 Abril 2013juanbordeje0% (1)
- Actividad Química Analítica Sesión #5Documento1 páginaActividad Química Analítica Sesión #52LG EIRLAún no hay calificaciones
- Actividad Química Analítica Sesión #5Documento1 páginaActividad Química Analítica Sesión #52LG EIRLAún no hay calificaciones
- Química PAU CyL LogoDocumento46 páginasQuímica PAU CyL LogotripleaformacionAún no hay calificaciones
- Cinetica QuimicaDocumento3 páginasCinetica QuimicaNicolas Mateo Gonzalez LopezAún no hay calificaciones
- 03 - Tablas Termodinamica - Van WylenDocumento12 páginas03 - Tablas Termodinamica - Van WylenDiego Medrano Hidalgo100% (1)
- Tarea 2 Química General-20210573Documento8 páginasTarea 2 Química General-20210573Carlos JiménezAún no hay calificaciones
- Ex Quim Test Prob Marzo 2016Documento6 páginasEx Quim Test Prob Marzo 2016Luis Carrasco GarridoAún no hay calificaciones
- Cinética, Guía No 1.Documento4 páginasCinética, Guía No 1.Pablo GallardoAún no hay calificaciones
- Taller 3Documento3 páginasTaller 3Edson Diaz0% (1)
- Hoja de Problemas 12 (QGB 22-23)Documento5 páginasHoja de Problemas 12 (QGB 22-23)guesorrock 888Aún no hay calificaciones
- Ejercicios Cinética 2Documento3 páginasEjercicios Cinética 2Mayra MoralesAún no hay calificaciones
- UntitledDocumento141 páginasUntitledReymar1995Aún no hay calificaciones
- T - Taller Calificado 01 - Sem 4 - Ses 4Documento2 páginasT - Taller Calificado 01 - Sem 4 - Ses 4juancitoAún no hay calificaciones
- Cinética QuimicaDocumento15 páginasCinética QuimicaJhonny Montaño ValdiviaAún no hay calificaciones
- Taller Final Quimica IiDocumento7 páginasTaller Final Quimica IiSamuel Orozco0% (1)
- Taller de Cinética y TermoquímicaDocumento14 páginasTaller de Cinética y TermoquímicaKEVIN ALDAIR TORRES CALLAAún no hay calificaciones
- 10 FQ - Problemas Propuestos 2017B PDFDocumento3 páginas10 FQ - Problemas Propuestos 2017B PDFSergio Esteban Pantoja IbarraAún no hay calificaciones
- Propex T52 Bi 1112 AlumnoDocumento4 páginasPropex T52 Bi 1112 Alumnoalvaro_adkAún no hay calificaciones
- Problem A RioDocumento8 páginasProblem A RioMarleny Garcia LucasAún no hay calificaciones
- Taller # 1 - QA - UdeA - 02-2018Documento3 páginasTaller # 1 - QA - UdeA - 02-2018Efra MortinattoAún no hay calificaciones
- Tarea Virtual 2 CDocumento8 páginasTarea Virtual 2 CPamela EspinozaAún no hay calificaciones
- Tema 6 OK ProblemasDocumento4 páginasTema 6 OK ProblemasFredyAnguloGutierrezAún no hay calificaciones
- Taller CineticaDocumento6 páginasTaller Cineticachigui10% (3)
- Guía de Quimica IV Febrero 2011Documento6 páginasGuía de Quimica IV Febrero 2011URIEL HERNANDEZAún no hay calificaciones
- Guia de Estequiometria de RXDocumento2 páginasGuia de Estequiometria de RXCuncunita del ValleAún no hay calificaciones
- Tarea 2. FQDocumento2 páginasTarea 2. FQJazmin Maritza Benito MamaniAún no hay calificaciones
- 2 EjercicioDocumento19 páginas2 EjercicioJosé MiguelAún no hay calificaciones
- Ejercicio de LettyDocumento4 páginasEjercicio de LettyTaniaEGAún no hay calificaciones
- CineticaDocumento4 páginasCineticaLupita Alavez100% (1)
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Gasificación de briquetas de carbón con biomasa:: una alternativa energética sostenibleDe EverandGasificación de briquetas de carbón con biomasa:: una alternativa energética sostenibleAún no hay calificaciones
- Cuestionario paraDocumento1 páginaCuestionario paraJose LozanoAún no hay calificaciones
- Ejercicio FDocumento3 páginasEjercicio FJose LozanoAún no hay calificaciones
- Ta 2 G#5Documento4 páginasTa 2 G#5Jose LozanoAún no hay calificaciones
- Criollo Vásquez Dayana Alarcón Merchán Yoyce Avelino Robles María Lalama Mosquera Carlos Sánchez Rezavala Luis Rivas Rivas LuisDocumento4 páginasCriollo Vásquez Dayana Alarcón Merchán Yoyce Avelino Robles María Lalama Mosquera Carlos Sánchez Rezavala Luis Rivas Rivas LuisJose LozanoAún no hay calificaciones
- Ejercicio 12Documento2 páginasEjercicio 12Jose LozanoAún no hay calificaciones
- Costos Generados Por Corrosion A Nivel Nacional Y A Nivel LocalDocumento6 páginasCostos Generados Por Corrosion A Nivel Nacional Y A Nivel LocalJose Lozano100% (1)
- Ejercicio en Clase 3Documento1 páginaEjercicio en Clase 3Jose LozanoAún no hay calificaciones
- Taller Ejercicio en ClaseDocumento3 páginasTaller Ejercicio en ClaseJose LozanoAún no hay calificaciones
- Taller 1-2ciclo II 2021-2022Documento2 páginasTaller 1-2ciclo II 2021-2022Jose LozanoAún no hay calificaciones
- Ejercicio 3Documento1 páginaEjercicio 3Jose LozanoAún no hay calificaciones
- Taller Funciones Estadistica 3-7 - Jose Lozano Ulloa 18.12.21Documento9 páginasTaller Funciones Estadistica 3-7 - Jose Lozano Ulloa 18.12.21Jose LozanoAún no hay calificaciones
- Deber Computacion 17-07Documento7 páginasDeber Computacion 17-07Jose LozanoAún no hay calificaciones
- Universidad de Guayaquil Facultad de Ingeniería Química Ingeniería de Las Reacciones Ing. Stefanie Bonilla Bermeo, MSCDocumento9 páginasUniversidad de Guayaquil Facultad de Ingeniería Química Ingeniería de Las Reacciones Ing. Stefanie Bonilla Bermeo, MSCJose LozanoAún no hay calificaciones
- Taller 1 - Componentes TOTALDocumento14 páginasTaller 1 - Componentes TOTALJose LozanoAún no hay calificaciones
- 15 Deportes Con Pelota GrandeDocumento6 páginas15 Deportes Con Pelota GrandeJose LozanoAún no hay calificaciones
- Corrosión Metálica en Ambientes Exteriores e Interiores en Las Ciudades de Quito y EsmeraldasDocumento5 páginasCorrosión Metálica en Ambientes Exteriores e Interiores en Las Ciudades de Quito y EsmeraldasJose LozanoAún no hay calificaciones
- Ejercicios de Actividad en Clase 2.2Documento3 páginasEjercicios de Actividad en Clase 2.2Jose LozanoAún no hay calificaciones