Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Problema 3 Discu2
Cargado por
ElyReyesDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Problema 3 Discu2
Cargado por
ElyReyesCopyright:
Formatos disponibles
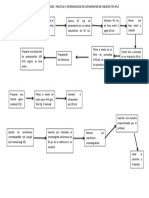
PROBLEMA 3, GUÍA DE DISCUSIÓN 2 plantear la siguiente ruta termodinámica para evaluar
los cambios en la entalpía y entropía:
Calcular los cambios de entalpía y entropía del
isobutano vapor a 190°F y 227 psia en relación con
el comportamiento ideal, a partir de la siguiente
información:
a) Referencia: H y S son cero para líquido saturado
a 60°F
b) La capacidad calorífica promedio definida como:
T2
CpdT
C PM = T1
para el isobutano líquido entre
T2 − T1
60 y 70°F es Cpm= 0.558 BTU/lb°R
c) El cambio de entalpía durante la vaporización a
70°F es de 143.4 Btu/lbm
d) La presión de vapor a 70°F es de 45 Psia
e) La capacidad calorífica del vapor es:
T °F Cp (Btu/lbm°R)
70 0.430
100 0.420
130 0.430
160 0.423
190 0.442
vsc liq.sat. l lv R
f) Los volúmenes específicos del isobutano vapor H190ºF,229 psia = H60ºF + ΔH60ºF−70ºF + ΔH70ºF − H70ºF,Psat
en pies3/lbm son: g.i.
+ ΔH70ºF, Psat R
+ H190ºF,227psia
70ºF −190ºF, 227 psia
P (psia) 500 R 530 R 560ºR 590 ºR 620 ºR 650ºR 680 ºR
vsc liq.sat. l lv R
40 2.08 2.25. 2.411 2.565 2.715 2.861 3.006 S190ºF,229 psia = S60ºF + ΔS60ºF−70ºF + ΔS70ºF − S70ºF,Psat
60 1.28 1.4 1.538 1.651 1.757 1.86 1.962
g.i. R
100 0.39 0.68 0.82 0.912 0.989 1.060 1.128 + ΔSH70ºF, Psat + S190ºF,227psia
70ºF −190ºF, 227 psia
150 0.27 0.38 0.46 0.53 0.598 0.656 0.709
200 0.21 0.27 0.28 0.326 0.39 0.451 0.498
227 0.369 0.414 Cálculo de cada término:
Nota: calcular las propiedades residuales por los tres
métodos. Para el método de ecuaciones de estado ENTALPÍA
seleccione la ecuación de Bittie Bridgeman.
Término Cálculo/Dato
𝑙𝑖𝑞.𝑠𝑎𝑡.
𝐻60º𝐹 0
SOLUCIÓN = 𝐶𝑝𝑝𝑟𝑜𝑚 (𝑇2 − 𝑇1 ) + 𝑉 𝑝𝑟𝑜𝑚 (1 − 𝛽𝑝𝑟𝑜𝑚 𝑇2)(𝑃2 − 𝑃1 )
El término relativo al cambio de presión se
Objetivo: Determinar los cambios de entalpia y puede considerar no significativo con
entropía del isobutano a condiciones de 190°F y 229 relación al término del cambio de
𝑙
psia tomando como referencia líquida saturado a 𝛥𝐻60º𝐹−70º𝐹 temperatura, por tanto, el cálculo del cambio
de entalpía como líquido saturado a 60ºF a
60ºF. líquido saturado a 70ºF, viene dado por:
= 𝐶𝑝𝑝𝑟𝑜𝑚 (𝑇2 − 𝑇1 )
Planteamiento: Como los cambios en las
𝑙𝑣
propiedades de estados no dependen de la 𝛥𝐻70º𝐹 143.4 Btu/lbm
trayectoria, sino solo del estado inicial y final y como
la entalpía y la entropía son funciones de estado, se
puede suponer cualquier trayectoria entre los estados
inicial y final. De acuerdo a lo anterior se puede
ENTALPÍA Término Cálculo/Dato
𝑙𝑣 𝑙𝑣
Término Cálculo/Dato
𝛥𝑆70º𝐹 𝛥𝐻70º𝐹
=143.4 Btu/lbm/530 ºR
𝑇
Se va a calcular a partir de: 𝑅 Se va a calcular a partir de:
a) Datos PVT con el siguiente −𝑆70º𝐹,𝑃𝑠𝑎𝑡
Datos PVT con el siguiente principio:
principio: 𝑃
𝜕𝑉 𝑅
𝑆 𝑅 = −𝑇 ∫ ( ) 𝑑𝑃
𝑃 𝑃 0 𝜕𝑇 𝑃
𝜕𝑉 𝑅
𝐻𝑅 = ∫ 𝑉 𝑅 𝑑𝑃 − 𝑇 ∫ ( ) 𝑑𝑃 Donde:
𝑂 0 𝜕𝑇 𝑃
Donde: 𝑉 𝑅 = 𝑉 − 𝑉 𝑔.𝑖.
𝑉 𝑅 = 𝑉 − 𝑉 𝑔.𝑖. 𝑉 𝑑𝑒 𝑡𝑎𝑏𝑙𝑎 𝑑𝑒𝑙 𝑒𝑗𝑒𝑟𝑐𝑖𝑐𝑖𝑜
𝑉 𝑑𝑒 𝑡𝑎𝑏𝑙𝑎 𝑑𝑒𝑙 𝑒𝑗𝑒𝑟𝑐𝑖𝑐𝑖𝑜
O bien si Z=PV/RT, cada dato de la
O bien si Z=PV/RT, cada dato de la tabla puede transformarse a Z, y
𝑅 utilizar:
−𝐻70º𝐹,𝑃𝑠𝑎𝑡 tabla puede transformarse a Z, y
utilizar: 𝑃 𝑃
𝑆𝑅 ∂𝑍 𝑑𝑃 𝑑𝑃
= −𝑇 ∫ ( ) − ∫ (𝑍 − 1)
𝐻 𝑅 𝑃
∂𝑍 𝑑𝑃 𝑅 0 ∂𝑇 𝑃 𝑃 0 𝑃
= −𝑇 ∫ ( ) A partir de la ecuación de Beattie-
𝑅𝑇 0 ∂𝑇 𝑃 𝑃
Bridgeman:
b) A partir de la ecuación de 𝛽′ 𝛾′ 𝛿′ 𝑉∗
(𝑆 ∗ − 𝑆) 𝑇 = + 2 + 3 + 𝑅 ln
Beattie-Bridgeman: 𝑉 2𝑉 3𝑉 𝑉
𝛽′′′ 𝛾′′′ 𝛿′′′ De material de clase tema 2.2.2.3b o en
(𝐻∗ − 𝐻) 𝑇 = 𝑅𝑇 − 𝑃𝑉 + + 2+ 3 bibliografía Hougen, Watson y Ragatz
𝑉 𝑉 𝑉
g.i. 190º𝑅 ′
De material de clase tema 2.2.2.3b o en ΔS1−2 𝑃227 𝑝𝑠𝑖𝑎
bibliografía Hougen, Watson y Ragatz ∫ 𝐶𝑝∗ 𝑑 𝑙𝑛 𝑇 − 𝑅 𝑙𝑛 ( 𝑠𝑎𝑡 )
70º𝑅 𝑃70º𝑅
190º𝐹 Cp(T) de tabla del literal e)
𝐶𝑝∗ 𝑑𝑇 𝑅 Se va a calcular a partir de:
g.i.
ΔH1−2
=∫
70º𝐹
−𝑆190º𝐹,227 𝑝𝑠𝑖𝑎
Cp(T) de tabla del literal e) Datos PVT con el siguiente principio:
𝑃
Se va a calcular a partir de: 𝜕𝑉 𝑅
𝑆 𝑅 = −𝑇 ∫ ( ) 𝑑𝑃
0 𝜕𝑇 𝑃
c) Datos PVT con el siguiente principio:
Donde:
𝑃 𝑃
𝜕𝑉 𝑅 𝑉 𝑅 = 𝑉 − 𝑉 𝑔.𝑖.
𝐻𝑅 = ∫ 𝑉 𝑅 𝑑𝑃 − 𝑇 ∫ ( ) 𝑑𝑃
𝑂 0 𝜕𝑇 𝑃 𝑉 𝑑𝑒 𝑡𝑎𝑏𝑙𝑎 𝑑𝑒𝑙 𝑒𝑗𝑒𝑟𝑐𝑖𝑐𝑖𝑜
Donde:
𝑉 𝑅 = 𝑉 − 𝑉𝑔.𝑖. O bien si Z=PV/RT, cada dato de la
𝑉 𝑑𝑒 𝑡𝑎𝑏𝑙𝑎 𝑑𝑒𝑙 𝑒𝑗𝑒𝑟𝑐𝑖𝑐𝑖𝑜 tabla puede transformarse a Z, y
O bien si Z=PV/RT, cada dato de la tabla puede utilizar:
𝑅
−𝐻190º𝐹,227 𝑝𝑠𝑖𝑎 transformarse a Z, y utilizar:
𝑃 𝑃
𝑆𝑅 ∂𝑍 𝑑𝑃 𝑑𝑃
𝐻𝑅 𝑃
∂𝑍 𝑑𝑃 = −𝑇 ∫ ( ) − ∫ (𝑍 − 1)
= −𝑇 ∫ ( ) 𝑅 0 ∂𝑇 𝑃 𝑃 0 𝑃
𝑅𝑇 ∂𝑇 𝑃 𝑃
0 A partir de la ecuación de Beattie-
d) A partir de la ecuación de Beattie- Bridgeman:
Bridgeman: 𝛽′ 𝛾′ 𝛿′ 𝑉∗
𝛽′′′ 𝛾′′′ 𝛿′′′
(𝑆 ∗ − 𝑆) 𝑇 = + 2 + 3 + 𝑅 ln
(𝐻∗ − 𝐻) 𝑇 = 𝑅𝑇 − 𝑃𝑉 + + 2+ 3 𝑉 2𝑉 3𝑉 𝑉
𝑉 𝑉 𝑉 De material de clase tema 2.2.2.3b o en
De material de clase tema 2.2.2.3b o en bibliografía Hougen, Watson y Ragatz
bibliografía Hougen, Watson y Ragatz
ENTROPÍA
Término Cálculo/Dato
𝑙𝑖𝑞.𝑠𝑎𝑡.
𝑆60º𝐹 0
Δ𝑆 = 𝐶𝑝𝑝𝑟𝑜𝑚 𝑙𝑛( 𝑇2⁄𝑇1 ) − 𝛽𝑝𝑟𝑜𝑚 𝑉 𝑝𝑟𝑜𝑚 (𝑃2 − 𝑃1 )
El término relativo al cambio de presión se
puede considerar no significativo con
𝑙 relación al término del cambio de
𝛥𝐻60º𝐹−70º𝐹
temperatura, por tanto, el cálculo del cambio
de entalpía como líquido saturado a 60ºF a
líquido saturado a 70ºF, viene dado por:
= 𝐶𝑝𝑝𝑟𝑜𝑚 𝑙𝑛( 𝑇2⁄𝑇1 )
También podría gustarte
- VidrioDocumento8 páginasVidrioElyReyesAún no hay calificaciones
- Lab1 - Parte 3.3.1.3 - IrqDocumento5 páginasLab1 - Parte 3.3.1.3 - IrqElyReyesAún no hay calificaciones
- Los MetalesDocumento24 páginasLos MetalesClaudio Gimenez100% (1)
- 42Documento191 páginas42JuanManuelMesaPosadaAún no hay calificaciones
- 2 SaponificaciónDocumento9 páginas2 SaponificaciónElyReyesAún no hay calificaciones
- Acetato de EtiloDocumento7 páginasAcetato de EtiloSergio RoblesAún no hay calificaciones
- Datoslasb 1 Opu 3Documento7 páginasDatoslasb 1 Opu 3Stefany Mariela Pineda AyalaAún no hay calificaciones
- Sólidos - Inorganicos Que Hay en La PPDocumento9 páginasSólidos - Inorganicos Que Hay en La PPElyReyesAún no hay calificaciones
- Ejercicios Resueltos VDocumento37 páginasEjercicios Resueltos VElyReyesAún no hay calificaciones
- c3 Unidad 4Documento44 páginasc3 Unidad 4ElyReyesAún no hay calificaciones
- 5630-Texto Del Artículo-21692-1-10-20130420Documento12 páginas5630-Texto Del Artículo-21692-1-10-20130420ElyReyesAún no hay calificaciones
- c3 Ejemplo 4.2Documento2 páginasc3 Ejemplo 4.2ElyReyesAún no hay calificaciones
- c3 Ejemplo 4.6Documento4 páginasc3 Ejemplo 4.6ElyReyesAún no hay calificaciones
- Problema 3 Discu2Documento2 páginasProblema 3 Discu2ElyReyesAún no hay calificaciones
- c3 Ejemplo 4.7Documento3 páginasc3 Ejemplo 4.7ElyReyesAún no hay calificaciones
- c3 Ejemplo 4.7Documento3 páginasc3 Ejemplo 4.7ElyReyesAún no hay calificaciones
- Probl. RadiacionDocumento47 páginasProbl. RadiacionJorge Anthony Calderon OjedaAún no hay calificaciones
- Tareea Termodinamia Quimica DosDocumento40 páginasTareea Termodinamia Quimica DosElyReyesAún no hay calificaciones
- Difusividad PDFDocumento6 páginasDifusividad PDFZully CabreraAún no hay calificaciones
- Métodos Numéricos, 4ta Edición - Juan Antonio Infante Del RíoDocumento520 páginasMétodos Numéricos, 4ta Edición - Juan Antonio Infante Del RíoBrandon Mancini100% (1)
- U4, Ejemplo 4.2Documento2 páginasU4, Ejemplo 4.2ElyReyesAún no hay calificaciones
- Cuadrado de Born-KoneingDocumento2 páginasCuadrado de Born-KoneingStefany Mariela Pineda AyalaAún no hay calificaciones
- Codigo de TrabajoDocumento92 páginasCodigo de TrabajoEver Sigfredo HernandezAún no hay calificaciones
- RedoxDocumento26 páginasRedoxluisormaAún no hay calificaciones
- Parcial1ci04 MopDocumento2 páginasParcial1ci04 MopElyReyesAún no hay calificaciones
- Conductividad F PDFDocumento12 páginasConductividad F PDFSergio Rivadeneyra AntoAún no hay calificaciones
- Complemento de Discusiã N Unidad 1.0Documento2 páginasComplemento de Discusiã N Unidad 1.0Stefany Mariela Pineda AyalaAún no hay calificaciones
- Discusión Unidad 1.0 ( (2016Documento5 páginasDiscusión Unidad 1.0 ( (2016Natalia GarzonaAún no hay calificaciones
- Parcial3difcii01 IopDocumento2 páginasParcial3difcii01 IopFAún no hay calificaciones
- Laboratorio 2 BiofisicaDocumento3 páginasLaboratorio 2 BiofisicaQ Vanegas YinethAún no hay calificaciones
- San Miguel Estudio Geológico - GeotécnicoDocumento34 páginasSan Miguel Estudio Geológico - GeotécnicoMauricio Manuel Montaño Ochoa100% (2)
- Diapositivas ExposicionDocumento8 páginasDiapositivas ExposicionWilmer Toribio FernandezAún no hay calificaciones
- CRISTALESDocumento5 páginasCRISTALESAlexandra LunaAún no hay calificaciones
- Prueba Tabla Periodica 1° MedioDocumento4 páginasPrueba Tabla Periodica 1° MedioJuan Pino100% (4)
- Las BiomoléculasDocumento7 páginasLas Biomoléculasrocio mailyn rios hornaAún no hay calificaciones
- Campo QuifaDocumento296 páginasCampo QuifaDanna Vanesa GómezAún no hay calificaciones
- Ablandamiento Cal/ SodaDocumento9 páginasAblandamiento Cal/ SodaPlutarco Chuquihuanga CórdovaAún no hay calificaciones
- HPLCDocumento1 páginaHPLCencb ipnAún no hay calificaciones
- Cinemática IIDocumento8 páginasCinemática IIArturo Rubén Lozano PérezAún no hay calificaciones
- Gases NoblesDocumento13 páginasGases NoblesHéctor VillanuevaAún no hay calificaciones
- 1) PANELES SOLARES - CLASE 1 (Font Sunpower V.2014)Documento76 páginas1) PANELES SOLARES - CLASE 1 (Font Sunpower V.2014)William Garcia MazaAún no hay calificaciones
- EJERCICIOS DE CONVECCIÓN FORZADA y LIBREDocumento3 páginasEJERCICIOS DE CONVECCIÓN FORZADA y LIBREAdrian NarvaezAún no hay calificaciones
- POLIMEROSDocumento17 páginasPOLIMEROSWilma Veronica Rivera BurgosAún no hay calificaciones
- In - BG Fernanda Coloma PDFDocumento5 páginasIn - BG Fernanda Coloma PDFFernanda ColomaAún no hay calificaciones
- Oxidación BiológicaDocumento15 páginasOxidación BiológicaIgor BobadillaAún no hay calificaciones
- CALDEROSDocumento6 páginasCALDEROSLorena BCAún no hay calificaciones
- ROBOTICADocumento2 páginasROBOTICALeslieAún no hay calificaciones
- Presión de Vapor - CavitaciónDocumento6 páginasPresión de Vapor - CavitaciónRafa MolinaAún no hay calificaciones
- Determinación Del Punto de Inflamación Mediante Analizador Pensky-Martens de Vaso CerradoDocumento24 páginasDeterminación Del Punto de Inflamación Mediante Analizador Pensky-Martens de Vaso Cerradocristina loyaAún no hay calificaciones
- Coeficiente PiezotérmicoDocumento9 páginasCoeficiente PiezotérmicoYuritziAún no hay calificaciones
- RESPONDEMO1Documento3 páginasRESPONDEMO1Gemelos VieraAún no hay calificaciones
- Boletin - Optica Geometrica - Resueltos - AlumnosDocumento13 páginasBoletin - Optica Geometrica - Resueltos - AlumnosMaria Jesus Esquer MoyaAún no hay calificaciones
- EnzimasDocumento27 páginasEnzimasYAMILETH ACOSTA GUTIERREZAún no hay calificaciones
- LABORATORIO 3 ViscosidadDocumento14 páginasLABORATORIO 3 Viscosidadvaleria lisbeth100% (1)
- PA 02 - Ex Pa - Geología - 2022-0Documento2 páginasPA 02 - Ex Pa - Geología - 2022-0ANA LUZ SOTO PILLPAAún no hay calificaciones
- Turbo ExpanderDocumento5 páginasTurbo ExpanderbrionyleslyAún no hay calificaciones
- Proceso SmawDocumento5 páginasProceso SmawBreyner RodriguezAún no hay calificaciones
- F&Q Proyecto de FlotabilidadDocumento11 páginasF&Q Proyecto de FlotabilidadALEJANDRA VERA CANTALAPIEDRAAún no hay calificaciones
- PH y Soluciones ReguladorasDocumento4 páginasPH y Soluciones ReguladorasMarco EspinosaAún no hay calificaciones