100% encontró este documento útil (1 voto)
2K vistas18 páginasEjercicios Termodinamica
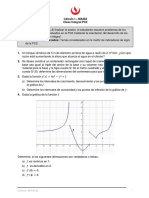
Este documento presenta 5 problemas de física relacionados con la termodinámica. El primer problema involucra la aplicación de la primera ley de la termodinámica para calcular el cambio en la energía interna de un sistema. El segundo problema involucra el cálculo del trabajo realizado durante una expansión isotérmica de un gas ideal. El tercer problema involucra el cálculo del trabajo realizado durante un proceso representado en un diagrama P-V. Los problemas 4 y 5 involucran el cálculo del trabajo realizado a lo largo de diferentes trayectorias
Cargado por
Wilder Challapa ArceDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
100% encontró este documento útil (1 voto)
2K vistas18 páginasEjercicios Termodinamica
Este documento presenta 5 problemas de física relacionados con la termodinámica. El primer problema involucra la aplicación de la primera ley de la termodinámica para calcular el cambio en la energía interna de un sistema. El segundo problema involucra el cálculo del trabajo realizado durante una expansión isotérmica de un gas ideal. El tercer problema involucra el cálculo del trabajo realizado durante un proceso representado en un diagrama P-V. Los problemas 4 y 5 involucran el cálculo del trabajo realizado a lo largo de diferentes trayectorias
Cargado por
Wilder Challapa ArceDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd