Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Entalpia Nuevo Documento de Microsoft Word
Cargado por
Julian Ricardo Ramirez Osorio0 calificaciones0% encontró este documento útil (0 votos)
36 vistas2 páginasLa entalpía es una función de estado termodinámica que representa la cantidad de calor intercambiado durante una transformación a presión constante. La variación de la entalpía de un sistema permite expresar la cantidad de calor intercambiado y es particularmente útil para procesos a presión constante donde los cambios de entalpía están asociados directamente con la energía recibida por el sistema en forma de calor. La entalpía incluye no sólo la energía interna del sistema sino también la energía almacenada en el medio ambiente circ
Descripción original:
Título original
entalpia Nuevo Documento de Microsoft Word
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoLa entalpía es una función de estado termodinámica que representa la cantidad de calor intercambiado durante una transformación a presión constante. La variación de la entalpía de un sistema permite expresar la cantidad de calor intercambiado y es particularmente útil para procesos a presión constante donde los cambios de entalpía están asociados directamente con la energía recibida por el sistema en forma de calor. La entalpía incluye no sólo la energía interna del sistema sino también la energía almacenada en el medio ambiente circ
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
36 vistas2 páginasEntalpia Nuevo Documento de Microsoft Word
Cargado por
Julian Ricardo Ramirez OsorioLa entalpía es una función de estado termodinámica que representa la cantidad de calor intercambiado durante una transformación a presión constante. La variación de la entalpía de un sistema permite expresar la cantidad de calor intercambiado y es particularmente útil para procesos a presión constante donde los cambios de entalpía están asociados directamente con la energía recibida por el sistema en forma de calor. La entalpía incluye no sólo la energía interna del sistema sino también la energía almacenada en el medio ambiente circ
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
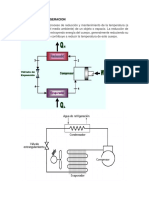
Entalpia
La entalpía es una función de estado de la termodinámica que se
simboliza por la letra H. La entalpía también se conoce como entalpía
absoluta o cantidad de calor . La variación de la entalpía de un sistema
termodinámico permite expresar la cantidad de calor intercambiado
durante una transformación isobárica , es decir, a presión constante.
H, denominada entalpia, mediante la relación:
La entalpía es particularmente útil en la comprensión y descripción
de los procesos isobárica: la presión constante, el cambio de entalpía se
encuentran directamente asociado con la energía recibida por el sistema
en la forma de calor, estos son fácilmente medibles en calorímetros .
Tal como se define, la entalpía abarca en sí no sólo la energía
interna del sistema, sino también la energía almacenada en el medio
ambiente del sistema (alrededores). Disminuyendo su volumen, la
entalpía también integra una porción de energía pasable que se
extraerá en forma de calor de ese sistema.
En definitiva, la entalpía es la suma de la energía interna de la materia y
el producto de su volumen multiplicado por la presión. La entalpía es
una función de estado cuantificable, aunque la entalpia total de un
sistema no se puede medir directamente, sin embargo, se puede medir
la variación de entalpía de un sistema.
También podría gustarte
- EntalpíaDocumento4 páginasEntalpíaRoberto Hurtados MartinezAún no hay calificaciones
- Entalpía en TermodinamicaDocumento5 páginasEntalpía en TermodinamicaCarolinaJiménezAún no hay calificaciones
- Ental PiaDocumento4 páginasEntal PiaPedro FranckAún no hay calificaciones
- EntalpíaDocumento4 páginasEntalpíaCecilio Díaz GijónAún no hay calificaciones
- Entropia y EntalpiaDocumento2 páginasEntropia y EntalpiaKsAún no hay calificaciones
- Entalpía ElectroDocumento24 páginasEntalpía ElectroSoledad Apaza BaltazarAún no hay calificaciones
- Presentación de Proyecto de Colores CálidosDocumento9 páginasPresentación de Proyecto de Colores CálidosTROLLINERDAún no hay calificaciones
- Entronpia y EntampiaDocumento4 páginasEntronpia y EntampiaJessiHam03Aún no hay calificaciones
- Enthalpy - Wikipedia, A Enciclopédia LivreDocumento7 páginasEnthalpy - Wikipedia, A Enciclopédia LivreCatumboAún no hay calificaciones
- EntalpíaDocumento3 páginasEntalpíaPxndx UrielAún no hay calificaciones
- EntalpíaDocumento6 páginasEntalpíaapi-19916045Aún no hay calificaciones
- EntalpíaDocumento21 páginasEntalpíarubenAún no hay calificaciones
- Entalpia TermodinamicaDocumento16 páginasEntalpia TermodinamicaErick MoralesAún no hay calificaciones
- EntalpíaDocumento5 páginasEntalpíaAaron RomeroAún no hay calificaciones
- Unidad 5 QuimicaDocumento3 páginasUnidad 5 QuimicaSara TastacaAún no hay calificaciones
- Energia Interna Calor Entalpia EntropiaDocumento5 páginasEnergia Interna Calor Entalpia EntropiaCriss CrissoAún no hay calificaciones
- EntalpiaDocumento4 páginasEntalpiawilmerAún no hay calificaciones
- EntalpiaDocumento4 páginasEntalpiaJossuet MaldonadoAún no hay calificaciones
- TermodinámicaDocumento19 páginasTermodinámicacentro de internet matapalomaAún no hay calificaciones
- Termodinamica Etalpia-Flujo Masico PDFDocumento29 páginasTermodinamica Etalpia-Flujo Masico PDFcarlosmilton10Aún no hay calificaciones
- Nociones de TermoquimicaDocumento8 páginasNociones de TermoquimicaFabricio RodríguezAún no hay calificaciones
- Expo FisiicaDocumento4 páginasExpo FisiicaMIRIAM ELIZABETH PADILLA RIVERAAún no hay calificaciones
- Exposición EntalpíaDocumento4 páginasExposición EntalpíaSebaslu89Aún no hay calificaciones
- TermoquímicaDocumento8 páginasTermoquímicaArletteAún no hay calificaciones
- Entalpia y EntropiaDocumento3 páginasEntalpia y EntropiaChayito Saavedra AliagaAún no hay calificaciones
- EntalpíaDocumento10 páginasEntalpíaEliane Peña EncisoAún no hay calificaciones
- Entalpía y EntropíaDocumento11 páginasEntalpía y EntropíaPaola RamosAún no hay calificaciones
- EntropiaDocumento13 páginasEntropiaAlberto A. RivasAún no hay calificaciones
- Entropía y EntalpiaDocumento7 páginasEntropía y EntalpiaYsmael PérezAún no hay calificaciones
- Trabajo de CompresiónDocumento2 páginasTrabajo de CompresiónMaryuri GuzmanAún no hay calificaciones
- Relacion Entre Calor y EntalpiaDocumento4 páginasRelacion Entre Calor y EntalpiaDiego Emmanuel Lomeli Topete33% (3)
- Energia Libre de HelmontDocumento9 páginasEnergia Libre de HelmontMiguel Angel CuestaAún no hay calificaciones
- Qué Es La EntalpíaDocumento5 páginasQué Es La EntalpíaJose GamerAún no hay calificaciones
- Entalpia - EntropiaDocumento1 páginaEntalpia - EntropiaabrahamAún no hay calificaciones
- Entalpia FisicaDocumento5 páginasEntalpia FisicaKevin LopezAún no hay calificaciones
- Trabajo de Investigación Electroquímica P7, P8Documento15 páginasTrabajo de Investigación Electroquímica P7, P8Micael FazzAún no hay calificaciones
- Calor de Formación y ReacciónDocumento6 páginasCalor de Formación y ReacciónRobertoCarlosOrrilloMendozaAún no hay calificaciones
- Trabajo de TermoquimicaDocumento8 páginasTrabajo de TermoquimicaUlises MarambiocAún no hay calificaciones
- Conceptos Básicos Transferencia de CalorDocumento12 páginasConceptos Básicos Transferencia de CaloralineAún no hay calificaciones
- Graficas Termodinamica Juan ManuelDocumento7 páginasGraficas Termodinamica Juan ManuelJuan ManuelAún no hay calificaciones
- TERMOQUÍMICADocumento26 páginasTERMOQUÍMICAFredy López MedinaAún no hay calificaciones
- Resumen Teoría Balance de EnergíaDocumento5 páginasResumen Teoría Balance de EnergíaPaez LamaAún no hay calificaciones
- Previo 6 de TermodinamicaDocumento7 páginasPrevio 6 de TermodinamicaJorgeAlbertoSandovalAún no hay calificaciones
- Electroquímica. FisicoquímicaDocumento8 páginasElectroquímica. FisicoquímicaROSMARY GUERRAAún no hay calificaciones
- EntalpiaDocumento5 páginasEntalpiaWarren Gabriel Morales MartinezAún no hay calificaciones
- Previo 6 de TermodinamicaDocumento7 páginasPrevio 6 de TermodinamicaRafael Velasco100% (1)
- 3.2 Investigación de Energía Interna y Entalpía en Los Procesos Termodinámicos-Plascencia Santiago Eiter AntonioDocumento7 páginas3.2 Investigación de Energía Interna y Entalpía en Los Procesos Termodinámicos-Plascencia Santiago Eiter AntonioEiter Antonio SantiagoAún no hay calificaciones
- Contenido Calórico o EntalpiaDocumento3 páginasContenido Calórico o EntalpiaGONZALO ALONSO AZURZA MANRIQUEAún no hay calificaciones
- Cinética Química, Termodinámica y EquilibrioDocumento18 páginasCinética Química, Termodinámica y EquilibrioAbril MendívilAún no hay calificaciones
- Entropia y EntalpiaDocumento2 páginasEntropia y Entalpiajose luisAún no hay calificaciones
- Termoquimica Quimica BasicaDocumento5 páginasTermoquimica Quimica BasicaMario Alberto Montero SánchezAún no hay calificaciones
- Entalpía: TermodinamicaDocumento18 páginasEntalpía: TermodinamicaIVAN ANTONIO CHAVEZ GARCIAAún no hay calificaciones
- Entropía AlexDocumento5 páginasEntropía AlexcuaniestefanyAún no hay calificaciones
- TermodinámicaDocumento5 páginasTermodinámicaliliana villaseñorAún no hay calificaciones
- Cuestionario Previo EntalpiaDocumento2 páginasCuestionario Previo EntalpiaAndrésTorresAún no hay calificaciones
- 13º AvanceDocumento9 páginas13º AvanceÎvëř ŠăňtāňdëřAún no hay calificaciones
- QUIMICA Tema 5. Cinética Química, Termodinámica y Equilibrio (II)Documento19 páginasQUIMICA Tema 5. Cinética Química, Termodinámica y Equilibrio (II)Esaú CMAún no hay calificaciones
- Energia Interna y EntalpiaDocumento14 páginasEnergia Interna y Entalpiairvin_48911153100% (7)
- ENTROPIADocumento19 páginasENTROPIAmafi3112Aún no hay calificaciones
- Refrigeracion y Ciclo de CarnotDocumento5 páginasRefrigeracion y Ciclo de CarnotJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Semana 7Documento14 páginasSemana 7Julian Ricardo Ramirez OsorioAún no hay calificaciones
- Ecuacion de Estado de Un Gas. Energia Interna de Un Gas. Gas Ideal. Seccion 5.1-5.5Documento5 páginasEcuacion de Estado de Un Gas. Energia Interna de Un Gas. Gas Ideal. Seccion 5.1-5.5Julian Ricardo Ramirez OsorioAún no hay calificaciones
- Primera Ley de La Termodinamica. Entalpia, Calor Especifico...Documento10 páginasPrimera Ley de La Termodinamica. Entalpia, Calor Especifico...Julian Ricardo Ramirez OsorioAún no hay calificaciones
- Nuevo Documento de Microsoft WordDocumento2 páginasNuevo Documento de Microsoft WordJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Refrigeracion y Ciclo de CarnotDocumento5 páginasRefrigeracion y Ciclo de CarnotJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Semana 2Documento16 páginasSemana 2Julian Ricardo Ramirez OsorioAún no hay calificaciones
- Semana 4Documento19 páginasSemana 4Julian Ricardo Ramirez OsorioAún no hay calificaciones
- Proceso de EstrangulacionDocumento3 páginasProceso de EstrangulacionJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Semana 5Documento10 páginasSemana 5Julian Ricardo Ramirez OsorioAún no hay calificaciones
- Semana 3Documento9 páginasSemana 3Julian Ricardo Ramirez OsorioAún no hay calificaciones
- 01 Guia de Laboratorio 2 MultimetroDocumento7 páginas01 Guia de Laboratorio 2 MultimetroJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Semana 6Documento11 páginasSemana 6Julian Ricardo Ramirez OsorioAún no hay calificaciones
- Conduccion y Conveccion de Calor, Conveccion, Conductividad y Radiacion TermicaDocumento11 páginasConduccion y Conveccion de Calor, Conveccion, Conductividad y Radiacion TermicaJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Primera Ley de La Termodinamica. Entalpia, Calor Especifico...Documento10 páginasPrimera Ley de La Termodinamica. Entalpia, Calor Especifico...Julian Ricardo Ramirez OsorioAún no hay calificaciones
- ENTROPIADocumento8 páginasENTROPIAJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Celestial Proceso de EstrangulacionDocumento10 páginasCelestial Proceso de EstrangulacionJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Entalpia Nuevo Documento de Microsoft WordDocumento2 páginasEntalpia Nuevo Documento de Microsoft WordJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Ecuacion de Estado de Un Gas. Energia Interna de Un Gas. Gas Ideal. Seccion 5.1-5.5Documento5 páginasEcuacion de Estado de Un Gas. Energia Interna de Un Gas. Gas Ideal. Seccion 5.1-5.5Julian Ricardo Ramirez OsorioAún no hay calificaciones
- Primera Ley de La Termodinamica. Entalpia, Calor Especifico...Documento10 páginasPrimera Ley de La Termodinamica. Entalpia, Calor Especifico...Julian Ricardo Ramirez OsorioAún no hay calificaciones
- 01 CTO en ParaleloDocumento6 páginas01 CTO en ParaleloSanti SampAún no hay calificaciones
- 00 CTO en SerieDocumento6 páginas00 CTO en SerieJulian Ricardo Ramirez OsorioAún no hay calificaciones
- 00 Guia de Laboratorio 1 SoldaduraDocumento8 páginas00 Guia de Laboratorio 1 SoldaduraJulian Ricardo Ramirez OsorioAún no hay calificaciones
- Ecuacion de Estado de Un Gas. Energia Interna de Un Gas. Gas Ideal. Seccion 5.1-5.5Documento5 páginasEcuacion de Estado de Un Gas. Energia Interna de Un Gas. Gas Ideal. Seccion 5.1-5.5Julian Ricardo Ramirez OsorioAún no hay calificaciones
- 00 CTO en SerieDocumento6 páginas00 CTO en SerieJulian Ricardo Ramirez OsorioAún no hay calificaciones