Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Comparto 'Modelo Atomico Danes Bohr' Contigo
Cargado por
Luzveidis RoblesTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Comparto 'Modelo Atomico Danes Bohr' Contigo
Cargado por
Luzveidis RoblesCopyright:
Formatos disponibles
INSTITUCIÓN EDUCATIVA TECNICA ROIG Y VILLALBA
DANE: 144279000368 – NIT 892 115181 DV – 6
RESOLUCIÓN: RES.262XI-5-2002.
DIRECCIÓN: CR 21 NO.20-33 TEL.(5)7756128 FONSECA, LA GUAJIRA
GUÍA DE ORIENTACIÓN
AREA: Ciencias Naturales DOCENTE: LIC. ROBINSON PINTO BORREGO
GRADO: 7 PERIODO: III AÑO: 2020
OBJETIVO
Establecer relaciones entre las características microscópicas y macroscópicas de la
materia y las propiedades físicas y químicas de la sustancia que la constituye
Describo el desarrollo de modelos que explica la estructura de la materia
COMPETENCIA COMPONENTE
Fisico
Quimico
Establecer condiciones. Interpretar situaciones proponer
alternativas de solución
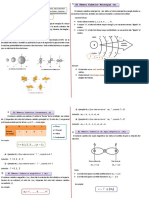
Modelo Atómico de Bohr.
NIELS BOHR. 7 de octubre de 1885 – 18 de noviembre de 1962.
Describió el átomo de hidrógeno con un protón en el núcleo, y girando
a su alrededor un electrón. ... En este modelo los electrones giran en
órbitas circulares alrededor del núcleo, ocupando la órbita de menor
energía posible, o la órbita más cercana posible al núcleo.
El modelo de Bohr era una modificación al modelo Rutherford, por lo
que las características de un núcleo central pequeño y con la mayoría
de la masa se mantenía. De la misma forma, los electrones orbitaban
alrededor del núcleo similar a los planetas alrededor del sol aunque
sus órbitas no son planas.
Este modelo de niveles de energía, significaba que los electrones solo
pueden ganar o perder energía saltando de una órbita permitida a otra
y al ocurrir esto, absorbería o emitiría radiación electromagnética en el
proceso.
El modelo de Bohr fue el primero en introducir el concepto de
cuantización lo que lo ubica como un modelo entre la mecánica clásica
y la mecánica cuántica. Fue una mejora al modelo de Rutherford pero
incorporando los descubrimientos de cuantización descubiertos por
Max Planck unos años antes y las ideas de Albert Einstein.
Principios básicos del modelo atómico de
Bohr.
1. Las partículas con carga positiva se encuentran en un volumen muy
pequeño comparado con el tamaño del átomo y contienen la mayor
parte de la masa del átomo.
2. Los electrones con carga eléctrica negativa, giran alrededor del núcleo
en órbitas circulares.
3. Los electrones orbitan el núcleo en órbitas que tienen un tamaño y
energía establecidos. Por lo tanto, no existen en un estado intermedio
entre las órbitas.
4. La energía de la órbita está relacionada con su tamaño. La energía
más baja se encuentra en la órbita más pequeña. Cuanto más lejos
esté el nivel de energía del núcleo, mayor será la energía que tiene.
5. Los niveles de energía tienen diferentes números de electrones.
Cuanto menor sea el nivel de energía, menor será la cantidad de
electrones que contenga, por ejemplo, el nivel 1 contiene hasta 2
electrones, el nivel 2 contiene hasta 8 electrones, y así sucesivamente.
6. La energía se absorbe o se emite cuando un electrón se mueve de
una órbita a otra.
7. En cada nivel de energía solo debe a ver un numero limitado de
electrones el cual se determina con la formula 2 (n) 2
Quién fue Niels Bohr?
Niels Bohr fue un físico Danés que nació el 7 de octubre de 1885 en Copenhague,
Dinamarca. Su padre era profesor en la Universidad y su madre provenía de una
familia acomodada.
Cursó sus estudios básicos en Dinamarca e ingresó a la universidad de
Copenhague en 1903 para estudiar física aunque también estudió astronomía y
matemáticas. En 1911 obtuvo su título de doctorado.
Ese mismo año, Bohr viajó a Londres con una beca de la Fundación Carlsberg
donde la mayor parte de la investigación sobre el átomo era hecha y ahí conoció a
importantes figuras del tema como JJ Thomson y Ernest Rutherford.
En 1912 regresó a Dinamarca y se casó con Margrethe Norlud con quien tuvo seis
hijos, uno de los cuales es también un gran físico que ganó el premio nobel en
1975, como su padre lo había hecho años antes.
Una vez en Dinamarca y ante la poca popularidad de la física en el país, tuvo que
dar clases a alumnos de medicina lo que no gustó en lo absoluto a Bohr,
regresando a Manchester donde Rutherford le había ofrecido un puesto. Estuvo en
Londres un par de años luego del inicio de la primera guerra mundial.
En 1916 fue nombrado director física teórica de la universidad de Copenhague, un
puesto creado específicamente para el. En 1918 logró que el gobierno creara el
instituto danés de física teórica conocido ahora como el Instituto Niels Bohr que
empezó a operar en 1921 con él al frente
.
En 1922 Bohr fue galardonado con el premio Nobel de Física por sus
investigaciones sobre las estructuras de los átomos y las radiaciones emitidas por
ellos.
En 1924 Bohr se reunión con Heisenberg en Dinamarca y posteriormente recibió a
científicos como Pual Dirac y Erwin Schrödinger quienes dieron forma a la
interpretación de Copenhague de la mecánica cuántica.
Bohr murió el 18 de noviembre de 1962 en Carlsberg, Dinamarca.
ACTIVIDAD
DESPUES DE HABER LEIDO EL CONTENID TEMATICO
CORRESPONDIENTE A LA MATERIA Y SU ESCTUCTURA
EL ALUMNO ESTARA EN CAPACIDAD DE RESPONDER
LAS SIGUIENTES PREGUNTAS.
1. Cuantas orbitas hay en modelo atómico de Danés Niels
Bohr? .
2. Cuáles son los postulados de Danés Niels Bohr?
3. Dibujo el modelo atómico de Danés Niels Bohr?
4. Quien fue Danés Niels Bohr?
5. En qué año fue propuesto el modelo atómico de Danés
Niels Bohr?
6. En qué año se le otorgó el premio nobel de física a
Danés Niels Bohr y porque?
7. Con que fin propuso Danés Niels Bohr su modelo
atómico.
8. Donde y en qué año muere Danés Niels Bohr
9. Teniendo en cuenta la formula 2 (n)2 determine el número
de electrones de los niveles 5, 6 y 7
10.Resalte aspectos importantes sobre la vida de Danés Niels
Bohr.
La guía va desde el 5 de Noviembre al 26 de Noviembre
del 2020.
Recordar que deben enviar la evidencia completa antes de
la fecha limite, marcar cada una de las hojas en la parte
superior con el nombre completo y grado. EVIDENCIAS
con lápiz no se seran recibidas
Att.. profesor de Biología ROBINSON PINTO BORREGO
También podría gustarte
- Guia de Matemática 2° PeridoDocumento19 páginasGuia de Matemática 2° PeridoLuzveidis Robles0% (1)
- Fisica Quimica 3º Eso - Fq3eso - Sep2010Documento17 páginasFisica Quimica 3º Eso - Fq3eso - Sep2010antonio11Aún no hay calificaciones
- Propiedades Periodicas de La TPDocumento21 páginasPropiedades Periodicas de La TPcompartecienciaAún no hay calificaciones
- Tecnicas de Analisis de CircuitosDocumento28 páginasTecnicas de Analisis de CircuitosCarlosAún no hay calificaciones
- Ejercicios Desasrrollados de La Segunda Unidad de Quimica General - Baltazar Honorio John AlexanderDocumento75 páginasEjercicios Desasrrollados de La Segunda Unidad de Quimica General - Baltazar Honorio John AlexanderAlex Baltazar50% (2)
- !!cuarto 11Documento8 páginas!!cuarto 11Luzveidis RoblesAún no hay calificaciones
- 6° Guia11 Ciencias Naturales - Propiedades de La MateriaDocumento3 páginas6° Guia11 Ciencias Naturales - Propiedades de La MateriaLuzveidis RoblesAún no hay calificaciones
- FM Juan Samper 3 PDFDocumento1 páginaFM Juan Samper 3 PDFLuzveidis RoblesAún no hay calificaciones
- Memorando Raciones para PrepararDocumento4 páginasMemorando Raciones para PrepararLuzveidis RoblesAún no hay calificaciones
- Calendario EpicoDocumento1 páginaCalendario EpicoLuzveidis RoblesAún no hay calificaciones
- Planeacion y Seguimiento Julio #5Documento5 páginasPlaneacion y Seguimiento Julio #5Luzveidis RoblesAún no hay calificaciones
- El Diezmo Era DineroDocumento8 páginasEl Diezmo Era DineroLuzveidis RoblesAún no hay calificaciones
- 8 Acta Talento Humano y usuario-COMPRROMISOS 1 (2) Enviar A YoliDocumento5 páginas8 Acta Talento Humano y usuario-COMPRROMISOS 1 (2) Enviar A YoliLuzveidis RoblesAún no hay calificaciones
- Diapositiva CopasstDocumento7 páginasDiapositiva CopasstLuzveidis RoblesAún no hay calificaciones
- Paletas CremosasDocumento3 páginasPaletas CremosasLuzveidis RoblesAún no hay calificaciones
- Guia 8 Tabla Periodica de Los Elementos 10 Quimica GuillermoDocumento11 páginasGuia 8 Tabla Periodica de Los Elementos 10 Quimica GuillermoWilliam MontañezAún no hay calificaciones
- SEGUNDO EXAMEN RAZ-VERBAL OkDocumento51 páginasSEGUNDO EXAMEN RAZ-VERBAL OkDennys Llontop0% (1)
- Tecnologia de MaterialesDocumento11 páginasTecnologia de MaterialesRaul Sierra RamirezAún no hay calificaciones
- Elementos y Compuestos de Uso FrecuenteDocumento2 páginasElementos y Compuestos de Uso FrecuenteLEANDRA TORRES CANALOAún no hay calificaciones
- Discusión 1 - Química General - 2024Documento6 páginasDiscusión 1 - Química General - 2024Rosa del Carmen ValenciaAún no hay calificaciones
- Resumen Química IIDocumento151 páginasResumen Química IIBautii PincoAún no hay calificaciones
- Seccion 2Documento4 páginasSeccion 2Momazos Xdi100% (1)
- Quimic Ultima PracticaDocumento4 páginasQuimic Ultima PracticaTania Ramos Aldana0% (1)
- 1234Documento13 páginas1234Gutierrez GambitoAún no hay calificaciones
- Actividad 2 - Identificación de Componentes Eléctricos, Operación y DiagnósticoDocumento21 páginasActividad 2 - Identificación de Componentes Eléctricos, Operación y DiagnósticoLeonardo Matta RubianoAún no hay calificaciones
- Guía de Aprendizaje:" Estructura Atómica, Atómico (Z) y N°másico (A)Documento2 páginasGuía de Aprendizaje:" Estructura Atómica, Atómico (Z) y N°másico (A)Gilda Chiesa HernandezAún no hay calificaciones
- Nuestro Amigo El AtomoDocumento2 páginasNuestro Amigo El AtomoLalo Espino40% (5)
- Biologia TallerDocumento4 páginasBiologia TallerAndy PerezAún no hay calificaciones
- QUIMCADocumento181 páginasQUIMCAManu MendezAún no hay calificaciones
- Física y Química Tema 3. LAS SUSTANCIAS QUÍMICAS PDFDocumento22 páginasFísica y Química Tema 3. LAS SUSTANCIAS QUÍMICAS PDFJerez Vendimia FridaAún no hay calificaciones
- Naturaleza DiscontinuaDocumento3 páginasNaturaleza DiscontinuaAnonymous gI6ZIlAún no hay calificaciones
- Teoría de Enlace-Valencia (TEV)Documento26 páginasTeoría de Enlace-Valencia (TEV)Maik MendozaAún no hay calificaciones
- TP N 2Documento4 páginasTP N 2Vivi Arenas100% (1)
- QUÍMICA I GUIÓN Ago Ene 2022 2023Documento7 páginasQUÍMICA I GUIÓN Ago Ene 2022 2023ALEJANDRO YERAY BACA CAMPOSAún no hay calificaciones
- Jeffry Herrera Cumplido. Is. 7C. Quimica. TallerDocumento2 páginasJeffry Herrera Cumplido. Is. 7C. Quimica. TallerElkin HerreraAún no hay calificaciones
- Fisica de La Television - Donald Fink y David LutyensDocumento119 páginasFisica de La Television - Donald Fink y David LutyensPrasutagusAún no hay calificaciones
- Practica Electricidad EstaticaDocumento5 páginasPractica Electricidad EstaticaJavo GavoAún no hay calificaciones
- Guia de Problemas Unidad 1 PDFDocumento11 páginasGuia de Problemas Unidad 1 PDFRocío GallaraAún no hay calificaciones
- Espectro Spin Órbita - Tabla PeriodicaDocumento5 páginasEspectro Spin Órbita - Tabla PeriodicaDianaAún no hay calificaciones
- Números Cuánticos55Documento12 páginasNúmeros Cuánticos55Wilder EfrainAún no hay calificaciones
- GUÍA El Átomo de Hidrógeno.Documento5 páginasGUÍA El Átomo de Hidrógeno.brayansag19Aún no hay calificaciones