Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Función de Gran para HCL y NaOH A Concentraciones 0
Cargado por
LuisFernandoMirandaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Función de Gran para HCL y NaOH A Concentraciones 0
Cargado por
LuisFernandoMirandaCopyright:
Formatos disponibles
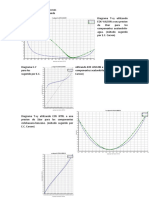
Función de gran para HCl y NaOH a concentraciones 0.1M y 0.1M con un volumen inicial de 20ml.
Para comenzar es necesario determinar que se trata de una base y acido fuertes por lo tanto las
ecuaciones nos quedaran de la siguiente manera.
En una valoración de un ácido fuerte con una base fuerte, la concentración de protones es
cH=cAV0/(V+V0) – cBV/(V+V0)
en el punto de equivalencia cAV0 = cBVe que se usara para corroborar el punto de intersección
Uniendo ambas ecuaciones anteriores tenemos que cH = cB(Ve-V)/(V0-V). Sabiendo la definición
de pH, como el opuesto del antilogaritmo de la actividad de los protones: 10-pH = γHcH, tenemos
que (V0+V)10-pH=γH cB(Ve-V) …………………..ecn(1).
Esto es así antes del punto de equivalencia, pues después de él la concentración de protones se
vuelve negativa según esa ecuación, lo cual significa que no tiene sentido químico pero sí
matemático, defino en las ecuaciones (son los protones “que faltan” para llegar al punto de
equivalencia). Tras el punto de equivalencia, hay que modificar la ecuación anterior introduciendo
el producto iónico del agua: Kw = cHcOH de modo y manera que tenemos una nueva ecuación:
(V0+V)10pH=cB/(γHKw)(V-Ve) …………. ecn(2).
La representación de Gran consiste en representar las ecuaciones (1) y (2), es decir: (V+V0)10-pH y
(V+V0)10pH frente al volumen. Obtendremos dos líneas rectas que se cruzan en el punto de
equivalencia, y de cuyas pendientes y ordenadas en el origen puede extraerse el producto iónico
del agua, Kw
HCl + NaOH ===== > NaCl + ܪଶܱ
inicio V0C0 -
adiciona v1c1
(v0c0 -
X < Veq v1c1)/v1+v0 Ɛ1
X = Veq Ɛ2 Ɛ3 Ɛ4
(c1v1-c0-
X > Veq Ɛ5 v0)/v0 + v1 (v0c0)/v0 + v1
También podría gustarte
- Armónicas en Sistemas Eléctricos IndustrialesDe EverandArmónicas en Sistemas Eléctricos IndustrialesCalificación: 4.5 de 5 estrellas4.5/5 (12)
- Informe n2 Paredes Pillco Angeles Natalia 1Documento14 páginasInforme n2 Paredes Pillco Angeles Natalia 1Ale MachacaAún no hay calificaciones
- Carga y Descarga de Un CapacitorDocumento9 páginasCarga y Descarga de Un CapacitorIvanovAún no hay calificaciones
- Tema 4 (CON ISBN) PDFDocumento14 páginasTema 4 (CON ISBN) PDFVitty BuggiAún no hay calificaciones
- Practica Circuito RC SerieDocumento9 páginasPractica Circuito RC SerieIvanovAún no hay calificaciones
- Informe de CircuitosDocumento8 páginasInforme de CircuitosTreveresthAún no hay calificaciones
- Capitulo 7 RealimentaciónDocumento6 páginasCapitulo 7 RealimentaciónMarcos LenardonAún no hay calificaciones
- Carga y Descarga de Un CapacitorDocumento8 páginasCarga y Descarga de Un CapacitorIvanovAún no hay calificaciones
- Volumetria Acido BaseDocumento76 páginasVolumetria Acido BaseMaría Cristina Ortiz GarcíaAún no hay calificaciones
- Parcial 2020: IC AnalógicosDocumento2 páginasParcial 2020: IC Analógicosraulhime64Aún no hay calificaciones
- Ejercicios Tema 3 - Teoremas de La Teoria de CircuitosDocumento28 páginasEjercicios Tema 3 - Teoremas de La Teoria de CircuitosBili Moyano ArevaloAún no hay calificaciones
- P12 - Respuesta Natural RCDocumento31 páginasP12 - Respuesta Natural RCabrahamAún no hay calificaciones
- Transientes Capacitivos e Inductivos Presentación 5Documento23 páginasTransientes Capacitivos e Inductivos Presentación 5Fernando H. GuerraAún no hay calificaciones
- Examen Pauta V01Documento21 páginasExamen Pauta V01ElenaContardoAún no hay calificaciones
- Recta de CargaDocumento31 páginasRecta de CargaJacoboRosasGonzalezAún no hay calificaciones
- Circuitos de Primer OrdenDocumento15 páginasCircuitos de Primer OrdenCONSTANZA VALENTINA SEPÚLVEDA ABARZÚAAún no hay calificaciones
- Laboratorio Fis 200 CAPACITANCIADocumento3 páginasLaboratorio Fis 200 CAPACITANCIApol0% (2)
- MetodologiadisenoDocumento6 páginasMetodologiadisenoJuli CorzoAún no hay calificaciones
- Rivera Pascual Diego Yahirp3Documento19 páginasRivera Pascual Diego Yahirp3Rivera Pascual DIegoAún no hay calificaciones
- Capítulo 4 & 5 DISEÑO DE REACTORES.Documento12 páginasCapítulo 4 & 5 DISEÑO DE REACTORES.Ambar FajardoAún no hay calificaciones
- QRC Ecu Recta PDFDocumento1 páginaQRC Ecu Recta PDFjkl316Aún no hay calificaciones
- RectaDocumento1 páginaRectaIram AbifAún no hay calificaciones
- Y y MXX: Ecuaciones de La RectaDocumento1 páginaY y MXX: Ecuaciones de La Rectajkl316Aún no hay calificaciones
- Análisis y Diseño en CDDocumento25 páginasAnálisis y Diseño en CDGabriel SerradaAún no hay calificaciones
- p11 Respuesta Natural RCDocumento30 páginasp11 Respuesta Natural RCmoises crisostomoAún no hay calificaciones
- TP N° 2 - Valoración Conductimétrica de Un Ácido FuerteDocumento7 páginasTP N° 2 - Valoración Conductimétrica de Un Ácido FuerteJuanAún no hay calificaciones
- ComparadoresDocumento7 páginasComparadoresGutierrez SergioAún no hay calificaciones
- IDR 434 Circuito RC en SerieDocumento4 páginasIDR 434 Circuito RC en Seriegreybinhernandez50Aún no hay calificaciones
- LABORATORIO NO 6 "Carga y Descarga de Un Circuito R-C"Documento19 páginasLABORATORIO NO 6 "Carga y Descarga de Un Circuito R-C"Irvin CormánAún no hay calificaciones
- QAnal1 04Documento38 páginasQAnal1 04joseAún no hay calificaciones
- Guia 2Documento15 páginasGuia 2ALFREDO SANTILLANAún no hay calificaciones
- Proyecto Final Electronica IIDocumento27 páginasProyecto Final Electronica IIJhonatan Alexander Orjuela FonsecaAún no hay calificaciones
- Cálculos de PH en Los 4 Casos de Valoraciones Ácido - BaseDocumento4 páginasCálculos de PH en Los 4 Casos de Valoraciones Ácido - Baseani estradaAún no hay calificaciones
- 3 CapacitanciaDocumento14 páginas3 CapacitanciaDavid Paolo Rocha JaureguiAún no hay calificaciones
- Control de ConvertidoresDocumento24 páginasControl de ConvertidoresHéctor Barrios CastroAún no hay calificaciones
- T5 LE LopezArandaJoseAntonioDocumento13 páginasT5 LE LopezArandaJoseAntonioJosé Antonio López ArandaAún no hay calificaciones
- IntroducciónDocumento3 páginasIntroducciónAdolf RodríguezAún no hay calificaciones
- Solucion Prueba 1 s2 2017 PDFDocumento3 páginasSolucion Prueba 1 s2 2017 PDFMiguel RodriguezAún no hay calificaciones
- Tallern3 6162c2155cacdc2Documento6 páginasTallern3 6162c2155cacdc2diego mauricio castaedaAún no hay calificaciones
- Movimiento ParabólicoDocumento17 páginasMovimiento ParabólicoAmberst Fidencio Gargatt ArapaAún no hay calificaciones
- Notas de Analisis FuncionalDocumento8 páginasNotas de Analisis Funcionaljuanpablo2pcAún no hay calificaciones
- Lab Fis III CapacitanciaDocumento12 páginasLab Fis III CapacitanciaJavierAún no hay calificaciones
- P12 - Respuesta Natural RCDocumento34 páginasP12 - Respuesta Natural RCAdolfo LopezAún no hay calificaciones
- Bitacora N° 7Documento11 páginasBitacora N° 7Marcelo SalinasAún no hay calificaciones
- Practicamodificada 20Documento7 páginasPracticamodificada 20Edwing Maquera FloresAún no hay calificaciones
- Practica 6Documento3 páginasPractica 6JeanPierSalloAún no hay calificaciones
- Op Amp 2Documento15 páginasOp Amp 2Carlos Enrique Salazar MuñozAún no hay calificaciones
- Revisen LoDocumento30 páginasRevisen LoCristhian Lenin Mata CabanaAún no hay calificaciones
- Análisis Del Movimiento PlanoDocumento3 páginasAnálisis Del Movimiento PlanoMadelineAún no hay calificaciones
- Up6 Unidad6 Circuitos Transitorios de Segundo OrdenDocumento36 páginasUp6 Unidad6 Circuitos Transitorios de Segundo Ordenjean pierre quirozAún no hay calificaciones
- 2013 Julio Con SolucionesDocumento6 páginas2013 Julio Con SolucionesSergio GalvezAún no hay calificaciones
- LAB No 1 PRQ 3351Documento15 páginasLAB No 1 PRQ 3351Eliseo FloresAún no hay calificaciones
- Circuito Equivalente de TheveninDocumento6 páginasCircuito Equivalente de Thevenineduardo gordonAún no hay calificaciones
- 1 - Tarea 2 - EaDocumento9 páginas1 - Tarea 2 - EaLUIS FERNANDO RODRIGUEZ ALVAAún no hay calificaciones
- Comparador Con HisteresisDocumento10 páginasComparador Con HisteresisCarlos Enrique LopezAún no hay calificaciones
- Informe-L1-1 Diego Marni Sobrino PDFDocumento16 páginasInforme-L1-1 Diego Marni Sobrino PDFAwesome AmazingAún no hay calificaciones
- R 63497Documento7 páginasR 63497Camilekz Moreno0% (1)
- Ingeniería de ProyectosDocumento4 páginasIngeniería de ProyectosLuisFernandoMirandaAún no hay calificaciones
- Cronograma ProyectoDocumento1 páginaCronograma ProyectoLuisFernandoMirandaAún no hay calificaciones
- 3 Expo FisicaDocumento7 páginas3 Expo FisicaLuisFernandoMirandaAún no hay calificaciones
- Seminario 1Documento1 páginaSeminario 1LuisFernandoMirandaAún no hay calificaciones
- Ingeniería de ProyectosDocumento4 páginasIngeniería de ProyectosLuisFernandoMirandaAún no hay calificaciones
- Diagrama TDocumento3 páginasDiagrama TLuisFernandoMirandaAún no hay calificaciones
- Analitica AlternoDocumento2 páginasAnalitica AlternoLuisFernandoMirandaAún no hay calificaciones
- Taller de MusicaDocumento1 páginaTaller de MusicaLuisFernandoMirandaAún no hay calificaciones
- Serie 1Documento4 páginasSerie 1LuisFernandoMirandaAún no hay calificaciones
- Apuntes 1 Propiedades TermodinamicasDocumento1 páginaApuntes 1 Propiedades TermodinamicasLuisFernandoMirandaAún no hay calificaciones
- Una Empresa de Prestigio Opera de La Siguiente Manera en Un Reactor de 5 Toneladas Se Introducen Los Reactivos A y B para Obtener CDocumento3 páginasUna Empresa de Prestigio Opera de La Siguiente Manera en Un Reactor de 5 Toneladas Se Introducen Los Reactivos A y B para Obtener CLuisFernandoMirandaAún no hay calificaciones
- Maquinado Gauge Manguera, Material AISI 304Documento1 páginaMaquinado Gauge Manguera, Material AISI 304LuisFernandoMirandaAún no hay calificaciones
- ExamenDocumento3 páginasExamenLuisFernandoMirandaAún no hay calificaciones
- Analitica AlternoDocumento2 páginasAnalitica AlternoLuisFernandoMirandaAún no hay calificaciones
- Ya VamejorDocumento1 páginaYa VamejorLuisFernandoMirandaAún no hay calificaciones
- Apuntes 1 Propiedades TermodinamicasDocumento1 páginaApuntes 1 Propiedades TermodinamicasLuisFernandoMirandaAún no hay calificaciones
- Investigacion de OperacinoesDocumento1 páginaInvestigacion de OperacinoesLuisFernandoMirandaAún no hay calificaciones
- Cinetica Miranda 13 MarzoDocumento2 páginasCinetica Miranda 13 MarzoLuisFernandoMirandaAún no hay calificaciones
- Plantilla Conv 04Documento26 páginasPlantilla Conv 04Anonymous 1ewWHl6D100% (1)
- Serie de Problemas Miranda 76-80Documento2 páginasSerie de Problemas Miranda 76-80LuisFernandoMirandaAún no hay calificaciones
- 10 de Mayo Clase de TermoDocumento2 páginas10 de Mayo Clase de TermoLuisFernandoMirandaAún no hay calificaciones
- Costos Reactivos ProductosDocumento1 páginaCostos Reactivos ProductosLuisFernandoMirandaAún no hay calificaciones
- Examen 2Documento22 páginasExamen 2LuisFernandoMirandaAún no hay calificaciones
- P 1Documento7 páginasP 1LuisFernandoMirandaAún no hay calificaciones
- Conclusión AspenDocumento1 páginaConclusión AspenLuisFernandoMirandaAún no hay calificaciones
- ReporteDocumento8 páginasReporteLuisFernandoMirandaAún no hay calificaciones
- Resumen Reactores MiercolesDocumento1 páginaResumen Reactores MiercolesLuisFernandoMirandaAún no hay calificaciones
- La Descomposición de Pentixido de Dinitrogeno Es Una Reacción de Primer Orden Con Una Constante de Velocidad KDocumento2 páginasLa Descomposición de Pentixido de Dinitrogeno Es Una Reacción de Primer Orden Con Una Constante de Velocidad KLuisFernandoMirandaAún no hay calificaciones
- Eficiencia de Torres de Destilación en La Producción de MTBEDocumento2 páginasEficiencia de Torres de Destilación en La Producción de MTBELuisFernandoMirandaAún no hay calificaciones