Documentos de Académico
Documentos de Profesional
Documentos de Cultura
C Cal
Cargado por
Hassiel Ramirez Avila0 calificaciones0% encontró este documento útil (0 votos)
6 vistas2 páginasTítulo original
C.cal
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
6 vistas2 páginasC Cal
Cargado por
Hassiel Ramirez AvilaCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
DATOS EXPERIMENTALES:
h
Υ=
h−h 1
h h1 h ϑ
h−h1
1.35
11.1 2.9 11.1
(11.1−2.9)
11.2 3 11.2 1.36
( 11.2−3 )
13.4 3.4 13.4 1.34
( 13.4−3.4 )
15.4 4 15.4 1.35
(15.4−4 )
RESULTADOS Y DISCUSION:
Considerando al gas como ideal, se demuestra que Υ es igual, aproximadamente,
a la relacion entre las diferencias de alturas manometricas: es decir la diferencia
entre la altura inicial ho y la obtenida al comprimir el gas, h1, dividida por la
diferencia entre la primera y la altura final del gas a temperatura ambiente, h2.
Se logra obtener la capacidad calorifica indirectamente de la formula
∆q
C=
AT
Con la formula
h
Υ=
h−h 1
Se observa un proceso adiabatico, definido asi porque no existe transferencia de
calor hacia el exterior debido a una pared adiabatica que aisla al exterior del
experimento. Lo cual provoca que se tenga una mejor medicion de presiones y
volumenes.
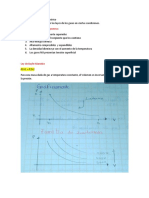
En la siguiente grafica se muestran los dos procesos.
CONCLUSIÓN:
Al finalizar el experimento, es mucho más sencillo, apoyado en la práctica, comprender el
funcionamiento de un proceso adiabático en el isoterma de un gas.
Gracias al aparato de Clement – Desormes, se puede calcular la capacidad calorífica de
un gas, únicamente tomando en cuenta la diferencia de alturas en el manómetro al
momento de someter a una mayor presión el gas contenido dentro de un recipiente, y el
efecto que provoca liberar un poco de esa misma presión para volver a determinar la
diferencia de alturas; lo anterior representa una manera básica y práctica de obtener el
coeficiente adiabático para cualquier gas.
Al realizar la evaluación, es notable la reversibilidad con la que cuenta este experimento,
puesto que el gas regresa a sus condiciones iniciales, gracias a que en ningún momento
se ve sometido a fuerzas que puedan alterar su estructura molecular.
BIBLIOGRAFIA:
Ira N Levine (2003) Fisicoquímica Tomo II 5ta edición
Maron y Prutton (1987). Fundamentos de fisicoquímica Ed.
También podría gustarte
- Tarea 3 de Cálculo para IBQ 2021 (A)Documento2 páginasTarea 3 de Cálculo para IBQ 2021 (A)Hassiel Ramirez AvilaAún no hay calificaciones
- Inv. Previa. Colorantes NaturalesDocumento3 páginasInv. Previa. Colorantes NaturalesHassiel Ramirez AvilaAún no hay calificaciones
- Problemario 1 Fernanda PalestinaDocumento10 páginasProblemario 1 Fernanda PalestinaHassiel Ramirez AvilaAún no hay calificaciones
- Tarea 2 de Cálculo para IBQ 2021 (A)Documento1 páginaTarea 2 de Cálculo para IBQ 2021 (A)Hassiel Ramirez AvilaAún no hay calificaciones
- Tarea 4 de Cálculo para IBQ 2021 (A)Documento2 páginasTarea 4 de Cálculo para IBQ 2021 (A)Hassiel Ramirez AvilaAún no hay calificaciones
- Tarea 8 de Cálculo para IBQ 2021 (A)Documento3 páginasTarea 8 de Cálculo para IBQ 2021 (A)Hassiel Ramirez Avila0% (1)
- Tarea 6 de Cálculo para IBQ 2021 (A)Documento3 páginasTarea 6 de Cálculo para IBQ 2021 (A)Hassiel Ramirez AvilaAún no hay calificaciones
- Tarea 1.1Documento2 páginasTarea 1.1Hassiel Ramirez AvilaAún no hay calificaciones
- Práctica 1, RefractometríaDocumento8 páginasPráctica 1, RefractometríaHassiel Ramirez AvilaAún no hay calificaciones
- Tarea 15Documento2 páginasTarea 15Hassiel Ramirez AvilaAún no hay calificaciones
- Tarea 2 de Cálculo para IBQ 2018Documento3 páginasTarea 2 de Cálculo para IBQ 2018Hassiel Ramirez Avila0% (1)
- Guía de Estudio Fisicoquímica 1er ParcialDocumento6 páginasGuía de Estudio Fisicoquímica 1er ParcialHassiel Ramirez AvilaAún no hay calificaciones
- 2da Práctica - DensidadDocumento3 páginas2da Práctica - DensidadHassiel Ramirez AvilaAún no hay calificaciones
- Tarea 1 de Cálculo para IBQ 2018Documento3 páginasTarea 1 de Cálculo para IBQ 2018Hassiel Ramirez AvilaAún no hay calificaciones
- Cálculo Difusividades de FickDocumento7 páginasCálculo Difusividades de FickDíaz CristianAún no hay calificaciones
- Repoerte 6 TFDocumento7 páginasRepoerte 6 TFDarinka Rivera GarciaAún no hay calificaciones
- 718772865.carta PsicrométricaDocumento4 páginas718772865.carta PsicrométricaAngela GarciaAún no hay calificaciones
- Apuntes Termodinamica Todos Los TemasDocumento158 páginasApuntes Termodinamica Todos Los Temasyago.delrio.cAún no hay calificaciones
- Calor Especifico Del GrafitoDocumento3 páginasCalor Especifico Del Grafitodarlis ballesta belloAún no hay calificaciones
- Destilación Simple y FraccionadaDocumento14 páginasDestilación Simple y FraccionadaRocha Valdovinos Aurelio NicolásAún no hay calificaciones
- Ejercicios Propuestos - Unidad 2 - GrupoDocumento16 páginasEjercicios Propuestos - Unidad 2 - GruponallelytomalaAún no hay calificaciones
- Termo IIDocumento6 páginasTermo IIHarving PerezAún no hay calificaciones
- Mecanica de Solidos Clase N&Deg 10 Efecto de La Temperatura, Por Ajustes y Deformaciones PreviasDocumento8 páginasMecanica de Solidos Clase N&Deg 10 Efecto de La Temperatura, Por Ajustes y Deformaciones Previasyasna_torres7165Aún no hay calificaciones
- Iccion 1Documento11 páginasIccion 1Davi MarcaAún no hay calificaciones
- Diseño de Un Sistema de Acondicionamiento de Aire en La Empresa Impresos DigitalesDocumento156 páginasDiseño de Un Sistema de Acondicionamiento de Aire en La Empresa Impresos DigitalesEdwin RodriguezAún no hay calificaciones
- EJERCICIOS DE REPASO CORTE 1 Taller 2Documento9 páginasEJERCICIOS DE REPASO CORTE 1 Taller 2AndamoAún no hay calificaciones
- Manual Del Curso Operador de Segunda, Plantas Proceso Criogenica No 1Documento89 páginasManual Del Curso Operador de Segunda, Plantas Proceso Criogenica No 1José Enrique CáceresAún no hay calificaciones
- Nmx-Ee-067-1979 Carta Psicrometrica 585 MMHGDocumento9 páginasNmx-Ee-067-1979 Carta Psicrometrica 585 MMHGjuanelo777Aún no hay calificaciones
- Secador de Aire Comprimido PDFDocumento4 páginasSecador de Aire Comprimido PDFJuan Alejandro Cañas ColoradoAún no hay calificaciones
- INFORME 6 de Tubo de Venturi 2022Documento7 páginasINFORME 6 de Tubo de Venturi 2022Harold Choque CanquiAún no hay calificaciones
- PuntoDocumento5 páginasPuntoMARIA MERCEDES MONTES DE OCA ESCOBARAún no hay calificaciones
- Informe 1-Medida de PresionDocumento21 páginasInforme 1-Medida de PresionAndrea AcuñaAún no hay calificaciones
- Marco Teorico Motor StirlingDocumento5 páginasMarco Teorico Motor StirlingAnely Carolina Garcia EscatelAún no hay calificaciones
- Vapor de AguaDocumento26 páginasVapor de AguaClaudia Patricia Ballen Garzon0% (1)
- Clase 3. Curva de SecadoDocumento44 páginasClase 3. Curva de SecadoNICOLL DAYANNA TORRES NAVASAún no hay calificaciones
- Mecanica de Suelos - Clase 9Documento55 páginasMecanica de Suelos - Clase 9Alexis Mariano R SantillanAún no hay calificaciones
- Calor de Combustion13Documento19 páginasCalor de Combustion13Jorge TrejoAún no hay calificaciones
- Examen Final de Resistencia de MaterialesDocumento10 páginasExamen Final de Resistencia de MaterialesCarlos De la RuaAún no hay calificaciones
- Carga Térmica de Refrigeracion Industrial Unac 2018 IIDocumento111 páginasCarga Térmica de Refrigeracion Industrial Unac 2018 IIEdson LeonardoAún no hay calificaciones
- Laboratorio # 2 HidraulicaDocumento10 páginasLaboratorio # 2 Hidraulicaluis vegaAún no hay calificaciones
- CAPÍTULO IV TURBOMAQUINAS HIDRAULICAS TURBINAS-2016-parte IDocumento13 páginasCAPÍTULO IV TURBOMAQUINAS HIDRAULICAS TURBINAS-2016-parte IAlfredo Pucho LeonAún no hay calificaciones
- 07 1ra Ley TermodinámicaDocumento30 páginas07 1ra Ley TermodinámicaCarlos RamirezAún no hay calificaciones
- TermoquimicaDocumento4 páginasTermoquimicaMarlon IlbayAún no hay calificaciones
- Proyecto Ley de DarcyDocumento12 páginasProyecto Ley de DarcySamuelSantosAún no hay calificaciones