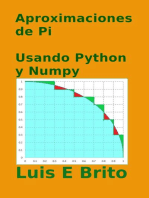
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Determina La Densidad Del Amoniaco (NH3) en G/la TPN Es
Cargado por
Damián Morales0 calificaciones0% encontró este documento útil (0 votos)
142 vistas2 páginasEl documento describe cómo calcular la densidad del amoníaco (NH3) a condiciones normales de presión y temperatura (TPN) utilizando la ecuación de los gases ideales. Explica que la densidad se calcula dividiendo la masa molecular del amoníaco (17 g/mol) entre el volumen a TPN. Esto da como resultado una densidad aproximada de 0,68 g/L para el amoníaco a TPN.
Descripción original:
Título original
62dbb0d92ac6ded5e44fd404a71725f6.pdf
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl documento describe cómo calcular la densidad del amoníaco (NH3) a condiciones normales de presión y temperatura (TPN) utilizando la ecuación de los gases ideales. Explica que la densidad se calcula dividiendo la masa molecular del amoníaco (17 g/mol) entre el volumen a TPN. Esto da como resultado una densidad aproximada de 0,68 g/L para el amoníaco a TPN.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
142 vistas2 páginasDetermina La Densidad Del Amoniaco (NH3) en G/la TPN Es
Cargado por
Damián MoralesEl documento describe cómo calcular la densidad del amoníaco (NH3) a condiciones normales de presión y temperatura (TPN) utilizando la ecuación de los gases ideales. Explica que la densidad se calcula dividiendo la masa molecular del amoníaco (17 g/mol) entre el volumen a TPN. Esto da como resultado una densidad aproximada de 0,68 g/L para el amoníaco a TPN.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
Determina la densidad del amoniaco
(NH3) en g/la TPN es
Vamos a aplicar la ecuación de los gases ideales, utilizando las
condiciones de T y P normales (TPN).
P: presión en atm
V: volumen en litros
n: número de moles
R: constante universal de los gases =
T: temperatura absoluta, en K
Condiciones normales (PTN):
T=0°C = 273,15 k
P= 1 atm
Vamos a transformar la ecuación anterior para que nos dé la densidad.
Para ello, los moles (n) los multiplicamos por la masa molecular (mm),
para obtener gramos y esto lo dividimos entre el volumen (V), para que
sea densidad (d). Veamos:
Usemos el hecho de que el número de moles, n, es igual a la masa
×masa molecular, mm, es decir:
, de donde despejamos
Lo cual sustituimos en la ecuación anterior, para obtener:
La masa molecular (mm) del amoníaco la calculamos con las masas
atómicas de los elementos que componen su fórmula molecular, NH3:
Masa atómica del hidrógeno, H: 1 g/mol
Masa atómica del nitrógeno, N: 14 g/mol
Masa molecular del NH3, mm= 14 g/mol + 3×1 g/mol = 17 g/mol
Sustituimos los valores en la ecuación que hallamos arriba para la
densidad, d:
Te invito a que consultes en Internet la densida para el amoníaco a ver
si se verifica este resultado. Recuerda que se trata de una
aproximación, puesto que los gases cumplen la ecuación de estado de
gases ideales solo de manera aproximada.
También podría gustarte
- Problemas Adicionales Resueltos GASESDocumento10 páginasProblemas Adicionales Resueltos GASESYoel Vales100% (1)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Seminario Nº7 - Gases - Problemas ResueltosDocumento19 páginasSeminario Nº7 - Gases - Problemas ResueltosRANDOM GAMESAún no hay calificaciones
- Fundamentos Termodinamicos de La PirometalurgiaDocumento14 páginasFundamentos Termodinamicos de La PirometalurgiaBaruc Lopez TorresAún no hay calificaciones
- Quimica General Gases Ejercicios Tipo ResueltosDocumento12 páginasQuimica General Gases Ejercicios Tipo ResueltosCamilo AlbornozAún no hay calificaciones
- Ley de Los Gases IdealesDocumento4 páginasLey de Los Gases IdealesCArlosAún no hay calificaciones
- Quimica TerminadoDocumento21 páginasQuimica TerminadoValentina Ortiz mejiaAún no hay calificaciones
- Lima Cuin Brandon - Tarea 6 - Ley de Dalton y Ley de AmagatDocumento9 páginasLima Cuin Brandon - Tarea 6 - Ley de Dalton y Ley de AmagatJaneth Sainz CampilloAún no hay calificaciones
- Termodinámica GasesDocumento16 páginasTermodinámica GasesAngel EuanAún no hay calificaciones
- Determinación de La Masa Molar de Un GasDocumento9 páginasDeterminación de La Masa Molar de Un GasJaviera Orellana SilvaAún no hay calificaciones
- Ejercicios Resueltos-Gases IdealesDocumento7 páginasEjercicios Resueltos-Gases IdealesMiriam Vanessa Cáceres RetuertoAún no hay calificaciones
- Ejercicios BrunoDocumento3 páginasEjercicios Brunomaite.recabal2272Aún no hay calificaciones
- TermodinamicaDocumento16 páginasTermodinamicaLUIS HERNANDEZAún no hay calificaciones
- BME - Semana 2-Adic RealDocumento67 páginasBME - Semana 2-Adic RealGaby GarciaAún no hay calificaciones
- Mezcla de GasesDocumento7 páginasMezcla de GasesRicardo GarcíaAún no hay calificaciones
- Guia Unidad 2 Gas Ideal Con Algunos Ejercicios ResueltosDocumento11 páginasGuia Unidad 2 Gas Ideal Con Algunos Ejercicios ResueltosCristian MeneAún no hay calificaciones
- Gases Ideales y Sus LeyesDocumento7 páginasGases Ideales y Sus LeyesMarlene SotoAún no hay calificaciones
- Materia Gases y Disoluciones 1° BachDocumento11 páginasMateria Gases y Disoluciones 1° BachMCAún no hay calificaciones
- Problemas Resueltos de Gases IdealesDocumento4 páginasProblemas Resueltos de Gases IdealesAlejandro Suarez PérezAún no hay calificaciones
- Unidad 1 Problemas ResueltosDocumento9 páginasUnidad 1 Problemas ResueltosIver Samuel Medina BAún no hay calificaciones
- Clase 5.2 GasesDocumento18 páginasClase 5.2 GasesIgnacio Barría LlancaAún no hay calificaciones
- Guia 9Documento3 páginasGuia 9gomalapidolucianoAún no hay calificaciones
- Relación Del Volumen Con El Número de MolesDocumento2 páginasRelación Del Volumen Con El Número de Molesyejopiro859740Aún no hay calificaciones
- Ejercicios Resueltos de Gases IdealesDocumento5 páginasEjercicios Resueltos de Gases IdealesProf. diseñoAún no hay calificaciones
- 5 Capitulo V LFFIIDocumento38 páginas5 Capitulo V LFFIIMarcus ClaydAún no hay calificaciones
- ExcelDocumento16 páginasExcelruben romanAún no hay calificaciones
- Ley de Los GasesDocumento7 páginasLey de Los Gasesjulio camposAún no hay calificaciones
- Ejercicios Resueltos de Gases IdealesDocumento6 páginasEjercicios Resueltos de Gases IdealesRigoberto100% (1)
- Termodinamica Ejercicios ResueltosDocumento61 páginasTermodinamica Ejercicios ResueltosErick Vega OchoaAún no hay calificaciones
- Ejercicios Resueltos de Gases IdealesDocumento16 páginasEjercicios Resueltos de Gases Idealesjose peres bernalAún no hay calificaciones
- Ejercicios Resueltos de Gases IdealesDocumento5 páginasEjercicios Resueltos de Gases IdealesCR7OENDERAún no hay calificaciones
- Unidad 2 PropiedadesDocumento32 páginasUnidad 2 PropiedadesThaiAún no hay calificaciones
- Determinación de La Fórmula Empírica de Un Compuesto Conocida Su Composición CentesimalDocumento6 páginasDeterminación de La Fórmula Empírica de Un Compuesto Conocida Su Composición CentesimalAlex Eduard Campos LealAún no hay calificaciones
- Resumen Laboratorio TermodinamicaDocumento13 páginasResumen Laboratorio TermodinamicaBrenda Angelica Alarcón TorresAún no hay calificaciones
- Lab#1 - Mec110 Termodinámica 2018 2Documento3 páginasLab#1 - Mec110 Termodinámica 2018 2RODRIGO ESTEBAN GONZÁLEZAún no hay calificaciones
- Presentación de Proyecto Hojas de Libreta Divertido BlancoDocumento18 páginasPresentación de Proyecto Hojas de Libreta Divertido Blancodiazluisangel041Aún no hay calificaciones
- Resolucion Unidad 4 2da ParteDocumento8 páginasResolucion Unidad 4 2da ParteedgardAún no hay calificaciones
- Problemas Resueltos de Gases IdealesDocumento5 páginasProblemas Resueltos de Gases IdealesJair Eviel Barrios Deluquez93% (15)
- Problemas Resueltos de Gases Ideales PDFDocumento5 páginasProblemas Resueltos de Gases Ideales PDFCamila MosqueraAún no hay calificaciones
- QM 1121 Ejercicios Resueltos de Gases IdealesDocumento6 páginasQM 1121 Ejercicios Resueltos de Gases IdealesmaryjoseAún no hay calificaciones
- Ejercicios Resueltos GasesDocumento11 páginasEjercicios Resueltos GasesLeonardo Suarez Mollinedo100% (2)
- Ejemplos 1. Resueltos Aplicacion de Leyes de Los GasesDocumento5 páginasEjemplos 1. Resueltos Aplicacion de Leyes de Los GasesDariana Millán CorreaAún no hay calificaciones
- 2.3.3 Propiedades de Mezcla de Gases Ideales-DimsDocumento11 páginas2.3.3 Propiedades de Mezcla de Gases Ideales-DimsIvan SolisAún no hay calificaciones
- Gases Ideales 010Documento40 páginasGases Ideales 010Maria Del Pilar VELA FONTISAún no hay calificaciones
- MAT02Documento25 páginasMAT02Edward Tace100% (1)
- QUÍMICA GENERAL (Gases)Documento34 páginasQUÍMICA GENERAL (Gases)nico jordanAún no hay calificaciones
- Actividad Sumativa #3 Química Andres Gutierrez 29511511Documento6 páginasActividad Sumativa #3 Química Andres Gutierrez 29511511AndresGuti 14Aún no hay calificaciones
- Analisis Presion Vs DensidadDocumento2 páginasAnalisis Presion Vs DensidadMateo DiazAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Curso básico de teoría de númerosDe EverandCurso básico de teoría de númerosCalificación: 5 de 5 estrellas5/5 (2)
- Determina La Densidad Del Amoniaco (NH3) en G/la TPN EsDocumento2 páginasDetermina La Densidad Del Amoniaco (NH3) en G/la TPN EsDamián MoralesAún no hay calificaciones
- Cuadro SignoticoDocumento1 páginaCuadro SignoticoDamián MoralesAún no hay calificaciones
- Practica 10Documento13 páginasPractica 10Damián MoralesAún no hay calificaciones
- Oxidacion y ReduccionDocumento16 páginasOxidacion y ReduccionDamián MoralesAún no hay calificaciones