Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tema 3 - Modulo II-2019-PRESENTACION-1
Cargado por
Camila García0 calificaciones0% encontró este documento útil (0 votos)
23 vistas45 páginasfisicoquimica II
Título original
tema 3 - modulo II-2019-PRESENTACION-1
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentofisicoquimica II
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
23 vistas45 páginasTema 3 - Modulo II-2019-PRESENTACION-1
Cargado por
Camila Garcíafisicoquimica II
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 45
Tema nº 3
▪ Cuando la superficie de un sólido se encuentra en
contacto con un fluido, líquido o gas, hay una interacción
entre los campos de fuerzas de la superficie del sólido y
los de dicho fluido.
▪ Cuando las moléculas del fluido contactan la superficie
de un sólido, algunas de estas moléculas se adhieren a
la superficie, mientras otras escapan de ella. El
fenómeno que resulta de este desbalance de fuerzas
moleculares presentes en la superficie sólida se llama
adsorción, siendo el sólido el adsorbente y el fluido (gas
o líquido), el adsorbato.
Etapa 1. Difusión externa.
El adsorbato se aproxima a la superficie externa del sólido, para lograrlo,
debe vencer la resistencia de una fina capa acumulada alrededor del
adsorbente (interface sólido-fluido).
Etapa 2. Difusión interna. Debido a que la superficie externa expuesta
por las partículas tiende a ser menor al 1% del total, el adsorbato migra a
través de la red porosa del sólido.
Etapa 3. La adsorción del adsorbato. En esta etapa, el adsorbato se
adhiere a la superficie del adsorbente.
Porosidad del carbón activado
La capacidad de adsorción del carbón activado, así como
su comportamiento, depende directamente de su textura
porosa y de su química superficial.
Dentro de la textura porosa, están incluidos la superficie
específica, el volumen de poro y la distribución de tamaño
de poro. La mayoría de los carbones activados tienen un
área superficial específica del orden de 800 a 1500 m2/g y
un volumen de poro del orden de 0,20 a 0,60 cm3/g.
Según la IUPAC, los poros se clasifican en tres grupos:
• microporos,
• mesoporos y
• macroporos.
1.5. Tipos de Adsorción
Según la naturaleza de las fuerzas involucradas, la
adsorción es de dos tipos:
• fisisorción
• quimisorción.
En el caso de la fisisorción, el adsorbato se encuentra unido
débilmente a la superficie del sólido por fuerzas de van der Waals, las
cuales se asemejan a las fuerzas de cohesión involucradas en las
condensación de vapores a líquidos.
En cambio, la quimisorción involucra un intercambio o una
compartición de electrones entre las moléculas de
adsorbato y la superficie del adsorbente dando como
resultado una reacción química. La quimisorción es la etapa
inicial de cualquier proceso catalítico.
1.6. ISOTERMAS DE ADSORCIÓN
Las isotermas de adsorción son las funciones matemáticas
más usadas para describir los procesos de adsorción.
Se construyen relacionando la capacidad de adsorción del
adsorbente (q) versus la concentración o presión en
equilibrio de su precursor en el fluido, manteniendo
constante las otras variables involucradas
(pH, masa del adsorbente, tiempo de contacto, entre
otras).
Esta relación depende considerablemente de la
temperatura del sistema, por ello se obtiene a temperatura
constante.
1.6.1. Isotermas de adsorción en un sistema sólido-gas
En un sistema sólido-gas, la isoterma a una temperatura
dada relaciona la cantidad adsorbida (nad) en el material
adsorbente a distintas presiones relativas (P/P0).
La Unión Internacional de Química Pura y Aplicada (IUPAC)
clasifica las isotermas de adsorción en seis tipos, los cuales
se muestran.
1.6.2. Isotermas de adsorción en un sistema sólido-líquido
La adsorción en un sistema sólido-líquido es un proceso frecuente (ya que
muchos contaminantes se encuentran en solución), pero a su vez es más
complejo que en un sistema sólido-gas. Esto se debe a que el solvente
podría participar en el proceso de adsorción (adsorción cooperativa)
compitiendo con el o los solutos por ocupar los centros activos del
adsorbente.
Las isotermas de adsorción en el sistema sólido-líquido se obtienen
relacionando la cantidad de soluto adsorbido por gramo de adsorbente (qe)
versus la concentración del soluto en el equilibrio (Ce)
Para describir las isotermas de equilibrio para un solo
componente existen muchos modelos de isotermas. Entre
los más usados para un sistema sólido-líquido están el de
Freundlich, Langmuir, Temkin, Elovich, entre otras.
a) Isoterma de Langmuir
En 1916, Langmuir desarrolló un modelo simple para tratar de predecir el
grado de adsorción de un gas sobre una superficie como función de la presión
del fluido. En este modelo se supone que:
1) el adsorbato forma una capa monomolecular sobre la superficie;
2) todos los sitios de la superficie son equivalentes;
3) no hay interacción entre las partículas adsorbidas y
4) las moléculas adsorbidas no tienen movimiento sobre la superficie
(Daniels, 1984).
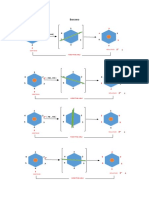
En el modelo de Langmuir se propone el siguiente esquema dinámico para
representar la adsorción:
donde A simboliza al adsorbato gaseoso, S al adsorbente sólido, y AS al complejo
adsorbente-adsorbato
La velocidad del cambio de la superficie cubierta
adsorción es proporcional a la presión parcial de A
Y el número de sitios vacantes , donde N
Es el número total de sitios .
La velocidad del cambio de la fracción ocupada
Es proporcional al número de especies adsorbidas
N
En el equilibrio no existe un cambio neto
( esto es la suma de las dos velocidades es cero)
Resolviendo para da la ecuación de LANGMUIR
El modelo de Langmuir, es válido para la adsorción
sobre una superficie con un número finito de sitios
idénticos, los cuales se consideran que están
homogéneamente distribuidos sobre la superficie del
adsorbente.
Se expresa de la siguiente manera:
Donde: qm y b son los parámetros de Langmuir
relacionados a la máxima capacidad de adsorción y la
energía de enlace de la adsorción, respectivamente. qe
es la concentración del soluto retenido en el adsorbente
en el equilibrio (mg g-1) Ce es la concentración de soluto
en la solución en el equilibrio (mg L-1)
La ecuación precedente puede ser linealizada
como se muestra a continuación:
Problema de estudio
Con , donde V infinito corresponde al
volumen para cobertura completa del
Adsorbente, esta expresión puede ser linealizada
b) Isoterma de Freundlich
El modelo de Freundlich está basado en la adsorción sobre
una superficie energéticamente heterogénea; es decir, los
sitios de adsorción con la misma energía de interacción
adsorbato-adsorbente se encuentran agrupados en
pequeñas áreas, sugiriendo que los sitios de enlace no son
equivalentes.
Se caracteriza por la siguiente ecuación:
Donde:
qe es la concentración del soluto retenido en el adsorbente en el equilibrio (mg
g-1) Ce es la concentración de soluto en la solución en el equilibrio (mg L-1)
KF es la medida de la capacidad del adsorbente (mg1-1/n L1/n g-1) n indica la
intensidad de la adsorción.
También podría gustarte
- San Agustin de Hipona Filosofia ResumenDocumento3 páginasSan Agustin de Hipona Filosofia ResumennyitadoriaAún no hay calificaciones
- Estudio Calidad de AguaDocumento21 páginasEstudio Calidad de AguaAarón Tejada HuarangaAún no hay calificaciones
- AglomerantesDocumento3 páginasAglomerantesSMITH HERRERA JIMENEZAún no hay calificaciones
- Elaboracion Pate de HigadoDocumento8 páginasElaboracion Pate de HigadoSegundo J GonzalesAún no hay calificaciones
- Ficha de Trabajo 11Documento5 páginasFicha de Trabajo 11Diego PortalAún no hay calificaciones
- Sol AmigurumiDocumento2 páginasSol AmigurumiAndreina Fermin100% (1)
- PDF Problemario Respuesta - CompressDocumento6 páginasPDF Problemario Respuesta - CompressCamila GarcíaAún no hay calificaciones
- GUIADocumento3 páginasGUIACamila GarcíaAún no hay calificaciones
- Energia CalorificaDocumento3 páginasEnergia CalorificaCamila GarcíaAún no hay calificaciones
- Formatos y Guia para Publicacion de Articulos Academicos y CientificosDocumento5 páginasFormatos y Guia para Publicacion de Articulos Academicos y CientificosCamila GarcíaAún no hay calificaciones
- Problemario - Primer Parcial-2020Documento10 páginasProblemario - Primer Parcial-2020Camila García100% (1)
- PROBLEMARIO - 2do Parcial - CARBONILO - MASASDocumento12 páginasPROBLEMARIO - 2do Parcial - CARBONILO - MASASCamila GarcíaAún no hay calificaciones
- Tema 1 - Sustitucion-2020-Aula 1Documento34 páginasTema 1 - Sustitucion-2020-Aula 1Camila GarcíaAún no hay calificaciones
- Benceno y MetanoDocumento2 páginasBenceno y MetanoCamila GarcíaAún no hay calificaciones
- D - Tema - 4 - 18 ElectronesDocumento14 páginasD - Tema - 4 - 18 ElectronesCamila GarcíaAún no hay calificaciones
- Tema 1 - Mecanismo de Sustitucion - Aula 3 - 2020Documento27 páginasTema 1 - Mecanismo de Sustitucion - Aula 3 - 2020Camila GarcíaAún no hay calificaciones
- Analitica Basica FlujogramaDocumento1 páginaAnalitica Basica FlujogramaCamila GarcíaAún no hay calificaciones
- Analisis YogurtDocumento57 páginasAnalisis YogurtALexVg0% (2)
- Tema 1 - SUSTITUCION - 2020 - AULA 2Documento55 páginasTema 1 - SUSTITUCION - 2020 - AULA 2Camila GarcíaAún no hay calificaciones
- Tema 2 Fisicoquimica II - Cinetica II-2019-PRESENTACION 5-1Documento42 páginasTema 2 Fisicoquimica II - Cinetica II-2019-PRESENTACION 5-1Camila GarcíaAún no hay calificaciones
- TEMA 2 - Cinetica II - PRESENTACION 4-2019-1Documento22 páginasTEMA 2 - Cinetica II - PRESENTACION 4-2019-1Camila GarcíaAún no hay calificaciones
- Tema 3 - Fisicoquimica II - Modulo II-2019-AULA 2Documento23 páginasTema 3 - Fisicoquimica II - Modulo II-2019-AULA 2Camila GarcíaAún no hay calificaciones
- Tema 3 - Fisicoquimica II - Modulo II-2019-AULA - 3Documento23 páginasTema 3 - Fisicoquimica II - Modulo II-2019-AULA - 3Camila GarcíaAún no hay calificaciones
- Compuestos OrganometalicosDocumento12 páginasCompuestos OrganometalicosCamila GarcíaAún no hay calificaciones
- Compuestos OrganometalicosDocumento12 páginasCompuestos OrganometalicosCamila GarcíaAún no hay calificaciones
- DayanaDocumento1 páginaDayanaCamila GarcíaAún no hay calificaciones
- Planificacion Geografía 4to Año Computacion 2023Documento3 páginasPlanificacion Geografía 4to Año Computacion 2023Federico Gonzalo CaviedesAún no hay calificaciones
- Tipos y Causas de Errores de MedicaciónDocumento29 páginasTipos y Causas de Errores de MedicaciónQF Felipe González0% (1)
- Audios Antiguos MonroeDocumento2 páginasAudios Antiguos MonroeMario CalvoAún no hay calificaciones
- Elementos Básicos de La PsicomotricidadDocumento9 páginasElementos Básicos de La PsicomotricidadRita Rossana Sepulveda CrisostomoAún no hay calificaciones
- Analizador SKF Microlog Serie GX: Cmxa 75Documento8 páginasAnalizador SKF Microlog Serie GX: Cmxa 75Resquín Orovio AntonioAún no hay calificaciones
- Practica 12Documento4 páginasPractica 12Cesar Mv100% (1)
- Dimensionamiento de TranqueDocumento41 páginasDimensionamiento de TranqueOmar Solis100% (1)
- Acentor AlpinoDocumento5 páginasAcentor AlpinoPablo Fernández PeroAún no hay calificaciones
- Problemas Tema 3 ElectromagnetismoDocumento3 páginasProblemas Tema 3 ElectromagnetismoAdrian CarvajalAún no hay calificaciones
- Actividad 20 Semana Del 06 de Setiembre 2021 EfDocumento2 páginasActividad 20 Semana Del 06 de Setiembre 2021 EfEduardo Maximo Padin GonzalesAún no hay calificaciones
- Bacterias Beneficiadas en La LecheDocumento3 páginasBacterias Beneficiadas en La LecheEvelyn Brolrzovich ZuloetaAún no hay calificaciones
- Salvador RuedaDocumento10 páginasSalvador RuedaRoberto EscañoAún no hay calificaciones
- Guia QuimicaDocumento13 páginasGuia QuimicaAngel Jacob Cabrera MartínezAún no hay calificaciones
- 8 Biol 5 SM T1 2022-220316-131336Documento92 páginas8 Biol 5 SM T1 2022-220316-131336Earlyna Espinoza CuevaAún no hay calificaciones
- PDF 20230621 150824 0000Documento10 páginasPDF 20230621 150824 0000Mari Jose Vazquez SanchezAún no hay calificaciones
- Prae FinalDocumento25 páginasPrae FinalJosé Miguel Dau CrespoAún no hay calificaciones
- Proyecto MiguelDocumento48 páginasProyecto Migueleliana caroAún no hay calificaciones
- HM6116Documento4 páginasHM6116Samuel CanasaAún no hay calificaciones
- Probabilidad y Estadistica Sin RespuestasDocumento54 páginasProbabilidad y Estadistica Sin RespuestasIsmael Ramirez100% (3)
- Peste y Leptospirosis FinalDocumento23 páginasPeste y Leptospirosis FinalChristian Castro SanchezAún no hay calificaciones
- Medula EspinalDocumento37 páginasMedula EspinalMaría José TochónAún no hay calificaciones
- La Felicidad RepulsivaDocumento11 páginasLa Felicidad RepulsivaPatricia ÁvilaAún no hay calificaciones
- Aguas ResidualesDocumento2 páginasAguas ResidualesDavid MartínezAún no hay calificaciones
- Alteraciones Post-Mortem, Necropsia y MuestrasDocumento16 páginasAlteraciones Post-Mortem, Necropsia y MuestrasDaniela BañosAún no hay calificaciones