Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Taller Primera Ley PDF
Taller Primera Ley PDF
Cargado por
JohanMorenoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Taller Primera Ley PDF
Taller Primera Ley PDF
Cargado por
JohanMorenoCopyright:
Formatos disponibles
EJERCICIOS REPASO PRIMERA LEY
FISICOQUIMICA UNIVERSIDAD DE LA SALLE
1. Una cierta cantidad de neón que se encuentra a 1 atmósfera de presión y 273 K experimenta una
compresión adiabática reduciendo su volumen a la mitad. Determine la presión y la temperatura finales.
2. Una cantidad de 0,227 moles de un gas que se comporta idealmente se expande isotérmicamente y en
forma reversible desde un volumen de 5 L hasta dos veces ese volumen a 27 oC. ¿Cuál será el valor de Q,
W, E y H?
3. 1 mol de hidrógeno a 1 atmósfera de presión y 0 ºC se comprime isotérmicamente hasta que su volumen
se reduce a la mitad. Luego se expande adiabáticamente hasta recuperar la presión inicial. Calcule
a) El trabajo realizado b) El calor transferido c) La variación de energía interna.
4. Se tiene un gas que ocupa un volumen de 2 L a una presión de 12 atm y temperatura de 25 °C. El gas se
expande sucesivamente e isotérmicamente, tomando los siguientes valores para el volumen: 4 L, 8 L y 16
L. Calcule: a) El trabajo realizado por el gas en su expansión.
5. Dos litros de nitrógeno a 0ºC y 5 atmósferas de presión se expanden isotérmicamente, hasta alcanzar una
presión de l atm. Suponiendo que el gas es ideal, hallar: a)W; b) ΔU; c) ΔH; d) Q.
6. Un mol de gas ideal sufre una expansión reversible e isotérmica, desde un volumen inicial V1 hasta un
volumen final 10V1. Durante dicho proceso el gas realiza 1000 calorías de trabajo. Si la presión inicial era
100 atm, calcular: a) V1 y b) Si había 2 moles de gas, cuál será su temperatura.
7. El valor promedio del Cp para el CO2 (g) entre 0°C y 100°C es de 8,90 cal/K. Se calientan 10 moles de este
gas desde 0°C hasta 100°C, a presión constante. Calcule: a) Q b) W c) ΔH y d)ΔU
8. Un mol de gas ideal monoatómico realiza el siguiente ciclo reversible: a) Calentamiento adiabático desde
P1=4 atm; V1 y T1 = 300oC hasta P2, V2 y T2=5/3T1. b) Enfriamiento isocórico hasta una P3 = P1 y T3. c)
Calentamiento isobárico desde P3, V3 y T3 hasta las condiciones iniciales. Calcular E, H, Q y W en cada
una de las etapas y en el ciclo.
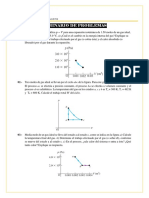
9. Un gas ideal inicialmente a P;. Vi y Ti se lleva por un ciclo como se ve en la figura. (a) Encuentre el trabajo
neto realizado sobre el gas por ciclo. (b) ¿Cuál es la energía neta agregada por calor al sistema por ciclo?
(c) Obtenga un valor numérico para el trabajo neto realizado por ciclo para 1 mol de gas inicialmente a
0°C.
JOHANNA MENDOZA G. Fisicoquímica 2018-2
También podría gustarte
- Seminario Resuelto Sobre Gases IdealesDocumento10 páginasSeminario Resuelto Sobre Gases IdealesMilton Escudero Miranda0% (1)
- Ejercicios Termodinamica BasicaDocumento13 páginasEjercicios Termodinamica BasicaNicolas Vasquez36% (11)
- Hoja de Problemas #04Documento4 páginasHoja de Problemas #04Paul Quiroz AliagaAún no hay calificaciones
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Guía de Ejercicios Tema 3Documento4 páginasGuía de Ejercicios Tema 3Kleidder ZacariasAún no hay calificaciones
- TermodinamicaDocumento4 páginasTermodinamicaJimmy Erick Luque MamaniAún no hay calificaciones
- 3 TermodinamicaDocumento3 páginas3 TermodinamicaMarubiru SeruAún no hay calificaciones
- Primera Ley de La TermodinamicaDocumento2 páginasPrimera Ley de La Termodinamicajesus orlando peñaloza contrerasAún no hay calificaciones
- 9-Seminario Termo 2018-2Documento2 páginas9-Seminario Termo 2018-2Edgar Alberto Palomino HuamaniAún no hay calificaciones
- 006629420Documento4 páginas006629420Jesús JacksonAún no hay calificaciones
- Ejercicios PAFDocumento2 páginasEjercicios PAFJefferson Herrera IncioAún no hay calificaciones
- FseyndrxuDocumento4 páginasFseyndrxuMiguel SaavedraAún no hay calificaciones
- Ejercicios de TermodinámicaDocumento2 páginasEjercicios de TermodinámicaJenner Alexander Naquiche Horna0% (2)
- Trabajo - Termodinamica PDFDocumento2 páginasTrabajo - Termodinamica PDFExamenesPorWhatsappAún no hay calificaciones
- Quimica ProblemasDocumento6 páginasQuimica ProblemasDiana RHAún no hay calificaciones
- Guia 19 PDFDocumento4 páginasGuia 19 PDFCaroll IsabelAún no hay calificaciones
- T7 Sem14 Ses3 Practica-2023-Ciclo MarzoDocumento2 páginasT7 Sem14 Ses3 Practica-2023-Ciclo MarzoEdwinRobertoCustodioAún no hay calificaciones
- Taller 1 PDFDocumento10 páginasTaller 1 PDFMonica OramasAún no hay calificaciones
- Taller 1Documento10 páginasTaller 1Juan Camilo DicueAún no hay calificaciones
- Problemas de 1° Ley de La TermodinamicaDocumento3 páginasProblemas de 1° Ley de La TermodinamicaKevin Caceres CruzAún no hay calificaciones
- Ejercicios W y Q. Primera Ley 2020-IDocumento7 páginasEjercicios W y Q. Primera Ley 2020-IOleggValVilAún no hay calificaciones
- Primer Taller FisicoquímicaDocumento3 páginasPrimer Taller FisicoquímicaGustavo Contreras OtalvaroAún no hay calificaciones
- Taller 2-GASES Y Ciclos - 2020Documento2 páginasTaller 2-GASES Y Ciclos - 2020caren malpicaAún no hay calificaciones
- 02 - Gases y TransformacionesDocumento2 páginas02 - Gases y TransformacionesfacundoAún no hay calificaciones
- Licenciatura HyS - Fisica - TP 5 - 6Documento3 páginasLicenciatura HyS - Fisica - TP 5 - 6Carlos Benjamin PaezAún no hay calificaciones
- Problemario Primera Ley TermodinámicaDocumento4 páginasProblemario Primera Ley TermodinámicajearlugAún no hay calificaciones
- Primer Principio 2023Documento5 páginasPrimer Principio 2023Martin RodriguezAún no hay calificaciones
- Problemas Propuestos Primera LeyDocumento3 páginasProblemas Propuestos Primera LeyJunior PeñaAún no hay calificaciones
- S15-FG - Chinchay Garcia Eduin Omar.Documento8 páginasS15-FG - Chinchay Garcia Eduin Omar.Ch G Omąr100% (1)
- Ejercicios Primera Ley TermodinámicaDocumento9 páginasEjercicios Primera Ley TermodinámicabrayanfloresmerinoAún no hay calificaciones
- Practica No 13 Fisica NRC 3617 2022-2 PDFDocumento3 páginasPractica No 13 Fisica NRC 3617 2022-2 PDFGena546Aún no hay calificaciones
- Serie de Problemas #1 Termodinamica IIDocumento4 páginasSerie de Problemas #1 Termodinamica IIFrank C. Flores100% (1)
- Gua N1 Termodinmica 2015Documento9 páginasGua N1 Termodinmica 2015Elías Raphael Rubilar BugueñoAún no hay calificaciones
- 1o LeyDocumento4 páginas1o LeyneedformaxAún no hay calificaciones
- Ley TermodinamicaDocumento6 páginasLey TermodinamicaEdgard RodríguezAún no hay calificaciones
- Guía de TermodinámicaDocumento9 páginasGuía de TermodinámicaJavier CortésAún no hay calificaciones
- Guía 1 PDFDocumento3 páginasGuía 1 PDFDaniel Andres Roa UmañaAún no hay calificaciones
- Taller Primera LeyDocumento4 páginasTaller Primera LeyScribdLibros11Aún no hay calificaciones
- Primer Taller VirtualDocumento1 páginaPrimer Taller VirtualDi-Al Ar-TeAún no hay calificaciones
- Actividad de Aprendizaje - N°07Documento4 páginasActividad de Aprendizaje - N°07JadeAún no hay calificaciones
- Taller 1Documento10 páginasTaller 1Monica Oramas0% (2)
- Problemas Tema 2Documento2 páginasProblemas Tema 2José Rafael GuillénAún no hay calificaciones
- Ejercicios Resueltos de Termodinamica PDFDocumento21 páginasEjercicios Resueltos de Termodinamica PDFMarco SánchezAún no hay calificaciones
- Problemas Bis 2013Documento3 páginasProblemas Bis 2013Emanuel TejadaAún no hay calificaciones
- Problemas de Física 1 Semana 6Documento3 páginasProblemas de Física 1 Semana 6ALONSO CONDORI CORNEJOAún no hay calificaciones
- Guia 1 Primera Ley GasesDocumento7 páginasGuia 1 Primera Ley GasesGeraldineAún no hay calificaciones
- EJERCICIOS 9 (Termodinamica)Documento3 páginasEJERCICIOS 9 (Termodinamica)Jenny UlloaAún no hay calificaciones
- Ejercicios Recomendados-Termodinamica 1leyDocumento3 páginasEjercicios Recomendados-Termodinamica 1leyLily Margareth ArrietaAún no hay calificaciones
- Ejercicios Termodinámica - Gonzales - Culque - CristhyanDocumento20 páginasEjercicios Termodinámica - Gonzales - Culque - CristhyanGONZALES CulqueAún no hay calificaciones
- Taller IDocumento11 páginasTaller ILUIS CARLOS ROMERO ZAPATAAún no hay calificaciones
- Alcances y Fortalezas de Un SigDocumento2 páginasAlcances y Fortalezas de Un SigSamantha SalinasAún no hay calificaciones
- Taller Numero 3Documento4 páginasTaller Numero 3Daniel DBAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Experiencias sobre la propiedad temperaturaDe EverandExperiencias sobre la propiedad temperaturaAún no hay calificaciones
- Actividad Evaluativa Eje 2 - Proyecto de InvestigacionDocumento27 páginasActividad Evaluativa Eje 2 - Proyecto de InvestigacionAdrianAún no hay calificaciones
- Burger KingDocumento17 páginasBurger KingmonyAún no hay calificaciones
- Caso Práctico Tema 1 MF1445 - 3Documento5 páginasCaso Práctico Tema 1 MF1445 - 3gemaAún no hay calificaciones
- Una Estructura Criminal Conformada Por Policías Hondureños Enviaba Armas A Las FARC de ColombiaDocumento6 páginasUna Estructura Criminal Conformada Por Policías Hondureños Enviaba Armas A Las FARC de ColombiaPedro ParamoAún no hay calificaciones
- Ejercicio P2-34ADocumento7 páginasEjercicio P2-34ALuis E. VargasAún no hay calificaciones
- Vacuna CovidDocumento22 páginasVacuna CovidLisseth Miranda CavaAún no hay calificaciones
- Monografía La Gestion Del Talento HumanoDocumento19 páginasMonografía La Gestion Del Talento HumanoHarold CumAún no hay calificaciones
- Plan de Mantenimiento Mantencion Alternador, Integracion Automotriz1Documento8 páginasPlan de Mantenimiento Mantencion Alternador, Integracion Automotriz1Gae Gu AntonioAún no hay calificaciones
- Piratería y Falsificación de SoftwaresDocumento4 páginasPiratería y Falsificación de SoftwaresYuuviia VegaAún no hay calificaciones
- MSDS Sikaflex-227 SPDocumento10 páginasMSDS Sikaflex-227 SPCintia RrosAún no hay calificaciones
- Trabajo Practico 1 FotografiaDocumento4 páginasTrabajo Practico 1 FotografiaNaza BaldoAún no hay calificaciones
- Victoria - Control 1 Contabilidad IACCDocumento4 páginasVictoria - Control 1 Contabilidad IACCclaudio hurtadoAún no hay calificaciones
- Plan de Tesis - Mamani Chayña Luis AngelDocumento9 páginasPlan de Tesis - Mamani Chayña Luis AngelLouis GassetAún no hay calificaciones
- Sistemas Fotovoltaicos P&GDocumento44 páginasSistemas Fotovoltaicos P&GJona AmilAún no hay calificaciones
- Terminacion Con Cañeria BaleadaDocumento7 páginasTerminacion Con Cañeria Baleadavane230991Aún no hay calificaciones
- Examen Implementacion Base de Datos Dba0002Documento4 páginasExamen Implementacion Base de Datos Dba0002Jeison Samir CastroAún no hay calificaciones
- Informe Semestral Academico 2023-28-12Documento2 páginasInforme Semestral Academico 2023-28-12margarita lanchipaAún no hay calificaciones
- Absorcion PresentacionDocumento26 páginasAbsorcion PresentacionPaola Robles VásquezAún no hay calificaciones
- Curvas Características de Una Bomba y CompresorDocumento8 páginasCurvas Características de Una Bomba y CompresorAnita López Liahut83% (6)
- Guia de Ejercicios de Potencia ComplejaDocumento3 páginasGuia de Ejercicios de Potencia ComplejaAndrea VivasAún no hay calificaciones
- Aa2 CotizacionDocumento10 páginasAa2 CotizacionEMERSON JORKY JACO GUTIERREZAún no hay calificaciones
- Ficha Tecnica Manejadores de Aire TM&V UtaDocumento5 páginasFicha Tecnica Manejadores de Aire TM&V UtaDilia Ines Castillo LaraAún no hay calificaciones
- Levantamiento Catastral 3.1Documento5 páginasLevantamiento Catastral 3.1Fidencio Gomez GarciaAún no hay calificaciones
- Análisis Complementario EIA Red Básica Del Metro de Lima y Callao PDFDocumento603 páginasAnálisis Complementario EIA Red Básica Del Metro de Lima y Callao PDFChamu SuaresAún no hay calificaciones
- Mecanismo de CohesiónDocumento38 páginasMecanismo de CohesiónEkya AlmanzaAún no hay calificaciones
- Matrices RappiDocumento5 páginasMatrices RappiDavidEstebanAún no hay calificaciones
- Libro de RDLS - 2013Documento103 páginasLibro de RDLS - 2013andreaAún no hay calificaciones
- Aprenda Gimp A Los TropezonesDocumento33 páginasAprenda Gimp A Los TropezonesskilltikAún no hay calificaciones
- Habilidades y Conocimiento de Los Ingenieros Mec Nicos 1594465842Documento4 páginasHabilidades y Conocimiento de Los Ingenieros Mec Nicos 1594465842Eliana AranaAún no hay calificaciones
- Saudi AramcoDocumento3 páginasSaudi AramcoJosé Rafael González MartínezAún no hay calificaciones