Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Dialnet TransicionesDeFaseUnaPropuestaDidactica 3700360 PDF
Dialnet TransicionesDeFaseUnaPropuestaDidactica 3700360 PDF
Cargado por
Daniel Sanchez LopezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Dialnet TransicionesDeFaseUnaPropuestaDidactica 3700360 PDF
Dialnet TransicionesDeFaseUnaPropuestaDidactica 3700360 PDF
Cargado por
Daniel Sanchez LopezCopyright:
Formatos disponibles
Transiciones de fase, una propuesta didáctica
Eric Benjamín Téllez Ugalde
Facultad de Ciencias, UNAM, Circuito Exterior s/n, Ciudad Universitaria,
C. P. 01000, México D.F.
E-mail: erictellez@gmail.com
(Recibido el 5 de Marzo de 2010; aceptado el 17 de Octubre de 2010)
Resumen
El agua es una de las sustancias más abundantes en la Tierra y definitivamente la más influyente. El estado sólido del
agua tiene varias características que no son comunes en el resto de las sustancias. De hecho el mismo estado sólido se
puede encontrar en un total de 16 fases diferentes. El hielo se acomoda de distintas formas dependiendo de la presión y
la temperatura formando cristales con diversas propiedades y diversas direcciones cristalinas. En gran medida, debido
a estas propiedades del sólido del agua, la vida en el planeta fue posible. Las transiciones de fase es un tema muy
común y fácil de entender; aquí se aborda con ejemplos poco conocidos y explicando las implicaciones planetarias,
climáticas e incluso biológicas, específicamente del agua.
Palabras clave: Transiciones de fase, enseñanza de la física con aplicaciones a otras ciencias, enseñanza con ejemplos
no cotidianos.
Abstract
The water is one of the most plentiful substances on Earth and definitely the most influential. The solid phase of water
has many characteristics that are not common in other substances. Indeed, the solid phase has 16 different structural
arrangements. Depend on pressure and temperature; the ice can arrange its molecules with different properties and
several crystalline directions. Due to some of these properties, life in Earth was possible. Phase transitions is a very
simple topic and very easy to understand; here it is explained with not so common examples and introducing the
weather, planetary and biological implications, specifically from water.
Keywords: Phase transitions, teaching physics with applications in other sciences, teaching with uncommon
examples.
PACS: 01.30.Ee, 01.40.eg, 01.40.ek, 01.40.gb. ISSN 1870-9095
I. INTRODUCCIÓN hielo no se encuentran en la naturaleza o muy rara vez lo
hacen y ni si quiera en nuestro planeta. Se piensa que
El hielo es agua sólida cristalizada, congelada. Es uno de los algunos de estos hielos pueden ser encontrados en las lunas
tres estados naturales del agua. El agua pura se congela a la de Júpiter.
altitud del nivel del mar a 0°C. El agua, junto con el galio,
bismuto, ácido acético, antimonio y el silicio, es una de las
pocas sustancias que al congelarse aumentan de volumen (es II. DESARROLLO
decir, que disminuye su densidad); la mayoría de las otras
sustancias se contraen al congelarse. Esta propiedad evita A. Estructura del agua líquida
que los océanos de las regiones polares de la Tierra se
congelen en todo su volumen, puesto que el hielo flota en el A presión atmosférica, las moléculas de agua se estructuran
agua y es lo que queda expuesto a los cambios de de manera tetraédrica, en virtud del enlace de hidrógeno.
temperatura de la atmósfera. Por esto, las moléculas de agua se amontonan de manera
El hielo es un mineral, y así como el agua, por ser el más compacta; por lo tanto, la densidad del hielo es menor que la
ligero de todos, ocupa la mayor parte de la litosfera y del agua (917kg/m3). El cristal de hielo tiene una estructura
precisamente esto es lo que ha hecho que la vida, como la hexagonal espaciada; dependiendo de la presión atmosférica
conocemos en la Tierra tenga sus fundamentos en el agua. el hielo se compacta de diferentes formas, dando lugar a los
El hielo se puede empaquetar en 16 formas diferentes diferentes tipos de hielo que hoy conocemos [1].
dependiendo de la presión y la temperatura. El agua tiene una celda de forma tetraédrica, debido
Generalmente nosotros sólo conocemos dos tipos de principalmente al dipolo magnético que hace que los
hielo, ya que para crear los otros tipos de hielo, es necesario ángulos entre el oxígeno e hidrógeno sean de
utilizar técnicas experimentales avanzadas y estos tipos de aproximadamente 109º.
Lat. Am. J. Phys. Educ. Vol. 4, Suppl. 1, Nov. 2010 948 http://www.lajpe.org
Eric Benjamín Téllez Ugalde
B. Tipos de hielo
En el hielo, como en la mayoría de los sólidos, las
moléculas se acomodan en una formación ordenada. Sin
embargo, dependiendo de las condiciones de presión y
temperatura, es posible que adopten diferentes formas. A
partir de 1900, Gustavo Tamman y posteriormente en 1912
Percy Bridgman hicieron experimentos sobre el hielo
aplicándole diferentes presiones y temperaturas, y
obtuvieron hielos diferentes con mayores densidades a la
normal (posteriormente se encontraron muchos más tipos de
hielo) [2]. Todas estas formas de hielo tienen estructuras
más compactas o sea que se forman varias modificaciones
alotrópicas o alótropos (diferentes formas de un elemento
existentes en el mismo estado físico). Hasta el momento se
conocen 16 tipos diferentes de hielos, aunque
estructuralmente solo son 11, ya que hay estructuras
repetidas, pero estas se juntan por enlaces de hidrógeno.
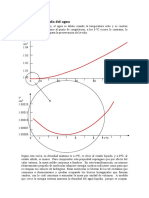
En forma natural, en la Tierra (dadas sus condiciones de FIGURA 2. Diagrama de presión contra temperatura del agua. La
T representa las condiciones normales de temperatura y presión en
presión y temperatura), solamente pueden existir dos tipos
la superficie de la Tierra. Mientras que la M y la V representan así
de hielo (hielo I y XI). Sin embargo, en otros planetas o en mismo, las de Marte y Venus respectivamente.
satélites, como el caso de Ganímedes (la luna más grande de
Júpiter), en los que las condiciones de presión y de
temperatura son diferentes, el hielo puede presentarse en
otras formas, como es el caso del hielo II. En otros casos, la
obtención de alguna forma es realmente difícil. En el 2009
se descubrió apenas una nueva forma de cristal de hielo,
llamado hielo XV, el cual es antiferroeléctrico [2]. Al
contrario, el hielo XI es ferroeléctrico.
FIGURA 3. Aumento de la escala en el diagrama de presión
contra temperatura. Bajando un poco la temperatura y aumentando
un poco la presión podemos ver que hay varios tipos de hielo. De
aquí que los glaciares tienen diversos tipos de movimientos,
colores y composiciones dependiendo de la profundidad.
D. Descenso crioscópico
El descenso crioscópico es la reducción del punto de fusión
FIGURA 1. Estructura cristalina del hielo Ih. de un disolvente puro por la presencia de solutos. Es
directamente proporcional a la molalidad, lo que hace que
C. Diagramas de fase sea más importante para solutos iónicos, como los que
predominan en el agua de mar, que para los no iónicos. El
A continuación en las figuras 1-4, se muestran unos fenómeno tiene importantes consecuencias en el caso del
diagramas de fase que ilustran los diferentes tipos de hielos agua de mar, porque la respuesta al enfriamiento intenso del
[3]. agua del océano, como ocurre en el invierno de las regiones
polares, es la separación de una fase sólida flotante de agua
pura en forma de hielo. Es así como se forma la banquisa en
Lat. Am. J. Phys. Educ. Vol. 4, Suppl. 1, Nov. 2010 949 http://www.lajpe.org
Transiciones de fase, una propuesta didáctica
torno a la Antártida o al océano Ártico, como un agregado 3. El agua tiene un punto crítico inusualmente alto.
compacto de hielo puro de agua, con salmuera llenando los 4. El agua sólida existe en una amplia variedad de
intersticios, y flotando sobre una masa de agua líquida a estructuras amorfas y cristalinas estables (y
menos de 0°C (hasta un límite de –1,9°C para una salinidad metaestables).
del 3,5%). 5. La estructura del agua líquida cambia a altas
presiones.
6. El agua superenfriada tiene dos fases y un segundo
punto crítico cerca de -91ºC.
7. El agua líquida se superenfría fácilmente pero se
cristaliza con dificultad.
8. El agua líquida existe a muy bajas temperaturas y
se congela calentándola.
9. El efecto Mpemba: el agua caliente se puede
congelar más rápido que el agua fría.
10. La densidad del hielo se incrementa con la
temperatura (hasta 70K).
11. Agua líquida tiene una alta densidad que se
incrementa al calentarla.
12. La superficie del agua es más densa que el agua
debajo.
13. La presión reduce la temperatura de máxima
densidad.
14. El agua tiene un bajo coeficiente de expansión.
15. La expansión térmica del agua se reduce cada vez
más a bajas temperaturas (se vuelve negativa).
16. La expansión térmica del agua se incrementa con el
FIGURA 4. Diagrama presión contra temperatura, si el agua se incremento de la presión.
comportara de acuerdo a su baja masa atómica. Si esto ocurriera, 17. El agua tiene una inusual baja compresibilidad.
no sería posible la tecnología debida a la incompresibilidad del 18. La compresibilidad cae así como la temperatura
agua, por ejemplo. aumenta hasta 46.5ºC.
19. Hay un máximo en la relación entre
compresibilidad y temperatura.
E. Fusión eutéctica 20. La velocidad del sonido se incrementa con la
temperatura hasta 74ºC.
En las condiciones terrestres y durante el invierno es 21. La velocidad del sonido debería mostrar un
frecuente agregar sal al hielo para que se funda. De hecho, mínimo.
lo que se funde no es el hielo, sino un compuesto de hielo y 22. El índice de refracción del agua tiene un valor
sal llamado "eutéctico". Cuando la sal NaCl (Na+, Cl–) máximo justo debajo de 0ºC.
entra en contacto con el hielo, los iones se arreglan 23. El cambio en el volumen de líquido a gas es muy
alrededor de las moléculas de agua, que son polares (H2δ+, grande.
Oδ–) y viene a formar un compuesto (H2O).(NaCl). Cuando 24. El calor de fusión del agua tiene un máximo a -
se respetan las proporciones exactas (alrededor del 23% de 17ºC.
sal en masa), se tiene un producto que se comporta como 25. El agua tiene más del doble de capacidad calórica
producto puro (particularmente, hay una temperatura de que el hielo o el vapor.
fusión constante) y que se califica de "eutéctica". La 26. La capacidad calórica específica (PC y VC) es
temperatura de fusión de esta eutéctica es de alrededor de – inusualmente alta.
21°C. Si la proporción de sal es inferior a esta relación, se 27. La capacidad calórica específica PC tiene un
da una mezcla agua-eutéctica, que se funde a una mínimo a 36ºC.
temperatura superior (entre –21°C y 0°C). Si la proporción 28. La capacidad calórica específica PC tiene un
de sal es superior, se tiene una mezcla sal-eutéctica que máximo a -45ºC.
también se funde a una temperatura superior. 29. La capacidad calórica específica VC tiene un
Así, en teoría, sería posible impedir la formación de hielo máximo.
hasta los –21°C. En la práctica, es imposible dosificar la 30. La conductividad térmica del agua es alta y se
cantidad de sal que debe usarse. incrementa hasta un máximo cerca de 130ºC.
F. Anomalías importantes del agua
1. El agua tiene un punto de fusión inusualmente alto.
2. El agua tiene un punto de ebullición inusualmente
alto.
Lat. Am. J. Phys. Educ. Vol. 4, Suppl. 1, Nov. 2010 950 http://www.lajpe.org
Eric Benjamín Téllez Ugalde
2. Cristalización fraccionaria de los magmas de
silicio.
3. Cristalización de soluciones acuosas.
4. Procesos en los cuales se incluye la participación
de organismos.
5. Formación del hielo.
Así que, el hielo es un miembro extremo de una serie
específica de minerales y obedece las leyes generales de la
gravitación, térmicas y químicas para la diferenciación de la
materia terrestre. Difiere en que es el más ligero y el que
tiene la más baja temperatura y por esta razón es el más
superficial y es uno de los minerales con más simples en su
composición química capaz de formar grandes masas de
roca monominerálica.
Subjetivamente, desde el punto de vista del hombre, la
principal cualidad del hielo, es que está en la última etapa de
formación de minerales en la secuencia térmica, situada más
allá de la etapa de formación de minerales organógenos. El
proceso de la vida orgánica, el cual requiere la presencia de
agua líquida, está situado entre las etapas de formación de
hielo y la formación de todos los otros minerales de altas
temperaturas. El hielo es el medio más extraño para la vida
orgánica, y una considerable acumulación de éste, rompe
FIGURA 5. Algunas de las propiedades anómalas del agua líquida completamente el curso normal de todos los procesos en la
relacionadas con la temperatura. Se ha escalado entre el valor biosfera.
máximo y el mínimo. Como la última etapa de la división geoquímica de la
secuencia térmica, la etapa de formación de hielo difiere de
G. El papel del hielo en la estructura de la Tierra las anteriores etapas de cristalización en que los magmas y
las soluciones acuosas se comprimen a una
De acuerdo con Shumskii [4], las propiedades específicas comparativamente pequeña parte de la materia terrestre. El
del hielo ordinario le dan un lugar especial dentro de los volumen del hielo sobre la Tierra, más de 20 millones de
minerales. El hielo es el más ligero y también el más frío de km3, se comprime solamente cerca del 1.7% del total del
todos los minerales; Su gravedad específica y su calor de volumen de agua en la superficie terrestre, sin contar el agua
fusión difieren de los otros minerales. Las leyes de en la litosfera. Sin embargo, el hielo es el componente
distribución del hielo en la tierra se derivan de estas sólido más ampliamente distribuido en la superficie de la
diferencias básicas. Tierra y en la atmósfera. Solamente los glaciares cubren una
Los principales elementos químicos y sus componentes área de 16 millones de km2 de la superficie terrestre,
son distribuidos zonalmente sobre nuestro planeta: los más incluyendo el continente antártico, con un área más grande
pesados se encuentran en las profundidades y los más que la de Europa; el hielo cubre un área de 3.1% de la
ligeros en la superficie, simplemente por gravedad; no superficie terrestre y un 10.8% de la superficie continental.
importa cuál sea el origen de los planetas, a través del Más o menos la misma área está ocupada por permafrost, el
tiempo se acomodaron según su peso específico. De acuerdo cual contiene hielo en forma de hielo cimentado y varios
con esta ley, el agua en todos sus estados de agregación se cuerpos con cristales de hielo. Si consideramos la nieve
comprime no más que el 8% del peso de las capas estacional y las capas de hielo, podríamos decir que entre
superiores de la costra Terrestre y 75% del peso de la 30% y 50% de la superficie de la Tierra esta cubierta por el
biosfera. El H2O congelada se expande siendo más ligera hielo; además de que parte del año más del 50% de la
que el agua líquida, flotando en ella, lo cual es de un superficie continental está cubierta por hielo.
significado especial, ya que el agua líquida y la vida De esta forma podemos darnos cuenta de que el hielo
orgánica puede existir bajo la capa aislante de hielo en clima puede estar presente en cualquier parte de la Tierra, si no en
frío. Sólo hay algunas otras sustancias que tiene el mismo la superficie entonces en la atmósfera. El hielo forma la
comportamiento como: el galio, bismuto, ácido acético, verdadera envoltura de la Tierra llamada criosfera. Está
antimonio y el silicio. De esta forma, de todos los minerales, situada entre la zona de alta temperatura de la alta
no solamente sólidos sino también líquidos, el hielo, por su estratosfera y la ionosfera en la zona de alta temperatura de
peso, es el más concentrado en la superficie. la costra terrestre con un total de 10km de ancho.
Si examinamos la Tierra como un simple, inicialmente
gaseoso, cuerpo fisicoquímico, podemos distinguir cinco H. El papel del agua y el hielo en la evolución de la vida.
etapas de temperatura de diferenciación geoquímica:
1. La división en una fase gaseosa y tres fases Es evidente que debido a las propiedades del agua, la vida
líquidas (aleaciones ferrosas, sulfurosas, y se desarrolló en torno a ella. No podemos afirmar que si
silicosas) fuera otra la sustancia con propiedades aún más benévolas
Lat. Am. J. Phys. Educ. Vol. 4, Suppl. 1, Nov. 2010 951 http://www.lajpe.org
Transiciones de fase, una propuesta didáctica
para el surgimiento de la vida, ésta hubiera preferido esa En su mayoría, los estudiantes no tienen gusto por la
sustancia por encima del agua. Pero algo si es claro, de este ciencia, principalmente debido a falta de motivación. La
sistema solar, el único planeta con vida conocida es éste, motivación no es sólo una condición indispensable para que
aquel en el que el agua predomina por encima de cualquier se dé un aprendizaje exitoso, además se tiene la tarea de
otra sustancia mineral, en cualquiera de sus estados de despertar y afianzar motivos duraderos, y esto concierne
agregación y con cualquier composición o mezcla. también al maestro [5]. Por ello se proponen ejemplos, unos
El hielo por su parte, debido a algunas de sus cotidianos y otros de investigación de frontera, explicando
propiedades, no solamente ha favorecido la proliferación de sus valiosas aportaciones a otros campos de la ciencia como
organismos, sino que, llegado el momento debido a causas la biología, la geología, la química, la astronomía, e
naturales climáticas, ha protegido a estos de su desaparición. inclusive, aunque no abordado en este trabajo, su presencia
Ofreciendo resguardo dentro de los mares, que de otra en el arte y en los deportes.
forma se congelarían irremediablemente y junto con ellos Finalmente hay que resaltar que toda motivación
todo el planeta, dejando con pocas posibilidades a la vida siempre debe ser dirigida hacia interpretar y entender los
como la conocemos. procesos naturales, ya que de otra forma se pone de
Es un hecho de entre tantos los que se necesitaron y se manifiesto una imagen de la física o química en el aula
necesitan para que surjan organismo por la recombinación propia de épocas pasadas (como el activismo científico) [6]
de los diferentes elementos, pero en definitiva el agua junto y esto podría resultar en una concepción engañosa de la
con sus propiedades únicas, además de su vasta ciencia actual.
acumulación en la superficie terrestre le dieron un impulso
sin comparación.
AGRADECIMIENTOS
III. CONCLUSIONES Se agradece al M. en C. Sergio Hernández Zapata, del
Taller de fluidos de la Facultad de Ciencias de la UNAM la
Es increíble que, el agua, siendo el material más extenso del asistencia técnica y el apoyo prestado durante la realización
planeta y que, teniendo la importancia para la vida y para el de este trabajo.
ser humano que se le conoce; y además por estas razones
sea también el más estudiado, aún hoy se pueda obtener
información nueva y se pueda hacer investigación de REFERENCIAS
frontera sobre este material.
Las propiedades del agua son realmente sorprendentes y [1]http://www.its.caltech.edu/~atomic/snowcrystals/ice/ice.
pueden ser explotadas desde muchos puntos de vista para la htm, consultado el 15-Nov-09
enseñanza de bachillerato o secundaria, ya sea en el [2] Hobbs, P. V., Ice Physics, (Clarendon Press., Oxford,
laboratorio o en el aula. 1974).
Hervir agua, hacer hielo e inclusive ponerle sal al hielo [3] http://www1.lsbu.ac.uk/water/index.html, consultado el
para mantener fríos los botes del helado de sabores, son 15-Nov-09.
procesos cotidianos conocidos y a veces imperceptibles. [4] Shumskii, P. A., Principles of structural glaciology,
Recurriendo a todos estos elementos (y muchos otros), (Dover, New York, 1964).
podemos ejemplificar al alumno sin recurrir siquiera al [5] Aebli, H., Factores de la enseñanza que favorecen el
laboratorio cuando no nos sea posible. También de esta aprendizaje autónomo, (Narcea Ediciones, Madrid, 2001).
forma se introduce al estudiante a los descubrimientos más [6] Jiménez-Liso, M. R. y De Manuel Torres, E., El regreso
recientes, que de hecho ocurren día a día en la ciencia, de la química cotidiana: ¿Regresión o innovación?,
siendo que algunos de ellos tienen gran importancia y valor Enseñanza de las ciencias: revista de investigación y
para el ser humano. experiencias didácticas 27, 257 (2009).
Lat. Am. J. Phys. Educ. Vol. 4, Suppl. 1, Nov. 2010 952 http://www.lajpe.org
También podría gustarte
- Genetica en OdontologiaDocumento145 páginasGenetica en OdontologiaRoger Navarrete33% (3)
- Laboratorio de ViscosidadDocumento5 páginasLaboratorio de ViscosidadMIGUEL ANGEL SUAREZ MONTOYAAún no hay calificaciones
- Lineas de Durhing para NaOH-AguaDocumento2 páginasLineas de Durhing para NaOH-AguaYulissa Ramirez100% (1)
- HieloDocumento4 páginasHieloluisaAún no hay calificaciones
- HIELODocumento6 páginasHIELOAlexander Guerrero PichardoAún no hay calificaciones
- HieloDocumento10 páginasHieloBrayan Diaz CanalesAún no hay calificaciones
- HieloDocumento9 páginasHieloJose MonartAún no hay calificaciones
- Misterios Del AguaDocumento2 páginasMisterios Del AguaDario Quimis SantanaAún no hay calificaciones
- Hielo Ardiente y DensoDocumento2 páginasHielo Ardiente y DensoRamos Juarez Jose PabloAún no hay calificaciones
- Por Que Se Derrite El HieloDocumento12 páginasPor Que Se Derrite El HieloItzel Reyes100% (1)
- Maquina Troceadora de IeloDocumento20 páginasMaquina Troceadora de IeloRobertoCamperoAún no hay calificaciones
- GlaciaresDocumento6 páginasGlaciaresMarcelo VendetoAún no hay calificaciones
- Universidad Politecnica de DurangoDocumento10 páginasUniversidad Politecnica de DurangoCiria De La CruzAún no hay calificaciones
- Trabajo CorregidoDocumento9 páginasTrabajo CorregidoYamile SosaAún no hay calificaciones
- Guía de Minerales Hielo VIIDocumento14 páginasGuía de Minerales Hielo VIIJulian Alex Ortiz MayAún no hay calificaciones
- El Agua Caracteristicas GeneralesDocumento9 páginasEl Agua Caracteristicas GeneralesGuido AutoreAún no hay calificaciones
- AGUADocumento10 páginasAGUArizaidisAún no hay calificaciones
- HieloDocumento11 páginasHieloFranklinSalayaAún no hay calificaciones
- GeohidrologíaDocumento39 páginasGeohidrologíaMarlen PereaAún no hay calificaciones
- AguaDocumento6 páginasAguaMiguel Angel Cordova BenitesAún no hay calificaciones
- Derretimiento de GlaciaresDocumento15 páginasDerretimiento de GlaciaresPia BandoniAún no hay calificaciones
- El AguaDocumento14 páginasEl AguaDayerson Sanchez MartinezAún no hay calificaciones
- Hielo VIIDocumento2 páginasHielo VIIGaby MercedesAún no hay calificaciones
- Reporte Glaciares PVA ESG CCLIMÃ - TICO-1Documento6 páginasReporte Glaciares PVA ESG CCLIMÃ - TICO-1Liz CastroAún no hay calificaciones
- Formación de Lso Glaciares GeannellaDocumento20 páginasFormación de Lso Glaciares GeannellaGeannella DiazAún no hay calificaciones
- Trabajo1 HidrogeoDocumento8 páginasTrabajo1 HidrogeoArgen HerranAún no hay calificaciones
- 01 Definicion-ClasificacionDocumento48 páginas01 Definicion-ClasificacionZevallosKimberleyAún no hay calificaciones
- GLACIACIONDocumento16 páginasGLACIACIONJhoseLuisLopezAún no hay calificaciones
- El PaisajismoDocumento3 páginasEl Paisajismomolina.marlon1995Aún no hay calificaciones
- HidrosferaDocumento2 páginasHidrosferaMario MendozaAún no hay calificaciones
- Estadistica Poblacional Sud AmericaDocumento6 páginasEstadistica Poblacional Sud AmericaRudy Loza MamaniAún no hay calificaciones
- HieloDocumento3 páginasHieloLucas Fernando RIVEROS CABALLEROAún no hay calificaciones
- El AguaDocumento6 páginasEl AguaLaura RamirezAún no hay calificaciones
- CriosferaDocumento23 páginasCriosferaAedo Francis JavierAún no hay calificaciones
- El AguaDocumento20 páginasEl AguaLUISAún no hay calificaciones
- El Agua El Líquido Más Extraño Del UniversoDocumento5 páginasEl Agua El Líquido Más Extraño Del UniversovictorserranovAún no hay calificaciones
- Geo Monografia GlaciaresDocumento37 páginasGeo Monografia GlaciaresJuliana J. Seminario100% (1)
- Formacion Hielo MarinoDocumento7 páginasFormacion Hielo MarinoAlejandro Barrientos Muñoz100% (1)
- Los Estados Del AguaDocumento4 páginasLos Estados Del AguaFERNANDA CASTRO SELAYAAún no hay calificaciones
- HieloDocumento8 páginasHieloNati P MorenoAún no hay calificaciones
- Lección 5 CriósferaDocumento16 páginasLección 5 CriósferaAndrea AlvizAún no hay calificaciones
- A-Dilatacion Anomala Del AguaDocumento4 páginasA-Dilatacion Anomala Del Agualata pal mitoAún no hay calificaciones
- Por Qué Flota El HieloDocumento3 páginasPor Qué Flota El HieloGisell GimenezAún no hay calificaciones
- Las GlaciacionesDocumento3 páginasLas GlaciacionesNiyed LópezAún no hay calificaciones
- Intemperismo y ErosionDocumento40 páginasIntemperismo y ErosionAnonymous yfae56GajvAún no hay calificaciones
- Química Recreativa L. Vlasov y D. TrifonovDocumento1 páginaQuímica Recreativa L. Vlasov y D. TrifonovSandra NvaAún no hay calificaciones
- Agua PedritoDocumento10 páginasAgua Pedritoeliparedes69Aún no hay calificaciones
- HieloDocumento3 páginasHieloNandoAún no hay calificaciones
- Cómo Influye La Temperatura en Los Cambios de Estados Del AguaDocumento40 páginasCómo Influye La Temperatura en Los Cambios de Estados Del Aguapattosolang100% (2)
- Depositos Fluvio Glaciales Freddy MontejoDocumento15 páginasDepositos Fluvio Glaciales Freddy MontejoFreddy Montejo OchoaAún no hay calificaciones
- Geografía 1. UNED. TEMA 4Documento15 páginasGeografía 1. UNED. TEMA 4Pepe MAún no hay calificaciones
- AguaDocumento13 páginasAguaJuan QuispeAún no hay calificaciones
- TP 6Documento8 páginasTP 6Yeroki MercedesAún no hay calificaciones
- Ciclo HidrologicoDocumento16 páginasCiclo HidrologicoRodrigo VegaAún no hay calificaciones
- Los Glaciares y El Ciclo de DenudaciónDocumento8 páginasLos Glaciares y El Ciclo de DenudaciónNoelia OsunaAún no hay calificaciones
- 2 - El Agua - ClaseDocumento126 páginas2 - El Agua - Clasewilson martin condori vargasAún no hay calificaciones
- Es El Hielo Una Roca?Documento4 páginasEs El Hielo Una Roca?jose2392Aún no hay calificaciones
- Deshielo polar: una aventura de Max Axiom, súpercientíficoDe EverandDeshielo polar: una aventura de Max Axiom, súpercientíficoAún no hay calificaciones
- (Re)calientes: Por qué la crisis climática es el problema más urgente de nuestro tiempoDe Everand(Re)calientes: Por qué la crisis climática es el problema más urgente de nuestro tiempoCalificación: 5 de 5 estrellas5/5 (1)
- Aplicaciones de Las Conicas - UNALDocumento112 páginasAplicaciones de Las Conicas - UNALJaimebohAún no hay calificaciones
- Hi Per TensionDocumento117 páginasHi Per TensionJaimebohAún no hay calificaciones
- Bricolaje - UtillajeDocumento22 páginasBricolaje - UtillajeJaimeboh100% (1)
- Error Al Intentar Iniciar Outlook 2003 - El Archivo MAPI32.DLL Está DañadoDocumento1 páginaError Al Intentar Iniciar Outlook 2003 - El Archivo MAPI32.DLL Está DañadoJaimebohAún no hay calificaciones
- Practica 06. Destilación Azeotropica PDFDocumento16 páginasPractica 06. Destilación Azeotropica PDFLuis Carlos Hernandez Salgado0% (1)
- Definiciones Del Postensado y PretensadoDocumento1 páginaDefiniciones Del Postensado y Pretensadorafael romanAún no hay calificaciones
- Matriz RiesgosDocumento48 páginasMatriz RiesgosErika Yasmin Gutieerez CortesAún no hay calificaciones
- Descenso Del Punto de CongelaciónDocumento11 páginasDescenso Del Punto de CongelaciónEliana camila pe�a yateAún no hay calificaciones
- Cocreto Ficha TecnicaDocumento16 páginasCocreto Ficha TecnicaFrancisco Javier Alvarez GarzaAún no hay calificaciones
- Prueba RemedialDocumento3 páginasPrueba RemedialNicole Constanza Muñoz BrionesAún no hay calificaciones
- Adrenalina y NoradrenalinaDocumento4 páginasAdrenalina y NoradrenalinaAlejandra RamirezAún no hay calificaciones
- Casos BioquimicaDocumento15 páginasCasos BioquimicaFrancesco Andrés Placencia SquadritoAún no hay calificaciones
- Informe 5 Ensayos de SolubilidadDocumento11 páginasInforme 5 Ensayos de SolubilidadJair BarruetaAún no hay calificaciones
- Chapa Antidesgaste ABREXDocumento12 páginasChapa Antidesgaste ABREXMiguel SenaAún no hay calificaciones
- EXAMEN MÁQUINAS TÉRMICAS Junio 06Documento4 páginasEXAMEN MÁQUINAS TÉRMICAS Junio 06Eduardo RivasAún no hay calificaciones
- CatalogoEIC DX 2009Documento21 páginasCatalogoEIC DX 2009EduAún no hay calificaciones
- Actividad10 EquipoOTM1 Matutino1 29042019Documento16 páginasActividad10 EquipoOTM1 Matutino1 29042019Jorge Luna100% (1)
- Guia 10 Ensayo de TracciónDocumento6 páginasGuia 10 Ensayo de TracciónMauricio SalasAún no hay calificaciones
- Resolución Ejercicios 1-15 Unidad VDocumento8 páginasResolución Ejercicios 1-15 Unidad VElvis Leonel Temoche SandovalAún no hay calificaciones
- CV Miguel CisnerosDocumento8 páginasCV Miguel CisnerosMiguel Angel Cisneros0% (1)
- Volcanes ExposicionDocumento17 páginasVolcanes ExposicionManuel Murillo0% (1)
- Ac. Carboxilcos, AmidasDocumento18 páginasAc. Carboxilcos, AmidasJUDITH INGAAún no hay calificaciones
- Especificaciones Obra Civil San FranciscoDocumento197 páginasEspecificaciones Obra Civil San FranciscoFrancisco J Rodríguez MartínAún no hay calificaciones
- Tipos de Registros ElectricosDocumento27 páginasTipos de Registros ElectricosJealitzaAún no hay calificaciones
- Monografia Del Ojo HumanoDocumento20 páginasMonografia Del Ojo HumanoDiana Carolina Monzon CardenasAún no hay calificaciones
- IntroducciónDocumento9 páginasIntroducciónPablo Cordero TapiaAún no hay calificaciones
- Tratamiento Termico en Soldadura Material TitanioDocumento108 páginasTratamiento Termico en Soldadura Material TitanioFreddy Mamani AtayupanquiAún no hay calificaciones
- Biodeterioro de Monumentos de Iberoamérica PDFDocumento197 páginasBiodeterioro de Monumentos de Iberoamérica PDFAraniza ValverdeAún no hay calificaciones
- Triptico VinculacionDocumento2 páginasTriptico VinculacionCristian Uriel Apunte AricoAún no hay calificaciones
- Tintoreria Introduccion 21.10.20Documento28 páginasTintoreria Introduccion 21.10.20MIGUEL RODRIGO CAIRO PAJUELOAún no hay calificaciones
- Trabajo AlohaDocumento31 páginasTrabajo AlohaPabloAún no hay calificaciones
- Construcción Híbrida Con Acero Ligero y Acero Laminado en Caliente en Estructuras ResidencialesDocumento8 páginasConstrucción Híbrida Con Acero Ligero y Acero Laminado en Caliente en Estructuras ResidencialesAnonymous RrPSDPatROAún no hay calificaciones