Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Combustion Camilo
Combustion Camilo
Cargado por
Manuel Gallegos CalderónDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Combustion Camilo
Combustion Camilo
Cargado por
Manuel Gallegos CalderónCopyright:
Formatos disponibles
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 1
TERMODINAMICA APLICADA
TEMAS:
COMBUSTION
COMPRESIN EXPANSIN DE GASES
APUNTES DE CLASE (En edicin)
Por: MSc. Camilo Fernndez Barriga
Arequipa, Mayo 2010
CAPITULO 1
COMBUSTION
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 2
INDICE (Combustin )
1. Introduccin 4
2. Objetivos 6
3. Combustibles y Combustin 7
3.1. Anlisis de los Combustibles 7
3.2. Composicin del Aire 8
3.3. Relaciones de Aire y Combustible 8
3.4. Combustin con Exceso o Deficiencia de Aire 10
4. Anlisis de los Procesos de Combustin Terica y Real 13
5. Entalpia de Formacin y Entalpia de Combustin 17
5.1. Calores de Reaccin 17
5.2. Base de Entalpia Igual a Cero 17
5.3. Entalpa de Formacin 18
5.4. Entalpa de Combustin 18
6. Anlisis de la Primera Ley de Sistemas Reactivos 22
6.1. Sistemas de Flujo Estable 22
6.2. Sistemas Cerrados 23
7. Temperatura de la Flama Adiabtica 26
8. Cambio de Entropa de Sistemas Reactivos 30
9. Anlisis de la Segunda Ley a los Procesos de Combustin 32
9.1. Determinacin de la posibilidad de reaccin: combustin adiabtica 32
9.2. Funcin de Gibbs estndar de reaccin 34
9.3. Anlisis de Sistemas Reactivos 34
10. Tema de Inters: Celdas de Combustible 37
10.1. Funcionamiento 37
10.2. Tipos de Celdas de Combustible 39
10.3. Conclusiones 40
11. Resumen 45
12. Bibliografa y Referencias 48
13. Practica Dirigida 49
14. Problemas Domiciliarios 58
15. Anexos 61
16. ndice Alfabtico 80
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 3
1. INTRODUCCION
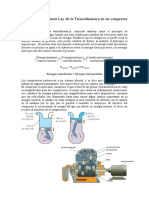
La combustin tal vez es el proceso trmico de mayor inters prctico por su escala de
utilizacin mundial, siendo a la vez muy fcil de realizar y muy difcil de estudiar, sea el
proceso de reaccin qumica exotrmica auto mantenida por conduccin de calor y difusin de
especies, conocido como combustin.
Sus aplicaciones se pueden resumir en:
Calefaccin de habitculos (hogueras, estufas, calderas),
Produccin de electricidad (centrales trmicas),
Propulsin (motores alternativos, turbinas de vapor, turbinas de gas),
Proceso de materiales (reduccin de xidos, fundicin, coccin),
Eliminacin de residuos (incineracin de basura),
Produccin de frio (frigorficos de absorcin),
Control de incendios (barreras cortafuegos, materiales ignfugos),
Iluminacin (hasta finales del siglo XIX era el nico mtodo de luz artificial).
El proceso de combustin es el ms importante en ingeniera porque todava hoy,
aunque tiende a disminuir (96% en 1975, 90% en 1985 y aprox. 80 % en 1995), la mayor parte
de la produccin mundial de energa se hace por combustin de petrleo, carbn y gas natural.
Y no solo es importante el estudio de la combustin controlada de los recursos primarios usados
es en la produccin de trabajo y calor, sino que tambin es preciso estudiar los procesos de
combustin incontrolada (fuegos) para tratar de prevenirlos y luchar contra ellos. Adems, cada
vez va siendo ms importante analizar la combustin controlada de materiales de desecho
(incineracin), con el fin de minimizar la contaminacin ambiental.
La combustin (quemar algo) es un proceso tan fcil de realizar porque genera mucha
entropa y por tanto su viabilidad (tendencia a reaccionar) es muy alta; mucha energa ordenada
en los enlaces qumicos pasa bruscamente a energa trmica (desordenada) de las partculas
producidas. De hecho, el mundo que nos rodea est integrado por mezclas reactivas (p.e. el
mobiliario o la vestimenta y el oxigeno del aire ambiente) en equilibrio metastable, y a veces
basta con forzar localmente la reaccin (chispa) para que se auto propague, normalmente
formando un frente luminoso (llama). Sin embargo, el proceso de combusti6n es difcil de
analizar por los siguientes motivos:
Es un proceso multidisciplinario (termoqumico - fluido dinmico) fuertemente
acoplado,
Los procesos de transporte de especies y calor (fenmenos de no equilibrio) son
dominantes,
La fuerte exotermicidad da lugar a altas temperaturas, enormes gradientes (llama), e
importantes fuerzas de flotabilidad por dilatacin diferencial,
Los enormes gradientes espaciales y los cortos tiempos de residencia en ellos provocan
estados de no equilibrio local (quimioluminiscencia, ionizacin).
Entre los tipos ms frecuentes de combustible son los materiales orgnicos que
contienen carbono e hidrgeno. En una reaccin completa todos los elementos tiene el mayor
estado de oxidacin. Los productos que se forman son el dixido de carbono (CO
2
) y el agua, el
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 4
dixido de azufre (SO
2
) (si el combustible contiene azufre) y puede aparecer xidos de
nitrgeno (NO
2
), dependiendo de la temperatura de reaccin. En la combustin incompleta los
productos que se queman pueden no reaccionar con el mayor estado de oxidacin, debido a que
el comburente y el combustible no estn en la proporcin adecuada, dando como resultado
compuestos como el monxido de carbono (CO). Adems, pueden generarse cenizas.
No hace mucho tiempo que los procesos qumicos estaban casi totalmente a cargo del
qumico o del ingeniero qumico. Pero cuando sobrevino la crisis energtica se plante la
impresionante aseveracin de que todos los combustibles fsiles son finitos o agotables. De
pronto a todo el mundo le interes el asunto de la energa, independientemente de los aspectos
que se exponen en este captulo. Aunque el proceso de la combustin nunca ser comprendido
por la mayor parte de la gente, es de esperar que todo ingeniero tenga un buen conocimiento de
los combustibles fsiles y de su rpida oxidacin en aire.
Los tipos ms frecuentes de combustible son los materiales orgnicos que contienen
carbono e hidrgeno. En una reaccin completa todos los elementos tiene el mayor estado de
oxidacin. Los productos que se forman son el dixido de carbono (CO
2
) y el agua, el dixido
de azufre (SO
2
) (si el combustible contiene azufre) y puede aparecer xidos de nitrgeno (NO
2
),
dependiendo de la temperatura de reaccin. En la combustin incompleta los productos que se
queman pueden no reaccionar con el mayor estado de oxidacin, debido a que el comburente y
el combustible no estn en la proporcin adecuada, dando como resultado compuestos como el
monxido de carbono (CO). Adems, pueden generarse cenizas.
La quema controlada de un combustible en el aire atmosfrico es una reaccin qumica
exotrmica acompaada de un incremento sustancial en la temperatura. Como todos los
procesos termodinmicos, tiene que ser eficiente. Deben ser correctos cuatro factores (entre
otros) para que un proceso de combustin se lleve a cabo adecuadamente; tales factores se
indican por la palabra mnemnica MATT. La M seala que debe haber una mezcla eficaz de
combustible y comburente (oxidante); la A, el aire suficiente para suministrar el oxgeno
adecuado; la T, la temperatura de ignicin apropiada para iniciar y mantener el proceso de
combustin, y la segunda T, el tiempo justo que permita la quema o combustin completa.
Este captulo resultar sumamente interesante, puesto que debe tenerse conciencia del
papel que juega la combustin en los destinos de un pas que trate de mantener su imagen y
estatus entre los dems pases del mundo.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 5
2. OBJETIVOS
Tener un una visin ms amplia de los combustibles y la combustin.
Aplicar el principio de conservacin de las masas a sistemas reactivos para determinar
las ecuaciones de reaccin balanceadas.
Definir los parmetros utilizados en el anlisis de la combustin, tales como la relacin
aire-combustible, el porcentaje de aire terico y la temperatura del punto de roci.
Aplicar balances de energa a sistemas reactivos para sistemas de masa fija y sistemas
FEES.
Calcular las entalpias de reaccin, combustin y los calores de los combustibles.
Determinar la temperatura de la flama adiabtica para mezclas reactivas.
Analizar los sistemas reactivos a partir de la segunda ley en encontrar los cambios y
generaciones de entropas.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 6
3. COMBUSTIBLES Y COMBUSTION
Los combustibles fsiles se pueden clasificar convenientemente como:
Slidos
Lquidos
Gaseosos.
El carbn (mineral) en sus diferentes clases es el combustible slido ms comn. Los
combustibles lquidos utilizados ms ampliamente son los derivados de hidrocarburos, con
frmula qumica C
x
H
y
, donde los subndices y poseen diversos valores. Los alcoholes, con
frmula qumica C
x
H
y
O
z
, tienen aplicacin cuando la desventaja en el precio es compensada por
otras ventajas. Los combustibles gaseosos son por lo general los ms limpios y donde el gas
natural sea abundante, probablemente resultan tambin los ms baratos. Los gases de
fabricacin y subproductos se emplean tanto para calefaccin como para generacin de
potencia. La era del espacio ha propiciado el desarrollo de ms combustibles, en particular los
reactivos que se combinan rpidamente y con liberacin de grandes cantidades de energa, como
el necesario para la propulsin de los cohetes.
3.1. Anlisis de los Combustibles
l anlisis msico (o gravimtrico) es el que especifica los diversos porcentajes en masa
(o las fracciones de masa, f
m
) de los elementos de un combustible y es tpico para combustibles
slidos y lquidos.
Un combustible gaseoso se puede definir por un anlisis gravimtrico o uno volumtrico
(molar). Los elementos constituyentes del combustible son principalmente el carbono y el
hidrgeno.
Si el combustible reactivo es del tipo molecular nico se pueden determinar por anlisis
gravimtrico los diferentes tomos a partir de la frmula qumica. En el caso del hidrocarburo
octano C
8
H
18
, que es cercano a la forma molecular promedio de la gasolina (una mezcla de
numerosas molculas diferentes), se tiene
(8 x 12) + (18 x 1) = 114 kg/kg mol de octano
Donde, en una molcula de combustible, hay 8 tomos de carbono con masa atmica 12, y 18
tomos de hidrgeno con una masa atmica aproximada igual a 1. (En la mayor parte de los
problemas de combustin, el nmero entero ms cercano al valor real de la masa atmica o
molecular es lo suficientemente exacto). Por consiguiente, en 1 mol de octano, hay 8 x 12 = 96
kg de C y 18 kg de H
2
. Las fracciones gravimtricas son:
f
mC
= 96/114 = 0.842 C, y f
mH2
= 18/114 = 0.158 H
2
.
Inversamente, suponga que se ha hallado un hidrocarburo que contiene el 80% de C y el
20% de H
2
(en masa) (f
mC
= 0.80, f
mH2
= 0.20). El nmero correspondiente de tomos es
80/12=6.67 y 20/1=20, cifras que son proporcionales al nmero de tomos de C y H
2
,
respectivamente. Los hidrocarburos equivalentes seran
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 7
C
6.67
H
20
o bien, CH
3
o bien, C
2
H,
o uno cualquiera en que el nmero de tomos de H
2
es 20/6.67 = 3 veces la cantidad de tomos
de C, designe por (CH
3
)
V
. Observemos que la masa molecular equivalente del C
6 67
H
20
es 100.
3.2. Composicin del Aire
El aire atmosfrico tiene una composicin volumtrica de 20.99% de oxgeno, 78.03%
de nitrgeno, algo menos que 1% de argn, y pequeas cantidades de varios otros gases como
vapor de agua, dixido de carbono, helio, hidrgeno y nen. Para la mayor parte de los clculos
de ingeniera generalmente basta incluir todos los gases adems del oxgeno, como nitrgeno, y
utilizar valores de composicin de 21% de oxgeno y 79% de nitrgeno "atmosfrico", en
volumen. Por tanto, en 100 moles de aire existen ms o menos 21 moles de 0
2
y 79 moles de N
2
,
o sea,
o bien
que es un valor til para el estudio general. La composicin gravimtrica aproximada del aire es
23.1%, 0
2
, 76.9%, N
2
, o bien, de 76.9/23.1 = 3.32 kg N
2
/kg O
2
.
3.3. Relaciones de Aire y Combustible
Si en las proporciones de los componentes de los reactivos hay exactamente las
suficientes molculas de oxidante para lograr una reaccin completa hasta formar molculas
estables de los productos, se dice que dichas proporciones son estequiometricas. Para las
mencionadas proporciones hay una cantidad ideal de oxidante; en el caso de combustibles que
reaccionan con O
2
puro, se habla del "100% de aire" (o bien, el 100% de 0
2
).
En la prctica, para asegurar una reaccin total del combustible (combustin completa),
se proporciona un exceso de aire o de oxgeno. En este caso, por ejemplo, podemos hablar del
120% de aire, el 200% de aire, etc., o bien, del 20% 100% de exceso de aire, etc. Cualquier
cantidad de aire superior a la requerida prcticamente para la situacin particular, hace que una
mayor cantidad de energa salga del sistema como energa almacenada (molecular), en tanto la
temperatura a la cual los productos de la combustin son enfriados debe ser la ms baja posible
econmicamente. La experiencia indica los siguientes valores de exceso de aire en el caso de los
hogares (u hornos) de las plantas de vapor: para carbn pulverizado del 15 al 20%; para
combustleo (fuel oil) del 5 al 20% para gas natural del 5 al 12%. En la figura 1 se muestra la
relacin aire-combustible y la potencia que genera dicha relacin.
Fig. 1.1 Grafica Relacin Aire-Combustible
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 8
Hay ocasiones en que se requiere una deficiencia (o defecto) de aire (u oxidante) y, en
el caso de los combustibles, se habla de, por ejemplo, un "80% de aire" (o bien, un 80% de 0
2
).
En general, si no hubiera algn exceso de combustible, la prdida por el combustible no
quemado, o sea, la combustin incompleta, sera antieconmica.
Puesto que los diversos principios ya son conocidos, unos cuantos ejemplos servirn
para explicar su aplicacin. Como se debe recordar, la identidad de las especies atmicas se
conserva durante un proceso qumico. Por consiguiente, si se expresa metdicamente el balance
atmico, equivalente al balance de masa de ese elemento (para cada tomo considerado), es ms
probable que se obtengan las ecuaciones qumicas correctas.
Ejemplo 1.1 Combustin del Octano
Si el octano gaseoso C
8
H
18
(g) se quema en aire ideal, qu volumen de aire a 140F
(60C) y 14 psia (0.98 kgf/cm abs.) es necesario? Determinar los volmenes y las masas
relativas de los componentes de los reactivos y de los productos, cuando el H
2
O es lquido, o
sea, H
2
O (1), y calcular la relacin de aire a combustible. Halle tambin un valor aproximado de
la masa molecular equivalente de los productos cuando el H
2
O es gaseoso, es decir, se tiene
H
2
O (g).
Solucin: En el caso de combustin estequiomtrica, los productos son H
2
O, CO
2
y N
2
(el N
2
se
considera inerte y pasa por la reaccin sin ningn cambio qumico). Dependiendo de la tempe-
ratura final, el H
2
O puede ser lquido o gas (vapor). Si los productos regresan a una presin
aproximadamente igual a la atmosfrica, se supone que se ha condensado todo el H
2
0 formado
durante la combustin. En este ejemplo se tienen en consideracin ambas fases. Recordemos
que los coeficientes de los smbolos qumicos pueden representar el nmero de molculas en la
reaccin, o, de preferencia, los moles de cada sustancia. Sea 1 mol de combustible la base de la
ecuacin y se expresarn las ecuaciones qumicas con los coeficientes desconocidos
representados por letras, por ejemplo, a, b, c.
C
8
H
18 (g)
+ a(O
2
+ 3.76N
2
) bH
2
0 + cC0
2
+ 3.76aN
2
En el caso de 3.76 moles de N
2
por mol de O
2
en el aire, el coeficiente del N
2
atmosfrico es 3.76a, para a moles de O
2
atmosfrico. Los balances de tomos dan
C: 8 = c o bien c = 8
H
2
: 18 = 26 o bien b = 9
O
2
: 2a = b + 2c o bien a = 12.5 3.76a = 47
Luego entonces, si la temperatura final es lo bastante baja para haber condensado el
H
2
O, se obtiene:
Reactivos Productos
C
8
H
18
(g) + 12.5O
2
+ 47 N
2
9 H
2
O(l) + 8 CO
2
+ 47 N
2
Moles: 1 + 12.5 + 47 9 + 8 +47
Volumen relativo 1 + 12.5 + 47 0 + 8 +47
Masa relativa 114 + 400 + 1316 162 + 352 + 1316
Masa/kg (comb.): 1 + 3.51 + 11.54 1.42 + 3.09 + 11.54
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 9
La primera lnea despus de la ecuacin es simplemente el nmero de moles de cada
componente para combustin completa en aire estequiomtrico. La lnea de "volumen relativo"
muestra los volmenes relativos cuando los reactivos y los productos estn a las mismas
temperaturas y presiones (Avogadro); el H
2
O lquido se indica con volumen cero (pues es muy
pequeo comparado con los volmenes de gas). Interpretacin: 1 m
3
de combustible requiere
12.5 m
3
de O
2
y resulta en 8 m
3
de CO
2
(a las mismas p y T). El anlisis volumtrico de los
reactivos y de los productos se puede obtener dividiendo el volumen de un componente entre el
volumen total: para los reactivos, supngase que 12.5/60.5 es la fraccin volumtrica de CO
2
;
para los productos, 8/55 es la fraccin volumtrica de CO
2
.
La lnea de "masa relativa" se halla multiplicando el nmero de moles de cada
componente por su masa molecular M (kg/mol); para O
2
, esto es (12.5) x (32) = 400. La lnea de
"Masa/kg (comb.)" se obtiene dividiendo cada trmino de la lnea precedente entre la masa de
combustible (114).
La interpretacin de la ltima lnea es como sigue: se requieren 3.51 kg O
2
/kg (comb.);
de esto resultan 1.42 kg H
2
O/kg (comb.), adems del H
2
O que ya estaba en el aire atmosfrico.
Una de las respuestas requeridas es r
a/c
= 3.51 + 11.54 = 15.05 kg(aire)/kg (comb.), que
es la relacin aire combustible (r
a/c
= 15.1, cuando se utilizan las partes decimales de las masas
moleculares); la relacin de combustible a aire r
c/a
es 1/15.05 = 0.0664 kg (comb.)/kg (aire). Si
las masas relativas de los reactivos no son necesarias, una forma ms rpida para calcular el aire
es emplear la masa molecular equivalente de aire por ejemplo, 29 y el total de moles
12.5+47=59.5 moles de aire. Se tiene as que:
Son de esperar pequeas diferencias en las respuestas por mtodos distintos cuando se
utilizan masas atmicas aproximadas.
En esta etapa, el volumen de aire se puede calcular en varias formas diferentes. Para
59.5 moles de aire por mol de combustible, la siguiente ecuacin da:
O sea, 27 380/114 = 240 pie
3
/lb (comb.), empleando las unidades inglesas. En unidades
mtricas se tienen 14.8 m
3
/kg (comb.).
La masa total de productos por mol de combustible es 162 + 352 + 1 316 = 1 830 kg. El
total de moles de productos gaseosos con H
2
O (g) por mol de combustible es 9 + 8 + 47 = 64.
La masa molecular es entonces M = 1 830/64 = 28.6 kg/mol de productos.
3.4. Combustin con Exceso o Deficiencia de Aire
Se considera que el exceso de aire pasa por la reaccin qumicamente sin cambio
alguno. Suponga que se desea tener un 100% de exceso de aire (el 200% de aire). En primer
lugar se debe equilibrar la ecuacin de combustin en el caso de aire estequiomtrico, de modo
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 10
que se conozca la cantidad ideal; luego se puede determinar la cantidad de aire correspondiente
a un porcentaje dado de exceso (o deficiencia). Para el 100% de exceso de aire en la ecuacin
(b), habra 25 moles de O
2
y 94 moles de N
2
. La ecuacin balanceada queda como
C
8
H
18 (g)
+ 25O
2
+ 94N
2
9H
2
O
(l)
+ 8CO
2
+ 12.5O
2
+ 94N
2
Con deficiencia de aire se deben admitir supuestos acerca de la composicin de los
productos en esta etapa. Supondremos que todo el H
2
va al H
2
O (debido a que existe una fuerte
afinidad entre el H
2
y el O
2
), y el estado incompleto de la combustin origina la aparicin de
algo de CO, as como CO
2
. Para esta hiptesis no hay demasiadas incgnitas. Como un ejemplo,
supngase que 80% del aire estequiomtrico es suministrado por el octano entonces el O
2
en los
reactivos es (0.80)(12.5) = 10 moles, y el N
2
correspondiente es (3,76)(10) = 37.6 moles. La
ecuacin qumica ser
C
8
H
18 (g)
+ 10O
2
+ 37.6N
2
= aCO + bCO
2
+ 9H
2
O + 37.6N
2
A partir de los balances de tomos de carbono y oxgeno
C: 8 = a + b o bien a = 8 b
O
2
: 2O = a + 2b + 9
Una resolucin simultnea da b = 3 moles y a = 5 moles. Se puede escribir ahora la
ecuacin balanceada y realizar otros clculos.
Ejemplo 1.2 Punto de roco de H
2
O en los productos
Aire seco estequiomtrico. Sea la reaccin para el octano como se ve en la ecuacin. En el
caso de una presin total P
m
= 14 psia (0.98kgf/cm
2
abs.), determinar la temperatura de conden-
sacin (o de roco) del H
2
O.
Solucin: Para 9 moles de H
2
O gaseoso y 64 moles de productos, la presin parcial del H
2
O por
la ley de Dalton es:
O sea, 0.1387 kgf/cm
3
abs.
La temperatura de saturacin correspondiente es 125.5F (51.9C), (de tablas) es casi
igual al punto de roco.
Aire hmedo, exceso del 20%. Consideremos que hay el 20% de exceso de aire en la
combustin de C
8
H
lg
. La relacin de humedad del aire proporcionado es = 0.0151b vap./lb a.s.
= 0.015 kg vap/kg a.s.; la presin total es de 14 psia (0.98 kgf/cm
2
abs.). Determine la
temperatura de roco del H
2
O.
Solucin: Las cantidades de O
2
y de N
2
se obtienen multiplicando sus coeficientes por 1.20
(para el 20% de exceso); los moles de N
2
son (1.2)x(47) = 56.4. Los moles de H
2
O = 9 y de CO
2
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 11
= 8 no cambian. Pero puesto que ahora hay (1.20) x (12.5) = 15 moles de O
2
, y slo 12.5 son
necesarios para la reaccin, los productos contendrn 15 - 12.5 = 2.5 moles de O
2
. Esto
proporciona el nmero total de moles de productos como:
La cantidad de aire seco considerada en la ecuacin de la reaccin es 15 + 56.4 = 71.4
moles, o sea, (71.4)(29) kg a.s./kg mol (comb.), donde M
as
= 29. Para co = 0.015 kg vap./kg a.s.,
el vapor que entra a la reaccin por mol de combustible es m
v
= (0.015)(71.4)(29) kg, y los
moles de vapor que entran son
Vapor total en los productos n
t
, = 9 + 1.725 = 10.725 kg mol y
O sea, 0.1362 kgf/cm
2
abs., de lo cual la temperatura de saturacin (punto de roco) es de
124.8F (51.6C). Es coincidencia que las respuestas a las partes (a) y (b) de este ejemplo sean
virtualmente las mismas. En ambos casos hay un pequeo error debido a que el H
2
O no est
actuando en forma ideal a su presin parcial.
Ejemplo 1.3 combustin terica real
En una instalacin trmica se han de quemar 1,8 Tm/hora de un combustible lquido, de
composicin qumica, C
12
H
23
, en exceso de aire, = 1,5.
Determinar:
La potencia calorfica superior e inferior de este combustible
El aire necesario para la combustin, teniendo en cuenta el exceso de aire.
La seccin transversal y la altura de la chimenea que ha de evacuar los gases de la
combustin, siendo la relacin, dimetro/altura = 1/20, en condiciones de tiro mximo,
sabiendo que la temperatura y presin de la atmsfera son 15C, y 760 mm de Hg
respectivamente. El coeficiente de velocidad es = 0,25.
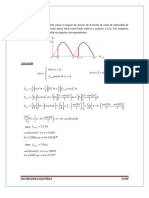
Solucin: Potencia calorfica superior e inferior de este combustible
Potencia calorfica superior del combustible:
Potencia calorfica superior del combustible:
Aire necesario para la combustin, teniendo en cuenta el exceso de aire
C
12
H
23
+ 17.75 O
2
12 CO
2
+ 11.5 H
2
O
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 12
{(12x12) + 23} C
12
H
23
+ 17.75 (16x2) O
2
12 (12+32) CO
2
+ 11.5 (2+16) H
2
O
{167} C
12
H
23
+ {568} O
2
{528} CO
2
+ {207} H
2
O
Aire: 21% O
2
; 79% N
2
; Nitrgeno = (79x568)/21 =2136.7 (unidades de peso de N
2
N de kg de O
2
por 1 kg de combustible:
Por lo que
Como hay un exceso de aire (1.5) sern necesarios 16.196x1.5 =24.3 kg
aire
por 1 kg
combustible
La seccin transversal y la altura de la chimenea que ha de evacuar los gases de la
combustin, siendo la relacin, dimetro/altura = 1/20, en condiciones de tiro mximo, sabiendo
que la temperatura y presin de la atmosfera son 15 C, y 760 mm de Hg respectivamente. El
coeficiente de velocidad es =0.25.
4. ANALISIS DE LOS PROCESOS DE COMBUSTION TEORICA Y REAL
Estos productos se analizan con el fin de saber cmo se realiza el proceso de
combustin, por ejemplo, la cantidad de aire suministrada. El aparato de Orsat, figura 1.2,
determina los porcentajes de CO
2
, CO y O
2
en los productos secos (aunque la muestra de prueba
est saturada con H
2
O). Puesto que los desechos de un motor de combustin interna contienen
hidrgeno H
2
e hidrocarburos (principalmente metano, CH
4
) estos componentes pueden ser: (1)
omitidos, (2) determinados por una prueba ms completa, o bien, (3) estimados. La experiencia
indica que la cantidad de CH
4
es de aproximadamente el 0.22% del volumen del gas seco de
salida, y que la cantidad de H
2
libre en volumen es de cerca de la mitad del porcentaje
volumtrico de CO
2
.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 13
Fig. 1.2
A partir de los anlisis de productos podemos formular la ecuacin qumica terica
correspondiente, o bien, obtener parte de ella, dependiendo de lo que se conoce al respecto del
combustible. Existen fuentes de error inevitables, tales como combustible no quemado en la
ceniza y el humo (holln). El anlisis del combustible y de los productos puede ser completo, en
cuyo caso es posible realizar balances de material. Sin embargo, podemos obtener una
conveniente aproximacin del aire proporcionado (si el contenido de O
2
, H
2
y N
2
libres es
pequeo), de un balance del carbn conociendo slo la cantidad de carbn quemado por unidad
de masa de combustible. Los detalles se entienden mejor exponindolos por medio de ejemplos.
Ejemplo 1.4 Relacin real entre aire y combustible
Se realiz un anlisis de gases de escape para los productos secos del carbn en el
ejemplo anteriores, y se hall que es el 15% C0
2
, el 3.5% 0
2
y el 0.2% CO, suponiendo que el
resto es nitrgeno, un 81.3% N
2
, todo considerando volumen de gas seco. Qu cantidad de
exceso o deficiencia de aire se suministra?
Solucin: Aproximada, suponiendo que slo se conoce la cantidad de carbono. En el caso del
carbn, sabemos que el carbono est como 0.6734 kg
C
/kg
(comb. seco)
, o sea, 5.61 moles por 100 kg
de combustible seco. Una ecuacin qumica parcial es
a[5.61C + ] + 15CO
2
+ 0.2CO + 3.5O
2
+ 81.3N
2
+
El anlisis de productos secos se escribe como se expres antes, siendo la base de la
ecuacin 100 moles de productos. El coeficiente a se obtiene de un balance de carbono
C: 5.61a = 15 + 0.2 o bien a = 2.71 5.61a = 15.2
15.2C + 15C0
2
+ 0.2CO + 3.50
2
+ 81.3N
2
+
Segn este enfoque suponemos que el nitrgeno mide la cantidad de aire, lo que es una
buena hiptesis si no hay N, en el combustible, puesto que pasa por la reaccin ideal sin ser
afectado. Los moles de 0
2
que acompaaron a los 81.3 moles de N
2
del aire son: 81.3/3.76 =
21.6 moles de O
2
; de lo cual, los moles de aire son: 81.3 + 21.6 = 102.9. La masa de aire por
unidad de masa de carbono, que se basa en todo el carbono que se quema es
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 14
Utilizando el contenido conocido de carbono (0.6734) y el de humedad [0.12, o bien,
0.88 kg (comb. seco)/kg (comb. en br.)], se obtiene
En comparacin con 8.1 kg de aire para combustin estequiomtrica. El exceso es (9.7 - 8. l)/8.1
= 19.8%.
Solucin: Por el anlisis qumico. Cuando se conoce ms del anlisis de combustible, se puede
realizar un clculo algo ms exacto del aire. Excepto en casos extremos, el azufre no se
considera (el S0
2
est en el porcentaje de CO
:
segn el anlisis Orsat debido a que el hidrxido
de potasio lo absorbe tambin). Empleando valores molares, tenemos
a[5.61C + 2.33H, + 0.265O
2
+ 0.045N
2
] + b(O
2
+ 3.76N
2
) 15CO
2
+ 0.2CO + 3.5O
2
+(0.045a
+ 3.76b)N
2
+ dH
2
O
Si hay hidrgeno en el combustible, tiene que haber alguna cantidad de H
2
O en los
productos. El coeficiente a se determina a partir del balance del carbono, y se hall
anteriormente; por lo tanto, a = 2.71. De otros balances de materiales se obtiene
H
2
: (2.71)(2.33)(2) = 2 d d = 6.31
0
2
: (2.71)(0.265)(2) + 2b = 30 + 0.2 + 7 + 6.31 b = 21.03
N
2
: (0.045a + 3.766) = 79.19
La ecuacin balanceada es (3.76b = 79.07)
[15.2C + 6.31H
2
+ 0.720
2
+ 0.122N
2
] + 21.03O
2
+ 79.07N
2
15CO
2
+ 0.2CO + 3.5O
2
+ 79.19N
2
+ 6.31H
2
O
El aire suministrado es el 0
2
y N
2
en el primer miembro de la ecuacin, fuera de los
corchetes que delimitan al combustible; se tiene as que 21.03 + 79.07 = 100.1 moles de aire.
Como antes,
Compare esto con la respuesta anterior. Adems de los procedimientos diferentes, es de
esperar un error experimental al tomar lecturas. La ventaja del segundo mtodo es que cualquier
razn deseada se obtiene rpidamente con la ecuacin balanceada. Quiz se haya observado,
aunque no resulta esencial en este ejemplo hacerlo as, que la cantidad de combustible encerrada
por los corchetes es de 100a = 271 kg/100 moles de productos secos.
Ejemplo 1.5 Proceso Real de Combustin
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 15
Se tiene propano que reacciona con aire seco en una proporcin tal que el anlisis de los
productos secos de la combustin da 11.5 % de CO
2
, 2.7 % de O
2
y un 0.7 % de CO. Obtngase
el porcentaje de aire terico utilizado durante el proceso.
Solucin:
Datos Propano que reacciona con aire seco, como se muestra en la figura
Anlisis El estudio se refiere a 100 moles de gases productos secos. El anlisis de los productos,
11.5 % de CO
2
, 2.7 % de O
2
0.7 % de CO, proporciona una suma de 14.9 mol. Si se supone que
el gas que falta es el nitrgeno, se tienen 85.1 mol de N
2
.Por tanto, la ecuacin qumica de la
reaccin adopta la forma
xC
3
H
8
+ a(O
2
+ 3.76N
2
) 11.5CO
2
+ 0.7CO + 2.7O
2
+ 85.1N
2
+ bH
2
O
El balance de masa aplicado a cada uno de los elementos permite evaluar los
coeficientes desconocidos.
N
2
: 3.76a = 85.1 a = 22.65
C: 3x = 11.5 + 0.7 = 12.2 x= 4.07
O: 2(22.65)=2(11.5) + 0.7 + 2(2.7) + b b = 16.2
H: 8x = 2b
Con los valores calculados de x y b, los miembros de la izquierda y de la derecha de la
ecuacin del balance de hidrgeno son 32.56 y 32.4, respectivamente. La comprobacin resulta
bastante satisfactoria, dado el limitado nmero de cifras significativas utilizadas en los clculos.
La reaccin real, pues, viene representada por la ecuacin qumica.
4,07C
3
H
8
+ 22.65O
2
+ 85.1N
2
11.5CO
2
+ 0.7CO + 2.7O
2
+ 85.1N
2
+ 16.2H
2
O
Dividiendo por 4.07, ecuacin se puede escribir para 1 mol de combustible. Se ha visto
que la reaccin estequiomtrica para el propano es
C
3
H
8
+ 5O
2
+ 18.80N
2
3CO
2
+ 4H
2
O + 18.80N
2
El nmero de moles de oxgeno tericos empleados por mol de combustible es igual a 5.
Camara de
Combustion
11.5% C
2.7% O
0.7% CO
O
2
2
Productos
Secos
Aire
C H
3 8
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 16
En la combustin real, esta relacin es 22.65/4.07= 5.57. Por tanto, el porcentaje de aire
terico (o de oxgeno) utilizado en el proceso real de combustin es
Porcentaje de aire terico = , o lo que es lo mismo, el
porcentaje de aire en exceso es de 11 por 100
5. ENTALPIA DE FORMACION Y ENTALPIA DE COMBUSTION
5.1. Calores de Reaccin
Tratndose de los combustibles, el calor de la reaccin qumica de combustin es
conocido como poder calorfico, calor de combustin, entalpia de reaccin h
rp
, o energa interna
de reaccin u
rp
. El trmino poder calorfico es un nombre general sin significado especfico, a
menos que se exprese la forma en que se mide (o bien, est implcita) en el contexto. Si el poder
calorfico se mide por un calormetro de bomba (idealmente es una cmara rgida de volumen
constante), de uso normal en el caso de combustibles slidos y lquidos, el poder calorfico
obtenido es el de valor, a volumen constante q
r
, igual a la energa interna de la reaccin, u
rp
. El
poder calorfico de combustibles gaseosos por lo general se halla con un calormetro de flujo
constante, sobre todo a presin invariable, dispositivo que da el poder calorfico a presin
constante q
p
, el que numricamente es igual a la entalpia de reaccin |h
rp
|. En cada caso para
combustibles que contengan hidrgeno, existe un poder calorfico superior (p.c.s.) q
vh
, q
ph
(la h
es del ingls higher), cuando el H
2
O en los productos se ha condensado a la forma [H
2
O (1)], y
un poder calorfico inferior (p.c.i.) q
vh
,q
p
, (la l es del ingls lower), cuando el H
2
O no se ha
condensado a [H
2
O
(g)
]. El p.c.i. q
1
es igual al valor del p.c.s. menos el calor latente del vapor de
agua condensado. En trabajos de prueba el poder calorfico se convierte a un estado estndar,
simbolizado por , , y as sucesivamente, y con los datos suficientes es posible calcular
cualquier valor de poder calorfico a partir de otro, como se explicar ms adelante. La entalpia
y la energa interna de la reaccin, desde el punto de vista de la qumica, son negativas cuando
la reaccin es exotrmica. Por otra parte, los ingenieros generalmente consideran el poder
calorfico como positivo; en consecuencia y .
5.2. Base de Entalpia Igual a Cero
Una eleccin simple para el estado de referencia sera tomar h igual a cero a T = 0 K =
0
o
R, en esta forma todas las entalpias tendran un valor positivo. (Se denotan los valores de las
propiedades al estado estndar de referencia elegido mediante el superndice o, como en h.) Sin
embargo, se encuentra que muchos materiales contienen cierta energa aun en el cero absoluto
de temperatura. Esta energa se halla en la forma de energa de ligadura nuclear, fuerzas de
ligadura moleculares y otras fuerzas que no son iguales para todas las molculas. La situacin se
simplifica para los elementos, en oposicin a las molculas ms complejas. Es factible asignar
valores de entalpia relativa entre un elemento y otro que est en un estado arbitrario. Los efectos
de las energas moleculares se pueden calcular respecto a los elementos que constituyen las
molculas. Por conveniencia, para comparar con los datos del laboratorio, se asigna como
estado estndar de referencia de todos los elementos, ah" = 0 a T = 25 C (77F) y P = 1 atm.
Por consiguiente, para todos los elementos, h = 0 en el estado estndar de referencia.
Cuando el elemento existe en la forma qumica estable de un gas diatmico (N
2
, O
2
H
2
, etc.) al
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 17
estado de referencia, entonces a este gas se le asigna un valor de cero al estado estndar de
referencia. El valor de h, para los elementos en cualquier otro estado, se encuentra aplicando la
relacin
Fcilmente se determina el valor de u en el estado estndar de referencia u con la
relacin
u = h - Pv = - P v
y el valor de v se halla mediante los datos P-v-T en el estado de referencia para un elemento en
particular.
5.3. Entalpa de formacin
Se tiene establecido una base comn para la entalpa de todos los elementos. Cuando se
forman las molculas a partir de los elementos, se requiere un aporte o una liberacin de la
energa qumica para completar la reaccin. En cualquier caso, la energa de la molcula, y por
consiguiente su entalpa, difiere de la suma de las entalpias de los tomos constituyentes de la
molcula. La entalpa de la molcula resultante puede escribirse como:
Donde h
f
es la entalpa requerida para formar la molcula a partir de los tomos constituyentes,
para un estado dado, o entalpa de formacin. El trmino con la suma toma en cuenta la entalpia
aadida al compuesto por los N
i
tomos de cada elemento i que constituyen la molcula.
Mediante la ecuacin anterior se encuentra la entalpa del compuesto en el estado
estndar de referencia:
Sin embargo, h = 0 para todos los elementos en el estado estndar de referencia, por lo
que la entalpa de un compuesto al estado estndar de referencia es igual a la entalpa de
formacin al estado estndar de referencia. En esta forma es factible establecer un valor de
referencia para todos los compuestos asentando que:
En el estado estndar de referencia de T = 25C = 77F y P = 1 atm. Los valores de la
entalpa de formacin en el estado estndar de referencia generalmente se determinan
experimentalmente, aunque en ciertos casos se pueden predecir los valores con los mtodos de
la termodinmica estadstica. En la tabla A12 se presenta una tabulacin para para
diferentes tipos de sustancias. Debe observarse que los valores que se dan en esa tabla realmente
son A , Es decir, los valores en la tabla estn en base molar en lugar de base msica
y se debe usar la masa molecular M del compuesto para la conversin a base msica.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 18
Ahora es posible calcular el valor de la entalpia en cualquier estado, tomando como
valor de referencia la entalpia del compuesto al estado estndar de referencia, y se le llama
entalpia de referencia estandarizada del compuesto. Por lo tanto, la entalpia en otro estado
resulta
Donde h (T, P) es la entalpia estandarizada del compuesto.
Ejemplo 1.6: Encuentre la entalpia estandarizada en los casos siguientes:
Argn a 100C (considere que acta como gas ideal)
Agua lquida a 100C
Vapor de agua a 100C y 1 atm
Solucin: El cambio de h para el argn entre 25 y 100C se encuentra mediante tablas como
El hecho de considerar el gas ideal permite considerar h como independiente de la
presin. Puesto que el argn es un elemento, el valor de la entalpia al estado estndar de
referencia de 25C y 1 atm es igual a cero. Por lo tanto, el valor de la entalpia a T = 100C est
dado por
Para el agua lquida, considerndola incompresible, se emplea
El valor de se encuentra de las tablas y resulta (-286.0 x 1000)/18.02 = -15,870
kJ/kg y el c
p
para el agua se obtiene en las tablas es 4.178 kJ/ (kg. K) (empleando el valor a 323
K = 50C). Al sustituir se obtiene
Respecto al vapor de agua, es suficiente tomar el valor encontrado en b) para la entalpa
estandarizada del agua lquida y agregarle simplemente h
g
de las tablas de vapor de agua. En la
tabla se lee h
fg
= 2257.0 kJ/kg, por lo que
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 19
5.4. Entalpa de combustin
Considrese la combustin de un hidrocarburo general C
n
H
m
en aire. Si se acepta que
existe exactamente el oxgeno suficiente para reaccionar qumicamente con el combustible
presente, es decir, que se tienen presentes cantidades estequiomtricas de combustible y de
oxidante, la reaccin de combustin se escribe
Donde A
i
son los coeficientes estequiomtricos para esta reaccin. Realizando un balance de los
tomos en ambos lados de la ecuacin se obtiene A
2
= A
5
, A
1
= n + m/4, A
3
= n y A
4
= m/2. El
coeficiente estequiomtrico del combustible se ha tomado como la unidad arbitrariamente.
En la combustin con aire, el nitrgeno y el oxigeno del aire estn en la relacin
volumtrica (y, por consiguiente, en la relacin molar, si actan como gases ideales) A
2
/A
l
=
79/21 = 3.76, tal como se encuentran en la atmsfera. (Es de prctica general el agrupar todos
los otros gases inertes de la atmsfera con el nitrgeno, ya que los otros gases que se encuentran
comnmente en el aire ambiente, como el argn, CO, etc., estn presentes en pequeas
cantidades y, en cualquier caso, sus propiedades de inters en la combustin tienen valores muy
cercanos a los del nitrgeno.) El valor de A
2
= A
5
debe ser igual a 3.16A
1
= 3.76(n + m/4). En
este caso, la ecuacin de la combustin queda
Al escribir las ecuaciones anteriores se ha supuesto que tiene lugar una combustin
completa del hidrocarburo, por lo que los nicos productos de combustin resultan ser el CO, y
el H
2
O. Aun si se lograse un mezclado perfecto del combustible y el oxgeno, la combustin
completa no tendra lugar, por lo que durante la combustin se forman monxido de carbono y
xidos de nitrgeno, as como una serie de hidrocarburos intermedios, que estn sujetos, a su
vez, a la combustin. En la prctica, generalmente se introduce en la zona de combustin ms
oxgeno del necesario segn la ecuacin de la reaccin qumica balanceada que se mostr con
anterioridad. Este "exceso de aire" permite completar la reaccin de combustin aun cuando no
se logre un mezclado perfecto; sin embargo, se paga un precio, como se ver ms adelante.
Cuando tiene lugar una combustin completa, los coeficientes estequiomtricos son
reales y as se ve la relacin entre el nmero de moles de los productos y el de los reactivos que
intervienen en la reaccin. Si las mezclas de los productos y de los reactivos son proporcionales
a los coeficientes estequiomtricos, se dice que se encuentran en relacin estequiomtrica
simplemente, que son estequiomtricos.
An se forman cantidades mnimas de CO y xidos de nitrgeno; pero estas cantidades
son tan pequeas que si se ignoran no afectan a la primera ley escrita para un volumen de
control. Sin embargo, el CO y los xidos de nitrgeno representan problemas de contaminacin
importantes, incluso en las proporciones relativamente pequeas en que se forman si se queman
grandes cantidades de hidrocarburos.
En primer lugar se examinar el caso de un reactor de flujo constante, isotrmico, que es
alimentado con un combustible que fluye con una razn de flujo molar unitario, y con aire cuya
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 20
rapidez de flujo es tal que permite obtener las relaciones molares especificadas respecto al
combustible. Un general, el reactor presenta cierta transferencia de calor para permitir que el
volumen de control sea isotrmico. Aplicando la primera ley a este volumen de control se tiene
Donde los subndices r y p significan reactivos y productos, respectivamente. Permtase que la
reaccin se lleve a cabo en las condiciones particulares del estado estndar de referencia, es
decir, a la presin de 1 atm y con la temperatura mantenida constante a 25C = 77F por la
transferencia de calor desde el reactor. En esta forma, la ecuacin anterior escrita en base molar
se transforma en:
Donde, como previamente se hizo, la barra coronando a una cantidad indica que sta se expresa
en base molar. Si ahora se divide toda la ecuacin entre la rapidez de flujo molar del
combustible la ecuacin se escribe
La ecuacin expresa el flujo de calor por mol de combustible requerido para que el
reactor opere en las condiciones de referencia normalizada, el cual es igual a la diferencia neta
entre la entalpia de los productos que salen del reactor y la entalpia de los reactivos que entran.
La cantidad recibe el nombre de entalpia de combustin o algunas veces de calor de
combustin. De acuerdo a la convencin de signos para Q en la primera ley, se interpreta el Q
positivo como el calor que se transfiere al volumen de control, por lo que se espera que
generalmente tenga un signo negativo. El valor de , definido por la ecuacin, est fijo en un
combustible dado y representa una medida de la energa qumica contenida por mol de
combustible cuando se quema con oxgeno (o aire).
Ejemplo 1.7: Calcule la entalpia de combustin del metano.
Solucin: Para el metano (CH
4
), la ecuacin de combustin, ecuacin se escribe:
CH
4
+ (1 + 1)(O
2
+ 3.76N
2
) CO
2
+ 2H
2
O +3.76(2)N
2
Ahora es necesario conocer los valores de para cada compuesto que interviene en la
reaccin; lo cual se muestra a continuacin:
M , BTU/lbmol
CH4 16.042 -32200
O
2
32.000 0
N
2
28.016 0
CO
2
44.010 -169300
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 21
H
2
O
(g)
18.016 -123000
H2O (l)
-104000
Sustituyendo en la ecuacin y suponiendo que el agua se produce en forma de vapor, se
encuentra
Obsrvese que = para un proceso en flujo estable. Por consiguiente, la
entalpia de combustin por mol de metano es igual a
Los valores de la entalpia de combustin (valores inferiores) se encuentran tabulados
para muchas sustancias y algunos se incluyen en la tabla A12. Naturalmente sera ms deseable
un combustible con la entalpa de combustin por unidad de masa mayor que aquel que tiene
una entalpa de combustin por unidad de masa menor, cuando los costos son iguales.
6. ANLISIS DE LA PRIMERA LEY DE SISTEMAS REACTIVOS
El balance de energa (o primera ley) es aplicable por igual a sistemas reactivos y no
reactivos. Sin embargo, los sistemas qumicamente reactivos implican cambios en su energa
qumica y en consecuencia, resulta ms conveniente reescribir las relaciones de balance y
energa en forma tal que los cambios en las energas qumicas se expresen de modo explcito.
Primero para sistemas de flujo estable, y luego para sistemas cerrados.
6.1. Sistemas de flujo estable
Antes de escribir la relacin del balance de energa, es necesario expresar la entalpia de
un componente en una forma adecuada para usarla en sistemas reactivos. Es decir, se necesita
expresar la entalpia tal como es relativa al estado de referencia estndar y al trmino de la
energa qumica que aparece explcitamente. Cuando se expresa de manera adecuada, el trmino
entalpia debe reducirse a la entalpia de formacin en el estado de referencia estndar. Con
esto en mente, se expresa la entalpia de un componente por unidad de mol.
Donde el trmino entre parntesis representa la entalpia sensible relativa al estado de referencia
estndar, que es la diferencia entre h (la entalpia sensible en el estado especificado) y h (la
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 22
entalpia sensible en el estado de referencia estndar de 25C y 1 atm). Esta definicin permite
utilizar valores de entalpia de las tablas sin que importe el estado de referencia utilizado en la
construccin.
Cuando los cambios de energas cintica y potencial son insignificantes, la relacin de
balance de energa para un sistema de flujo se puede expresar para un sistema
de flujo estable qumicamente reactivo ms explcitamente como:
Donde y representan las relaciones de flujo molares del producto p y el reactivo r,
respectivamente.
En el anlisis de combustin conviene ms trabajar con cantidades expresadas por mol
de combustible. Tal relacin se obtiene al dividir cada trmino de la ecuacin anterior entre la
relacin de flujo molar del combustible, produciendo:
Donde N
r
y N
p
representan el nmero de moles del reactivo r y el producto p, respectivamente,
por mol de combustible. Observe que N
r
= 1 para el combustible, y que los otros valores de N
r
y
N
p
pueden sacarse directamente de la ecuacin de combustin balanceada. Considerando la
transferencia de calor hacia el sistema y el trabajo realizado por el sistema como cantidades
positivas, la relacin de balance de energa anterior se expresa de una manera ms compacta
como:
o como:
(kJ/kmol combustible)
donde:
y (kJ/kmol combustible)
Si se dispone de la entalpia de combustin para una reaccin particular, la ecuacin
de energa de flujo estable por mol de combustible se expresa como:
(kJ/kmol)
Las anteriores relaciones de balance de energa se escriben a veces sin el trmino
trabajo, pues la mayor parte de los procesos de combustin de flujo estable no implican ninguna
interaccin de este tipo.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 23
Una cmara de combustin generalmente involucra salida de calor pero no entrada de
calor. Entonces el balance de energa para un proceso tpico de combustin de flujo estable se
convierte en:
Esto expresa que la salida de calor durante un proceso de combustin simplemente es la
diferencia entre la energa de los reactivos que entran y la energa de los productos que dejan la
cmara de combustin.
6.2. Sistemas Cerrados
La relacin general de balance de energa para un sistema cerrado
se expresa para un sistema cerrado qumicamente reactivo estacionario como:
(kJ/kmol combustible)
Donde U
productos
representa la energa interna de todos los productos, y U
reactivos
es la energa
interna de los reactivos. Para evitar el uso de otra propiedad la energa interna de formacin ,
se utiliza la definicin de entalpia o y expresa la
ecuacin anterior como:
Donde hemos tomado la transferencia de calor hacia el sistema y el trabajo realizado por el
sistema como cantidades positivas. Los trminos son insignificantes para slidos y lquidos
y pueden sustituirse por R
u
T para gases que se comportan como un gas ideal. Tambin, si se
desea, los trminos en la ecuacin anterior pueden sustituirse por .
El trmino trabajo en las ecuaciones representan todas las formas de trabajo, incluyendo
el trabajo de frontera. Se mostr que para sistemas cerrados no reactivos
sometidos a un proceso de expansin o compresin a P = constante en cuasi equilibrio. Este
tambin es el caso para los sistemas qumicamente reactivos.
Existen varias consideraciones importantes en el anlisis de sistemas reactivos. Por
ejemplo, se necesita conocer si el combustible es un slido, un lquido o un gas, pues la entalpia
de formacin de un combustible depende de la fase del combustible. Tambin es necesario
conocer el estado del combustible cuando entra a la cmara de combustin para determinar su
entalpia. En especial para los clculos de entropa es importante saber si el combustible y el aire
entran a la cmara de combustin premezclados o separadamente. Cuando se enfran los
productos de combustin hasta temperaturas bajas, se debe considerar la posibilidad de
condensacin de una parte del vapor de agua en los gases producto.
Ejemplo 1.8 Anlisis de Sistemas de la Primera Ley
Se quema metano gaseoso, inicialmente a 400K, con un 50 por 100 de exceso de aire,
que entra a 500K en la cmara de combustin. La reaccin, que transcurre a 1 atm, es completa,
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 24
y la temperatura de los gases producto es igual a 1.800K. Determnese el calor transferido hacia
o desde la cmara de combustin, en kJ/Kmol de combustible.
Solucin:
Datos: Metano gaseoso reacciona con aire en la cmara de combustin mostrada en la figura
Modelo Sistema abierto en rgimen estacionario; combustin completa; gases ideales
Anlisis La transferencia de calor se obtiene a partir del balance de energa en rgimen
estacionario
Donde n es el cociente entre el flujo molar del componente i y el flujo molar de combustible. Lo
primero que hay que determinar son los valores de n. La reaccin para la combustin completa
del metano con el 50 por 100 de exceso de aire es:
CH
4(g)
+ 3(O
2(g)
+ 3.76N
2(g)
) CO
2(g)
+ 2H2O
(g)
+ 11.28N
2(g)
+ O
2(g)
Se ha indicado que el estado del agua en los productos es gaseoso, ya que la temperatura
final se encuentra muy por encima de la temperatura de roco del agua. Adems, como la
presin parcial del vapor de agua es tan slo 132 mbar [
agua
=(1.01325bar)(2/15.8)], se puede
suponer que el vapor es un gas ideal junto con los otros gases producto.
Una vez que se han identificado los reactantes y los productos con sus valores de n, el
balance de energa queda
La parte de la entalpa sensible, por tablas para todos los gases excepto el metano, y los
valores de entalpa de formacin h
298
se encuentran en la Tabla A12. En este texto no se tienen
Camara de
Combustion
Productos
Secos
Aire
CH
4
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 25
datos tabulados que permitan calcular la variacin de entalpa del metano entre 298 K y 400 K.
Hay que obtener este valor integrando los datos de c
p
. En la Tabla A2
En la que T viene expresada en kelvin. El valor adecuado de R
u
es 8.314 kJ/Kmol.K. La
variacin de entalpa del metano entre 298K y 400K, utilizando la ecuacin de c
p
anterior,
omitiendo los pasos de la integracin, es igual a
Compuesto
i
n
i
T
(K)
(kJ/kmol)
(kJ/kmol)
(kJ/kmol)
CH
4(g)
1 400 -74870 3876 -70994
O
2(g)
3 500 0 14770-8682 6088
N
2(g)
11.28 500 0 14581-8669 5912
CO
2(g)
1 1800 -393520 88806-9364 -314078
H
2
O
(g)
2 1800 -241820 72513-9904 -179211
N
2(g)
11.28 1800 0 57651-8669 48982
O
2(g)
1 1800 0 60371-8682 51689
Sustituyendo estos valores en el balance de energa se llega a:
7. TEMPERATURA DE LA FLAMA ADIABTICA
Una medida de la utilidad de un combustible particular es su entalpia de combustin.
Sin embargo, en ciertos casos el ingeniero est ms interesado en producir una temperatura
elevada que una gran cantidad de energa liberada. Este es el caso en el diseo de equipos de
proceso que requieren una temperatura mnima de operacin, como son los secadores y los
hornos para procesos qumicos. En esta seccin se van a comparar las temperaturas disponibles
por la combustin de un combustible.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 26
Supngase que un reactor de combustin se va a operar en forma diferente a la
empleada para determinar la entalpa de combustin. En lugar de extraer la energa necesaria
para que el reactor se mantenga en condiciones isotrmicas mediante la transferencia de calor,
ahora se le va a aislar perfectamente, de tal modo que no tenga lugar ninguna transferencia de
calor y el reactor opere adiabticamente. Entonces, en este caso, la ecuacin de la primera ley se
reduce a:
Suponiendo que los reactivos entran al reactor en el estado estndar de referencia, la
ecuacin con base en la unidad molar de combustible queda
Cuando se dispone de los datos de la entalpia de combustin para el combustible que se
desea emplear, resulta conveniente sustituir para eliminar el trmino de los reactivos:
La entalpia que sale del reactor, transportada por los productos de combustin, es igual
a la entalpia de los productos en el estado estndar de referencia ms (ya que tiene un valor
negativo) la energa liberada por la reaccin de combustin.
La solucin de la ecuacin para la temperatura de los productos de combustin
(suponiendo que sea la misma para todos los productos debido al mezclado dentro del reactor)
es iterativa. Se supone una temperatura y se encuentran los valores de en las tablas A4 a la
A11 o por clculo. Los valores de se sustituyen en el lado de los productos y el resultado se
comprueba con el lado de los reactivos. El proceso se repite hasta que se encuentra una
temperatura que satisfaga la igualdad. En el caso donde no hay exceso de aire, la temperatura
recibe el nombre de temperatura terica de flama adiabtica para el combustible. La temperatura
terica de flama adiabtica es la mayor temperatura que se puede obtener del combustible
empleado en la reaccin de combustin (a menos que se realice cierto precalentamiento de los
reactivos hasta temperaturas superiores a la del estado estndar de referencia), dado que no se
permite ninguna transferencia de calor hacia los alrededores y no hay exceso de aire presente
que absorba algo de la entalpia de combustin. En las tablas A12 se presentan los valores de la
temperatura terica de flama adiabtica para algunos combustibles comunes. Obsrvese que el
valor de la temperatura terica de flama adiabtica se basa en la ecuacin de la reaccin qumica
considerada. Con frecuencia, la temperatura real es menor debido a la disociacin o ionizacin
de los productos de combustin o a la presencia de reacciones que se supuso no tendran lugar.
(En algunos casos, la operacin a las condiciones estequiomtricas puede producir una
temperatura de flama menor que a las condiciones ligeramente fuera de las estequiomtricas.
Por ejemplo, a la temperatura del quemador pueden ocurrir reacciones adicionales; que el CO,
se disocie para formar CO o que se formen cantidades importantes de xidos de nitrgeno. En
ese caso, realmente tiene lugar una temperatura de flama adiabtica superior cuando se trabaja
en condiciones diferentes a las estequiomtricas, donde estas reacciones se han suprimido.)
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 27
Cuando se cuenta con tablas o programas de cmputo para h (T
P
, P) de cada producto,
entonces se les emplea para determinar la temperatura de flama adiabtica, mediante la eleccin
iterativa de T hasta que la ecuacin de la llama sea satisfecha. Debe cuidarse que las fuentes de
todos los datos empleados estn en el estado estndar de referencia, o el usuario debe convertir
los datos de la fuente al estado estndar de referencia.
Otro mtodo de encontrar T
p
consiste en escribir de nuevo la ecuacin como:
y entonces reemplazar los cambios de la entalpa en funcin de los calores especficos para un
quemador a presin constante o en considerar que la entalpa es independiente de la presin
(hiptesis de gas ideal), de modo que la ecuacin anterior queda de la sgte forma:
Ahora se emplea la expresin polinomial de la tabla A13 para el lado izquierdo y se
realiza la iteracin hasta la convergencia. Obsrvese que, para una T fija, las individuales de
cada uno de los productos tiene la forma
Fig. 1.3
Ahora el proceso iterativo qued algo simplificado. En el caso del valor de T
p
considerado, se encuentran los valores de c
p
*(T) para cada compuesto, y la convergencia se
demuestra mediante la prueba de la igualdad en la ecuacin. La figura 1.3 presenta una grfica
de c
p
* (T).
7.0
6.0
5.0
4.0
3.0
2.0
1.0
0
500 1000 1500 2000 2500 3000
0 1000 2000 3000 4000 5000
Temperatura C
Temperatura F
c (T) p
R
CO2
H O 2
O2
N y Aire 2
Ar
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 28
Ejemplo 1.9: Calcule la temperatura terica de flama adiabtica para el metano.
Solucin: La entalpia de combustin para el metano (con produccin de vapor de agua) se
encontr en el ejemplo 10.2 igual a -802900 kJ/kmol. Las entalpias en el estado estndar de
referencia para los productos tambin se dieron en ese ejemplo. La reaccin qumica es:
CH
2
+ 20
2
+ 7.52N
2
CO
2
+ 2H
2
O + 7.52N
2
Sustituyendo los valores conocidos para 1 kmol de combustible, se obtiene:
El lado derecho de esta ecuacin no incluye el N
2
ya que en su estado estndar de
referencia la entalpia es cero. El trmino en el lado izquierdo es igual a:
La entalpia del N
2
se vuelve importante y debe incluirse ya que esta ltima expresin se
refiere a la temperatura de los productos que dejan el reactor.
Empleando en primer lugar las expresiones polinomiales de los calores especficos para
determinar la temperatura de flama adiabtica, la expresin del lado izquierdo mediante este
mtodo queda:
Para CO
2
Para el H
2
O
Y para el N
2
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 29
Se escogen valores de T
p
, se evala el lado izquierdo de la relacin de la primera ley
mediante la suma de los tres trminos anteriores y se compara con el lado derecho. La
representacin grfica de las iteraciones resulta til para la interpretacin de los resultados.
T
p
(Propuesta) (K) CO
2
H
2
O N
2
Suma (kJ) -q (kJ)
2300 110700 174200 499200 748100 802700
2400 117300 183900 523700 824900 802700
2346 113700 178700 510500 802900 802700
La grfica de la suma = contra T
p
(propuesta) se muestra a continuacin.
Fig. 1.4
Obsrvese que la tercera propuesta se escogi con base en una interpolacin lineal entre
los valores antes seleccionados de 2300 y 2400 K y tambin cmo este caso corresponde al
resultado correcto. Con frecuencia esto ocurre en los problemas de combustin porque es casi
lineal con T dentro de intervalos regularmente grandes de temperatura y el procedimiento de
iteracin converge muy rpidamente.
Tambin debe notarse que la mayor parte de la entalpa de los productos sale con el
nitrgeno ms que con los productos de la reaccin CO, y H
2
0.
El valor calculado no corresponde muy bien al valor tabulado de 2285 K para la
temperatura de flama adiabtica del metano, que se lee en la tabla C. 11. Esta diferencia se debe
en parte al empleo de las relaciones de c
p
(T) fuera del intervalo de temperatura para el cual se
determinaron (generalmente este intervalo abarca de 273 a 1800 K).
8. CAMBIO DE ENTROPA DE SISTEMAS REACTIVOS
Hasta ahora se han analizado procesos de combustin desde el punto de vista de la
conservacin de la masa y la energa. Sin embargo, el anlisis termodinmico de un proceso
resulta incompleto sin el examen de los aspectos de la segunda ley. De particular inters resultan
la exerga y la destruccin de exerga, las cuales se relacionan con la entropa.
2300
7.8 X 10
5
8.0 X 10
5
S
u
m
a
(
k
J
)
8.2 X 10
5
8.4 X 10
5
2350
T (Propuesta)
p
( K)
2400
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 30
Las relaciones de balance de entropa aplicadas tanto a sistemas reactivos como no
reactivos, siempre que las entropas de los constituyentes individuales se evalen de manera
apropiada con una base comn. El balance de entropa para cualquier sistema (incluyendo los
sistemas reactivos) que experimenta cualquier proceso se expresa como:
(kJ/K)
Utilizando cantidades por unidad mol de combustible y tomando la direccin positiva de
la transferencia de calor como aquella que se dirige hacia el sistema, la relacin de balance de
entropa se puede expresar de manera ms explcita para un sistema reactivo cerrado o de flujo
estable como:
(kJ/K)
Donde T
k
es la temperatura de la frontera donde Q
k
la cruza. Para un proceso adiabtico (Q=0),
el trmino de transferencia de entropa desaparece y la ecuacin se reduce a:
La entropa total generada durante un proceso se determina al aplicar el balance de
entropa a un sistema extendido que incluya al sistema mismo y a sus alrededores inmediatos,
donde puedan estar ocurriendo irreversibilidades externas. Cuando se evala la transferencia de
entropa entre un sistema extendido y sus alrededores, la temperatura de frontera del sistema
extendido simplemente se toma como la temperatura ambiente.
La determinacin del cambio de entropa asociado con una reaccin qumica parecera
directa, salvo por una cosa: las relaciones de entropa para los reactivos y los productos
implican las entropas de los componentes, no los cambios de entropa, como fue el caso para
los sistemas no reactivos. De modo que surge el problema de encontrar una base comn para la
entropa de todas las sustancias, como se hizo con la entalpia. La bsqueda de dicha base comn
condujo, en los principios del siglo XX, al establecimiento de la tercera ley de la
termodinmica. La tercera ley se formul como sigue: La entropa de una sustancia cristalina
pura a la temperatura del cero absoluto es cero.
Por consiguiente, la tercera ley de la termodinmica proporciona una base absoluta para
los valores de entropa para todas las sustancias. Los valores de entropa relativos a esta base
reciben el nombre de la entropa absoluta. Los valrese que se incluyen en las tablas A4 hasta
la A11 para diversos gases como N
2
, O
2
, CO, CO
2
, H
2
, H
2
O, OH y O, son los valores de
entropa absoluta de gas ideal a la temperatura especificada y a una presin de 1 atm. Los
valores de entropa absoluta para diversos combustibles se enumeran en la tabla A12 junto con
los valores en el estado de referencia estndar de 25C y 1 atm.
La ecuacin anterior es una relacin general para el cambio de entropa de un sistema
reactivo. Requiere la determinacin de la entropa de cada componente individual de los
reactivos y los productos, lo que en general no es fcil de lograr. Es posible simplificar un poco
los clculos de entropa si los componentes gaseosos de los reactivos y los productos se
aproximan como gases ideales. Sin embargo, los clculos de entropa nunca son tan fciles
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 31
como los clculos de la entalpia o la energa interna, puesto que la entropa es una funcin tanto
de la temperatura como de la presin, incluso para gases ideales.
Cuando se evala la entropa de un componente de una mezcla de gas ideal, se debe
emplear la temperatura y la presin parcial del componente. Observe que la temperatura de un
componente es la misma que la temperatura de la mezcla, y que la presin parcial de un
componente es igual a la presin de la mezcla multiplicada por la fraccin molar del
componente.
Los valores de entropa absoluta a presiones diferentes a P
0
= 1 atm para cualquier
temperatura T pueden obtenerse de la relacin del cambio de entropa del gas ideal escrita para
un proceso isotrmico imaginario entre los estados (T, P
0
) y (T,P)
Para el componente i de una mezcla de gases ideales, esta relacin puede escribirse
como:
(kJ/kmol.K)
Donde P
0
= 1 atm, P
i
es la presin parcial, y es la fraccin molar del componente y P
m
es la
presin total de la mezcla.
Si una mezcla de gas est relativamente a una presin alta o a baja temperatura, la
desviacin del comportamiento de gas ideal debe tomarse en cuenta incorporando ecuaciones de
estado ms exactas o las grficas generalizadas de entropa.
9. ANALISIS DE LA SEGUNDA LEY A LOS PROCESOS DE COMBUSTIN
Todos los clculos de las propiedades del combustible (entalpa de combustin, tem-
peratura de flama adiabtica y las aplicaciones de dichas propiedades (combustible y aire
precalentados, efectos del exceso de aire, clculos para el horno y la caldera) se han basado
nicamente en el empleo de la primera ley a sistemas reactivos. La segunda ley tambin tiene
importantes usos tanto en las reacciones de combustin como en las qumicas. Se van a estudiar
dos tipos generales de las aplicaciones de la segunda ley: la determinacin de la posibilidad de
reaccin para un conjunto de condiciones dado y el anlisis de la eficiencia termodinmica
global de un sistema donde la reaccin qumica juega un papel importante.
9.1. Determinacin de la posibilidad de reaccin: combustin adiabtica
Una consecuencia de la segunda ley es que la generacin de entropa en cualquier
proceso adiabtico es mayor o igual a cero. Tcitamente se ha supuesto hasta ahora que las
reacciones qumicas empleadas en este captulo ocurren en realidad; es decir, que metano
mezclado con aire presenta una reaccin de combustin de la que resulta la formacin de los
productos de combustin bajo la forma de CO, y H
2
O. La experiencia indica que esto puede
ocurrir; sin embargo, si no existen ciertas condiciones especiales (por ejemplo, la presencia de
una fuente de ignicin) la reaccin tiene un carcter contingente. El empleo de la segunda ley
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 32
permite predecir si una reaccin qumica dada puede ocurrir, como se ver despus. El que la
reaccin sea posible, de hecho acontezca y con qu rapidez tenga lugar depende de otros
factores (la presencia de una fuente de ignicin o de un catalizador, por ejemplo). Estos factores
se estudian en el tema de cintica qumica y quedan fuera del alcance de este texto.
La aplicacin de la segunda ley, para determinar si una reaccin tiene lugar, es directa.
Se va a probar en un reactor adiabtico, en flujo estable, si la generacin de entropa es positiva.
De ser as, la reaccin es factible. Sin embargo, si la generacin de la entropa calculada resulta
negativa, entonces la reaccin propuesta no es posible. Si la generacin de la entropa resulta
igual a cero, entonces la reaccin qumica es reversible.
La segunda ley requiere para un reactor adiabtico y en flujo estable, que:
Ejemplo 1.10 Se precalienta metano a 80C y se quema con un 20% de exceso de aire, el cual
ha sido precalentado a 200C. Es posible esta reaccin de acuerdo con la segunda ley?
Solucion: La ecuacin de la reaccin qumica es igual a la de los ejemplos anteriores. En el
ejemplo anterior se encontr la temperatura de los productos igual a 2199 K. Los datos
requeridos se toman de la tabla A12:
Reactivo Moles
kJ/kmolK
Producto Moles
kJ/kmolK
CH
4
1 186.3 CO
2
1 213.7
O
2
2.4 205.03 O
2
0.4 205.03
N
2
9.024 191.5 N
2
9.024 191.5
12.424 H
2
O
(vapor)
2 188.7
12.424
Ahora es necesario calcular los valores de la entropa en las condiciones que presentan
los reactivos y los productos. Dado que la combustin tiene lugar a una presin total de 1 atm y
que los materiales actan como una mezcla de gases ideales, la presin parcial de cada
constituyente de los reactivos y de los productos est dada por P
i
= (n
i
/n)(101.2 kPa). La
entropa de cada constituyente en las condiciones conocidas de temperatura y de presin parcial
se obtiene mediante la ecuacin (9A0a) modificada para dar la entropa estndar:
Obsrvese que las dos formas finales de la ecuacin slo son vlidas con una presin
total de 1 atm en el quemador. Para todas las sustancias en este problema, a excepcin del
metano, las tablas de aire resultan adecuadas y dan los valores de
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 33
Directamente. (Nota: Los valores de las tablas se expresan por unidad de masa y no por mole).
Para el metano, es posible emplear las expresiones polinomiales para c
p
(T) de tablas
De estos clculos se obtiene lo siguiente:
Reactivo T
r
(K)
kJ/(kmolK)
Producto T
r
(K)
kJ/(kmolK)
CH
4
353 0.0805 213.5 CO
4
2199 0.0805 336.1
O
2
473 0.1932 232.6 O
2
2199 0.0322 301.0
N
2
473 0.7263 207.8 N
2
2199 0.7263 258.2
H
2
O 2199 0.1610 284.8
Al sustituir en la ecuacin para 1 kmol de combustible, queda:
por lo tanto, la reaccin es posible, como ya se esperaba.
9.2. Funcin de Gibbs estndar de reaccin
Para un quemador isotrmico que opere a la temperatura T
a
=T
r
=T
p
, para una mol de
combustible, despus de emplear la funcin de Gibbs ( ) se transforma en
Dado que s
gen
debe ser mayor o igual a cero para que la reaccin tenga lugar, para hacer
que la reaccin sea isotrmica y reversible a la temperatura de los alrededores se requiere que
Resulta obvio que la funcin de Gibbs es una propiedad muy importante para deter-
minar si una reaccin particular es contingente.
9.3. Anlisis de Sistemas Reactivos
La exerga es una magnitud termodinmica que indica el mximo trabajo terico que se
puede alcanzar por la interaccin espontnea entre un sistema y su entorno. Informa de la
utilidad potencial del sistema como fuente de trabajo. Definida de otra forma la exerga es la
porcin de la energa que puede ser transformada en trabajo mecnico, la parte restante, sin
utilidad prctica, recibe el nombre de entropa.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 34
Una vez que se evala el cambio de entropa total o la generacin de entropa, la exerga
destruida X
destruida
asociada con una reaccin qumica puede determinarse de:
donde T
0
es la temperatura absoluta de los alrededores.
Cuando se analizan sistemas reactivos se tiene ms inters por los cambios en la exerga
de los sistemas reactivos que en los valores de exerga en varios estados como se ve en la fig. 5.
Fig. 5
Se tiene que tener en cuenta que el trabajo reversible W
rev
representa el trabajo mximo
que puede efectuarse durante un proceso. En ausencia de cualquier cambio en las energas
cintica y potencial, la relacin del trabajo reversible para un proceso de combustin de flujo
estable que incluye transferencia de calor nicamente con los alrededores a T
0
puede obtenerse
reemplazando los trminos de entalpia por , lo que produce:
Una situacin interesante surge cuando tanto los reactivos como los productos estn a la
temperatura de los alrededores T
0
. En este caso, , que es, por
definicin, la funcin de Gibbs por unidad mol de una sustancia a temperatura T
0
. La relacin
del W
rev
en este caso se escribe como:
R
e
a
c
t
i
v
o
s
P
r
o
d
u
c
t
o
s
Trabajo
Reversible
Exergia
Estado T,P
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 35
donde es la funcin de Gibbs de formacin ( para elementos estables como N
2
y O
2
en
el estado de referencia estndar de 25C y 1 atm, justo como la entalpia de formacin) y
representa el valor de la funcin de Gibbs sensible de una sustancia a temperatura T
0
relativa al estado de referencia estndar.
En el caso muy especial en el que T
react
= T
prod
= T
0
= 25C (por ejemplo, los reactivos,
los productos y los alrededores estn a 25C) y la presin parcial P
i
= 1 atm para cada
componente de los reactivos y los productos se tiene:
Se puede concluir, de acuerdo con la ecuacin anterior, que el valor de (el negativo
de la funcin de formacin de Gibbs a 25C y 1 atm) de un compuesto representa el trabajo
reversible asociado con la formacin de ese compuesto a partir de sus elementos estables a 25C
y 1 atm en un ambiente a 25C y 1 atm. Los valores de de varias sustancias se incluyen en la
tabla A12.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 36
10. TEMAS DE INTERES: CELDAS DE COMBUSTIBLE
Una celda de combustible es un dispositivo electroqumico cuyo concepto es similar al
de una batera. Consiste en la produccin de electricidad mediante el uso de qumicos, que
usualmente son hidrgeno y oxgeno, donde el hidrgeno acta como elemento combustible, y
el oxgeno es obtenido directamente del aire.
Tambin pueden ser usados otros tipos de combustibles que contengan hidrgeno en su
molcula, tales como el gas metano, metanol, etanol, gasolina o diesel entre otros.
Debido a que la generacin de energa elctrica es directa, la eficiencia que alcanza una
celda de combustible puede ser muy elevada, adems al no tener partes en movimiento son muy
silenciosas. Sumado a todo esto hay que agregar que la celda de combustible no usa la
combustin como mecanismo de generacin de energa, lo que la hace prcticamente libre de
contaminacin.
Las celdas de combustible individuales pueden combinarse para producir motores ms
potentes impulsados por ejemplo a hidrgeno.
Pueden ser fabricadas de distintos tamaos y para distintas aplicaciones que van desde
su uso en telefona celular, hasta el uso de stas para impulsar automviles.
10.1. Funcionamiento
El funcionamiento de una celda de combustible consiste bsicamente en la oxidacin
del hidrgeno en agua, generando energa elctrica y calor directamente, sin pasar por
generadores u otros artefactos.
Toda celda de combustible est compuesta por un nodo, un ctodo y electrolitos. Sin
embargo, siendo la oxidacin del hidrgeno igual para todos los tipos de celdas de combustible,
los materiales usados en stas son muy variados.
La reaccin producida da lugar a la formacin de electricidad, calor y agua.
Esto se logra alimentando el hidrgeno en el nodo de la celda y el oxigeno en el ctodo, los
cuales estn separados por una membrana electroltica.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 37
La reaccin se produce dentro de la celda misma. La produccin de agua toma lugar en
distintas partes de la celda dependiendo del electrolito utilizado.
El hidrgeno fluye hacia el nodo de la celda, donde una cubierta de platino ayuda a
quitar los electrones a los tomos de hidrgeno dejndolo ionizado, o sea, en forma de protones
(H+). La membrana electroltica permite el paso solo de los protones hacia el ctodo.
Debido a que los electrones no pueden pasar a travs de la membrana, se ven forzados a
salir del nodo por un circuito externo como forma de corriente elctrica, sta es la corriente
elctrica que se utiliza para hacer funcionar los artefactos.
Luego, a medida que el ctodo deja fluir a travs de l al oxgeno, ste se combina con
los protones y los electrones anteriormente citados para formar agua. Como esta reaccin
naturalmente est desplazada hacia la formacin de agua, cuando se produce, se libera energa
en forma de calor. Esta una reaccin positiva y por lo tanto exotrmica. El proceso qumico que
se lleva a cabo es el siguiente:
nodo: 2H2 4H+ + 4e-
Ctodo: 4e- + 4H+ + O2 2H2O
Reaccin completa: 2H2 + O2 2H2O
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 38
Esta operacin se puede hacer de manera contnua si los suministros de componentes se
hacen en forma constante y a un rgimen de flujo estable. En este tipo de operacin, al hacerse
en forma isotrmica, las limitaciones termodinmica para el rendimiento no existen (Ciclo de
Carnot).
10.2. Tipos de celdas de combustible
cido Fosfrico (PAFC)
Temperatura de operacin: ~ 220 C Este es el tipo de celda de combustible ms
desarrollado a nivel comercial y ya se encuentra en uso en aplicaciones tan diversas como
clnicas, hospitales, hoteles, edificios de oficinas, escuelas, plantas elctricas y una terminal
aeroportuaria. Las celdas de combustible de cido fosfrico generan electricidad a ms del 40%
de eficiencia y cerca del 85% si el vapor que sta produce es empleado en cogeneracin -
comparado con el 30% de la ms eficiente mquina de combustin interna. Este tipo de celdas
puede ser usado en vehculos grandes como autobuses y locomotoras. Existen en produccin
comercial unidades de alrededor de 200kw.
Polmero Slido(PEM)
Temperatura de operacin: 50 - 100 C Tienen una densidad de potencia alta, pueden
variar su salida para satisfacer cambios en la demanda de potencia y son adecuadas para
aplicaciones donde se requiere una demanda inicial de energa bastante importante, tal como en
el caso de automviles, de acuerdo con el Departamento de Energa de los Estados Unidos, "son
los principales candidatos para vehculos ligeros, edificios y potencialmente otras aplicaciones
mucho ms pequeas tales como bateras recargables para videocmaras por ejemplo.
Carbonato Fundido(MCFC)
Temperatura de operacin: ~ 600 C Las celdas de combustible de carbonato fundido
prometen altas eficiencias combustible-electricidad y la habilidad para consumir combustibles a
base de carbn. En este tipo de celdas es aprovechada la electricidad y el calor generado.
Oxido Slido(SOFC)
Temperatura de operacin: 500 - 1000 C Es una celda de combustible altamente
prometedora, podra ser utilizada en aplicaciones grandes de alta potencia incluyendo estaciones
de generacin de energa elctrica a gran escala e industrial. Algunas organizaciones que
desarrollan este tipo de celdas de combustible tambin prevn el uso de stas en vehculos
motores. Las unidades que se abrigan van desde 25 hasta 100kw de potencia. Un sistema de
xido slido normalmente utiliza un material duro cermico en lugar de un electrolito liquido
permitiendo que la temperatura de operacin sea muy elevada. Las eficiencias de generacin de
potencia pueden alcanzar un 60%.
Alcalinas
Temperatura de operacin: 50 - 250 C Utilizadas desde hace mucho tiempo por la
NASA en misiones espaciales, este tipo de celdas pueden alcanzar eficiencias de generacin
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 39
elctrica de hasta un 70%. Estas celdas utilizan hidrxido de potasio como electrolito. Hasta
hace poco tiempo eran demasiado costosas para aplicaciones comerciales pero varias compaas
estn examinando la forma de reducir los costos y mejorar la flexibilidad en su operacin.
Produccin de hidrgeno
El hidrgeno a ser utilizado en las celdas de combustible puede obtenerse a partir de
varias formas, utilizando diversos equipamientos y combustibles.
Produccin de hidrgeno a partir de energa solar.
En el ciclo del hidrgeno solar la electricidad producida por los mdulos solares opera
un equipo de electrlisis que divide el agua en sus dos componentes elementales, hidrgeno
(H2) y oxgeno (O2). El oxgeno se libera al aire y el hidrgeno se bombea a los tanques, donde
es almacenado en el lugar de produccin.
Produccin de hidrgeno a partir de metano (CH4).
Cuando la cantidad de energa requerida es importante, como por ejemplo para
abastecer una industria, edificios, etc, lo ms conveniente es adoptar un sistema alimentado a
gas natural o metano. Este sistema se basa en la oxidacin del metano produciendo dixido de
carbono e hidrgeno, el cual pasa a alimentar las celdas de combustible. Generalmente las
celdas de combustible tienen una eficiencia del 40%, por otro lado un procesador de
combustible tiene una eficiencia de aproximadamente el 80%. Por lo tanto la eficiencia total del
sistema "procesador + celda de combustible" es de alrededor del 30%. La produccin de
hidrgeno a partir de metano se basa en la siguiente reaccin qumica:
CH
4
+ H
2
O CO + 3H
2
CO + H
2
O CO
2
+ H
2
CH
4
+ 2H
2
O 4H
2
+ CO
2
10.3. Conclusiones
Varias son las caractersticas que hacen que las celdas de combustible se consideren una
de las formas alternativas ms ventajosas para la obtencin de energa.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 40
Sus altas eficiencias rozan el 80% cuando adems de electricidad se recupera calor. Este
valor supera ampliamente las eficiencias de otros sistemas convencionales.
Adems, la energa producida es 100% limpia, ya que el nico producto que se obtiene
es agua o vapor de agua dependiendo de la temperatura de operacin del dispositivo.
Otra de sus ventajas es que pueden conectarse en paralelo para suplir cualquier
requerimiento energtico. Las celdas de combustible adosadas a un procesador permiten obtener
energa a partir de combustibles corrientes como alcoholes, gas natural y combustibles de
origen fsil, as como tambin a partir de biomasa o de la fraccin orgnica recuperada de
residuos slidos domiciliarios.
De todas formas, el combustible ms conveniente termina siendo el hidrgeno, ya que
es el que ms energa entrega por unidad de masa (141 MJ/Kg). Adems, el hidrgeno puede
obtenerse fcilmente por electrlisis del agua. Estos equipos de electrlisis se pueden alimentar
de energa elctrica obtenida por paneles fotovoltaicos o aerogeneradores. La Patagonia
Argentina es muy apta para el emplazamiento de estos ltimos con ese fin.
El aspecto econmico tambin es de gran relevancia, los precios de las celdas de
combustible no son altos cuando se los compara con los gastos anuales de electricidad y gas
natural, con lo que su compra se amortiza en pocos meses. Con respecto a los costos de
mantenimiento, stos se consideran mnimos o casi nulos.
Adems de todo esto, no debe dejarse de lado la importancia de la independencia
energtica que brinda la instalacin y uso de celdas de combustible.
Por ltimo, cabe aclarar que las celdas de combustible prometen seguir mejorando en
todos sus aspectos y ampliar cada vez ms el mercado, as lo demuestran las estadsticas.
10.4. Sera el hidrogeno el combustible del futuro?
Mucho se habla de que el hidrgeno ser el combustible del futuro. Que ser una
energa limpia, que los autos tendrn emisiones de vapor de agua solamente, que esa energa nos
llevar ms all de las estrellas y energizar nuestros ciclones. Pero, realmente es tan
maravilloso. Eso es lo que trata de aclarar el cientfico especialista en energas alternativas Chris
Nelder.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 41
Como pequeo dato histrico, el principio de funcionamiento de las celdas de hidrgeno
fue descubierto el ao 1839, pero recin en el ao 1960 se us por primera vez, en unas
misiones espaciales. Y todava se considera como una energa que revolucionar el mundo.
La gran gracia de usar hidrgeno, es que sera un combustible disponible en grandes
cantidades (prcticamente es inagotable, se encuentra en todo el universo; incluso se habla de
prepararlo directamente en casa) y es una energa 100% limpia, ya que no emite gases
contaminantes ni de efecto invernadero. Esto es lo que la hace la favorita de los activistas
ambientales y de un sinnmero de organizaciones ambientales, polticos figuretes, marcas
automotrices. Sin embargo, no todo puede ser tan bonito.
Hay que dejar un par de cosas en claro: primero que nada, el hidrgeno, como elemento
aislado, no existe de manera natural. Sea donde sea, lo vamos a encontrar unido a algn otro
tomo de otro elemento qumico. Adems, el hidrgeno en s no es una fuente de energa, sino
que es un transportador (o almacenador) de la misma. As que, para usar esa energa, primero se
debe utilizar ms energa para liberar los H (hidrgenos)
Una visin resumida y simplista del uso del hidrgeno es la siguiente: El H
2
se libera de
su acompaante, se comprime para almacenar, luego se quema en unas celdas de
combustible, y es de ah de donde sale la energa y el agua, como resultado de la unin de
tomos de oxgeno y de H
2
.
Ya mencion que el H
2
no es una fuente de energa, sino que la lleva almacenada. Entonces, lo
que bsicamente se hace es sacarle la energa, o transformarla. Y segn las leyes de
termodinmica, al transformar energa de un tipo a otra, algo de ella se pierde. Y aqu es donde
se pone econmicamente fea la cosa, ya que, despus de mucho bla bla tcnico, estimaciones y
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 42
porcentajes (lo pueden encontrar en la pgina de referencia), se llega a la conclusin de que
alrededor del 80% de la energa generada para producir el H como combustible es perdida.
Mucho, para los costos que tiene el producir H
2
como combustible, lo que complicara el uso en
vehculos.
Ustedes pensarn pero, y qu pasa con los autos que ya estn usando el H
2
como combustible?,
tienes razn, s hay autos que utilizan este combustible. En 2 ciudades de EEUU, una parte del
transporte pblico utiliza H
2
. Mercedes Benz, Ford, entre otros, tienen prototipos funcionando
con H
2
. BMW fue un paso ms adelante, y puso a la venta el 1er auto de serie que usa H
2
(aunque en realidad fueron slo 500 unidades, era la 1era vez que un auto que funcione con H
2
sala masivamente de una lnea de ensamblaje) Pero sabes cul es el pequeo secreto de
stos vehculos?
El H
2
con que funcionan esos vehculos, no es tan limpio como creen. De donde se
extrae es lo feo, ya que no lo sacan de la hidrlisis del agua (hasta ahora el mtodo ms comn)
sino que lo sacan del gas natural, ya que est prcticamente listo para su transporte y
almacenamiento. Pero durante el proceso de separacin igual se generan emisiones de dixido
de carbono, perdindose el concepto de energa 100% limpia. Esto se hace as, por la cantidad
de energa que requiere la hidrlisis, lo que aumenta considerablemente los costos.
Otro problema es el del almacenaje y transporte. El equipamiento de las industrias
actuales no es compatible con el H, as que se deberan cambiar caeras, vlvulas, bombas,
tambores de almacenaje, etc. Adems, el H es el elemento ms pequeo, entonces escapar por
donde sea.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 43
Por lo mismo, si se quisiera usar el H
2
, habra que empezar desde cero. Cambiar toda
la infraestructura de las refineras, vehculos, kilmetros de caeras, etc. Literalmente, hacer
borrn y cuenta nueva.
El H
2
servira para aplicaciones a menor escala y como almacenamiento de energa. En
ese sentido s es prctico.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 44
11. RESUMEN
Cualquier material que pueda quemarse para liberar energa recibe el nombre de
combustible a la reaccin qumica durante la cual un combustible se oxida y se libera una gran
cantidad de energa se le conoce como combustin. El oxidante empleado con ms frecuencia
en los procesos de combustin es el aire. E l aire seco puede tener aproximadamente, 21% de
oxigeno y 79% de nitrgeno, en nmeros molares por lo tanto:
1Kmol O
2
+ 3,76Kmol N
2
= 4.76Kmol aire
Durante un proceso e combustin, los componentes que existen antes de la reaccin
reciben el nombre de reactivos y los que existen despus de la reaccin se denominan productos.
L as ecuaciones qumicas se balancean con base en el principio de la conservacin de la masa, el
cual establece que la masa total de cada elemento se conserva durante una reaccin qumica La
reaccin entre la masa del aire y la masa de combustible durante un proceso de combustin se
denomina relacin aire-combustible AC:
donde: m
aire
= (NM)
aire
y m
combus
= (N
i
M
i
)
combustible
Un proceso de combustin es completo si todo el carbono en el combustible se
convierte en CO
2
, todo el hidrogeno en H
2
O y todo el azufre (si lo hubiera) en SO
2
. La cantidad
mnima de aire necesaria para combustin competa de un combustible se denomina aire
estequiomtrico o terico. El aire terico tambin se conoce como la cantidad de aire
qumicamente correcta o 100% de aire terico. El proceso de combustin ideal durante el cual
un combustible se quema completamente con aire terico se llama combustin estequiomtrico
o terico de este combustible. El aire remanente de la cantidad estequiomtrica se denomina
exceso e aire. La cantidad de exceso de aire suele expresarse en trminos de aire
estequiomtrico como exceso de aire porcentual o aire terico porcentual. Durante una reaccin
qumica, algunos enlaces qumicos se rompen y otros se forman por ello, un proceso que incluye
reacciones qumicas implicara cambios en la energa qumicas. Debido al cambio en la
composicin, es necesario contar con un estado de referencia estndar para todas las sustancias,
el cual se ha establecido en 25C (77F) y 1atm.
A la diferencia entre la entalpia de los productos en u7n esta especfico y la entalpia de
los reactivos en el mismo estado en una reaccin completa, se le denomina entalpia de reaccin
h
g
. En procesos de combustin, a la entalpia de reaccin se le conoce como entalpia de
combustin h
c
, que representa la cantidad de calor liberado durante el final de proceso de
combustin de flujo establece cuando un 1Kmol (o un Kg) de combustible se quema
completamente a una temperatura y presin especificadas. La entalpia de una sustancia en un
estado especfico debido su composicin qumica recibe el nombre de entalpia de formacin h
f
.
A la entalpia de formacin de todos los elementos estables se le asigna calor 0 en el estado de
referencia estndar de 25C y una atm. El poder calorfico de un combustible se ha definido
como la cantidad de energa liberada cuando un combustible se quema completamente en un
proceso de flujo estable y los productos se regeneran al estado de los reactivos. El poder
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 45
calorfico de un combustible es igual ala valor absoluto de la entalpia de combustin del
combustible:
Poder calorfico = (KJ7 Kg de combustible)
Tomando la trasferencia del calor hacia el sistema y el trabo realizado por el sistema
como cantidades positivas la relacin de conservacin de la energa para sistemas de flujo
estable qumicamente reactivos se expresa por unidad mol de combustible como:
Q W = (
f
0
+ -
0
)
P
(
f
0
+ -
0
)
r
donde el superndice representa propiedades en el estado de referencia estndar de 25
0
C y 1
atm. Para un sistema cerrado, seria
Q W = (
f
0
+ -
0
- P )
P
(
f
0
+ -
0
- P )
r
Los trminos P son insignificantes para slidos u lquidos y pueden sustituirse por R
u
T
para gases que se comportan como gases ideales.
En la ausencia de cualquier prdida de calor hacia los alrededores (Q=0), la temperatura
de los productos alcanzara y un mximo que se denomina temperatura de flama adiabtica de la
reaccin. La temperatura de flama adiabtica de un proceso de combustin de flujo estable se
determina de acuerdo con H
prod
= H
reac
o
(
f
0
+ -
0
)
P
(
f
0
+ -
0
)
r
Tomando la direccin positiva de la transferencia de calor como aquella como aquella
que se dirige al sistema, la relacin de balance de entropa se expresa, para un sistema cerrado i
una cmara de combustin de flujo estable, como
+ S
gen
= S
prod
S
react
Para un proceso adiabtico se reduce a
S
gen adiabtico
= S
produ
S
react
0
La tercera ley de la termodinmica establece que la entropa de una sustancia cristalina
pura a la temperatura del cero absoluto es cero. Ta tercera ley proporciona una base comn para
lea entropa de todas las sustancias, y los valores de entropa relativos a esta base se denominan
entropa absoluta. Las tablas de gases ideales incluyen los valores de entropa absoluta sobre un
amplio intervalo de temperaturas, pero a una presin fija de P
0
= 1 atm. Los valores de entropa
absoluta a otras presiones P para cualquier temperatura T se determinan de:
Para el componente i de una mezcla de gases ideales, esta relacin puede escribirse
como:
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 46
donde P es la presin parcial y
1
es la fraccin molar del componente y P
m
es la presin total de
la mezcla en atmosferas.
La destruccin de exerga y el trabajo reversible asociados con una reaccin qumica se
encuentran a partir de
X
destruida
= W
rev
W
act
= T
0
S
gen
W
rev
= (
f
0
+ -
0
- )
r
(
f
0
+ -
0
- )
p
Cuando los reactivos as como los productos estn a la temperatura de los alrededores
T
0
, el trabajo reversible puede expresarse en trminos de las funciones de Gibbs como
W
rev
= (
f
0
+ -
0
)
r
(
f
0
+ -
0
)
p
PRCTICA DIRIGIDA Combustin
1.- 13.2. (W-R) Se quema 1 kg/min de etileno (C
2
H
4
) con aire seco, en una proporcin
combustible-aire de 1:17 en masa. Supngase combustin completa y una presin total de 95
kPa. Calclese (a) el porcentaje de exceso de aire utilizado, (b) la razn de equivalencia, (c) el
tanto por ciento en volumen de CO
2
, en los gases producto, (d) la temperatura de roco, en
grados Celsius, (e) el tanto por ciento de vapor de agua condensado si se enfran los gases
producto hasta 20
0
C, y (f) el flujo volumtrico de aire seco necesario a 95 kPa y 27
0
C. en
m
3
/min. Si el aire suministrado en la realidad tiene una relacin de humedad de 15 g H
2
O/kg
aire seco, (g) determnese la temperatura de roco de los productos de la reaccin. Rptas: a)
15 b) 0,87 c) 11,5 d) 47,4 e) 80,6 f) 13,1 g) 45
2.- (14.31 C-B) Se quema metano (CH
4
) con aire seco. El anlisis volumtrico de los productos
en base seca es 5,2% de CO
2
, 0,33% de CO, 11,24% de O
2
, y 83,23% de N
2
. Determine: a) La
relacin aire combustible y b) el porcentaje de aire terico utilizado. R: a) 34,5
kga/kgc b) 200%
3.- (14.46 C-B) Durante un proceso de combustin de flujo estable, se quema por completo
metano (CH
4
) con la cantidad de aire estequiomtrica. Si tanto los reactivos como los
productos se mantienen a 25C y 1 atm y el agua en los productos existe en forma lquida,
determine la transferencia de calor para este proceso. Cul sera su respuesta si la
combustin se alcanzara con 100% de exceso de aire?. R: 890 330 KJ/Kmol
4.- 13.37. (W-R) Se quema en rgimen estacionario propano (C
3
H
8
) a 25
0
C con el 100 por 100
de exceso de aire, inicialmente a 25
0
C y L bar. La reaccin es completa y los productos salen a
600 K. Para un flujo volumtrico de aire igual a 20 m
3
/min, determnese (a) el flujo msico de
combustible necesario en kg/min, y (b) el flujo de calor que se necesita transferir, en kJ/min. R:
a) 0,748 b) -26830
5.- (14.52 C-B) Durante un proceso de combustin de flujo estable se quema gas benceno (C
6
H
6
) a 25C con 95% de aire terico, el cual entra en la cmara de combustin a 25C. Todo el
hidrgeno del combustible se convierte en H
2
O, pero parte del carbono se transforma en CO.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 47
Si los productos salen a 1 000 K determine, a) la fraccin molar del CO en los productos y b) la
transferencia de calor en este proceso. R: a) 2.1% b) 2 112 KJ/kmol c
6.- 13.77. (W-R) La entalpa de reaccin de la combustin de la hidracina (N
2
H
4
) con oxgeno en
la reaccin N
2
H
4
(l) + 0
2
(g) N
2
(g) + 2 H
2
O(l) es igual a -624.800 kJ/kmol a 25
0
C. Obtngase la
entalpa de formacin de la hidracina lquida a 25
0
C, en kJ/kmol. R: 53 140
7.- (14.68 C-B) Durante un proceso de combustin de flujo estable se quema gas acetileno (C
2
H
2
) a 25C con 30% de exceso de aire. A 27C. Se observa que la cmara de combustin libera
hacia los alrededores 75 000 KJ/kmol de combustible. Suponga que la combustin es completa
y determine la temperatura de salida de los gases producto. R: 2 301 K.
8.- 13.92. (W-R) Se quema etano (C
2
H
6
) gaseoso con la cantidad estequiomtrica de aire,
inicialmente ambos a 25 C, en un proceso en rgimen estacionado. El agua aparece lquida en
los productos, que se encuentran a 25 C y 1 atm. La temperatura del entorno es de 25 C, la
combustin es completa y el combustible y el aire entran separados, ambos a 1 atm.
Determnese (a) la variacin de entropa de la reaccin, y (b) la generacin de entropa en el
proceso global, en kl/K por kmol de combustible. R: a) -332,1 b) 4 902
9.- 13.122. (W-R) En una pila de combustible entran etileno (C
2
H
4
) y el oxgeno estequio-
mtrico en fase gaseosa, cada uno a 1 atm y 25
0
C, y originan los productos de la reaccin
completa, tambin a 25
0
C. Toda el agua formada en el ctodo sale a 1 atm en estado lquido y
el CO, formado en el nodo sale como gas puro a 1 atm. Obtngase (a) el trabajo mximo
obtenido en el proceso en rgimen estacionario, en kJ/kmol de combustible, (b) el rendimiento
ideal de la pila, y (c) la fuerza electromotriz ideal. R: a) 1 331 100 b) 0,943 c) 1,15
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 48
12. BIBLIOGRAFIA Y REFERENCIAS
Termodinmica (Yunus Cengel /Michael Boles, 6ta Edicion)
o Combustin
o Anlisis de primera y segunda ley
o Flama adiabtica
o Tablas Termodinmicas
Termodinmica (Faires/Simmang, 6ta Edicion)
o Combustin
o Entalpia de formacin y de combustin
o Anlisis de primera ley
o Cambio de entropa
Principio de Termodinmica para Ingenieros (Howell/Buckius)
o Combustin
o Entalpia
o Entropa
Termodinmica (Warks/Richards 6ta Edicin)
o Ejemplos de combustin
o Ejemplos de aire-combustible
o Ejemplos de anlisis de primera ley
o Ejemplos de anlisis de segunda ley
Fundamentos de Combustin (Strehlow)
o Combustin
www.eco2site.com/informes/celda.asp
o Celdas de Combustible
www.tecnociencia.es/especiales/.../descripcion.htm
o Celdas de combustible
es.wikipedia.org/wiki/Exerg%C3%Ada
o Exergia
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 49
13. PROBLEMAS VARIOS
P.1 [15.15. (Y. Cengel)] Durante un proceso de combustin se quema etileno (C
2
H
4
) con aire
estequiomtrico. Suponga una combustin completa y determine la relacin aire-combustible
por unidad de masa y por unidad molar.
Asumiendo: 1 combustin completa. 2 Los productos de la combustin son CO
2
, H
2
O y N
2
solo.
Propiedades: Masa molar de C, H
2
y aire son 12Kg/Kmol, 2Kg/Kmol y 29Kg/Kmol (28.97)
respectivamente.
La ecuacin de combustin estequiometria del acetileno es:
Balanceando La ecuacin:
Sustituyendo en la ecuacin:
Luego: La relacin A-C por unidad de masa ser.
La relacin aire combustible por unidad molar ser:
P.2 [15.22. (Y. Cengel)] Se quema octano (C
8
H
18
) con 250 por ciento de aire terico, el cual
entra a la cmara de combustin a 25C. Suponga una combustin completa y6 una presin total
de 1 atm, y determine: a) La relacin de aire combustible y b) La temperatura del punto de roco
de los productos.
Asumiendo: 1 combustin completa. 2 Los productos de la combustin son CO
2
, H
2
O y N
2
solo.
Propiedades: Masa molar de C, H
2
y aire son 12Kg/Kmol,
2Kg/Kmol y 29Kg/Kmol (28.97) respectivamente.
Analizando la ecuacin de la combustin.
Del balanceo:
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 50
Sustituyendo en la ecuacin tenemos:
Entonces:
a) La relacin aire combustible ser:
b) La temperatura del punto de roco en los productos
Luego:
P.3 [15.27 (Y. Cengel)] Cierto gas natural tiene el siguiente anlisis volumtrico: 65 por ciento
de CH
4
, 8 por ciento de H
2
, 18 por ciento de N
2
, 3 por ciento de O
2
y 6 por ciento de CO
2
.
Despus este gas se quema por completo con la cantidad estequiomtrica de aire seco. Cul es
la razn aire-combustible para este proceso de combustin?
Suposiciones: 1. Combustion completa 2. Productos de combustin contiene CO
2,
H
2
O y N
2
Propiedades: Masa molar de C, H
2
, N
2
, O
2
y aire son 12 kg/kmol, 2 kg/kmol, 28 kg/kmol, 32
kg/kmol y 29 kg/kmol respectivamente.
Anlisis: Considerando 1 kmol de combustible, la ecuacin de combustin puede quedar
determinada como:
(0.65 CH
4
+ 0.08 H
2
+ 0.18N
2
+ 0.03O
2
+ 0.06CO
2
) + a
th
(O
2
+ 3.76N
2
) x CO
2
+ y H
2
O + z N
2
Los coeficientes en la anterior ecuacin se determinan del balanceo de masas:
C: 0.65 + 0.06 = x x = 0.71
H: 0.65x4 + 0.08x2 = 2y y = 1.38
O
2
: 0.03 + 0.06 + a
th
= x + y/2 a
th
= 1.31
N
2
: 0.18 + 3.76 a
th
= z z = 5.106
Resulta:
(0.65 CH
4
+ 0.08 H
2
+ 0.18N
2
+ 0.03O
2
+ 0.06CO
2
) + 1.31(O
2
+ 3.76N
2
)
0.71 CO
2
+ 1.38H
2
O + 5.106N
2
La relacin Aire-Combustible se determina, teniendo la masa de aire y la masa de combustible:
m
aire
= (1.31x4.76 kmol)(29 kg/kmol) = 180.8kg
m
comb.
= (0.65x16 + 0.08x2 + 0.18x28 +0.03x32 + 0.06x44)kg = 19.2kg
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 51
ACth = = = 9.42 kg aire/kg comb.
P.4 [15.42 (Y. Cengel)] Determine la entalpa de combustin del metano (CH
4
) a 25C y 1atm,
utilice los datos de entalpia de formacin de las tablas. Suponga que el agua en los productos
estn en forma lquida.
Asumiendo: El agua en los productos esta en forma lquida.
Anlisis: La ecuacin estequiomtrica de la reaccin es:
Luego, debido a que los reactantes y los productos se encuentran a una referencia estndar a
estados de 25C y 1 atm y a su vez el N
2
y O
2
son elementos estables. Entonces sus entalpias
de formacin son cero.
Luego la entalpia de de combustin del metano (CH
4
)
Entonces:
P.5 [15.50 (Y. Cengel)] Durante un proceso de combustin de flujo estable se quema hidrogeno
(H
2
) por completo con la cantidad estequiometrica de aire. Si tanto los reactivos como los
productos se mantienen a 25
o
C y 1atm. Y el agua en los productos existe en la forma lquida,
determine la transferencia de calor para este proceso. Cul sera su respuesta si la combustin
se alcanzara con 50 por ciento de exceso de aire?
Suposiciones: 1. Opera en condiciones estable. 2. Aire y gases de combustin son idelaes. 3
Energia cinetica y potencial son nulas 4. Combustion completa
Anlisis: El H
2
es quemado completamente con la cantidad estequimoetrica de aire, as los
productos contendrn H
2
O y N
2
, pero no oxigeno. Considerando 1 kmol de H
2
, la ecuacin de
combustin teorica ser:
H
2
+ a
th
(O
2
+ 3.76N
2
) H
2
O + 3.76 a
th
N
2
Donde a
th
se determina del balanceo de O
2
, entonces a
th
= 0.5
H
2
+ 0.5(O
2
+ 3.76N
2
) H
2
O + 1.88 N
2
La transferencia trmica de la combustin se determina por el balance de energa E
ent
.E
sal
=E
sist
. En la cmara de combustin se tiene W = O Entonces se reduce a:
-Q
sal
= Np( )
p
- Nr( )
R
=
N
p
h
f,P
- N
R
h
f,R
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 52
Como reactivos y productos se encuentran a 25
o
C, entonces pueden ser considerados como
gases ideales. De tablas:
Sustancia (kJ/kmol)
H
2
0
O
2
0
N
2
0
H
2
O (l) -285,830
Sustituyendo:
-Q
sal
= (1)(-285,830)+ 0 0 0 0 = -285,830 kJ/kmol H
2
Q
sal
= 285,830 kJ/kmol H
2
Si la combustin se da con 50% de exceso de aire, la respuesta ser la misma pues se est dando
a 25C y no hay flujo de energa.
P.6 [15.53 (Y. Cengel)] Durante un proceso de combustin de flujo estable se quema gas
acetileno (C
2
H
2
) por completo con 20% de exceso de aire. El combustible y el aire entran a la
cmara de combustin a 25C y los productos salen a 1500K. Determine a) La relacin aire
combustible AC y b) La transferencia de calor en este proceso.
Propiedades: La masa molar del C
2
H
2
y del aire son 26Kg/Kmol y 29Kg/Kmol
respectivamente.
Anlisis: La combustin es completa con un exceso de aire 20% entonces la ecuacin ser.
Balanceando la ecuacin tenemos:
Entonces:
a) Entonces la relacin aire combustible ser:
b) El calor transferido por este proceso de combustin es determinado del balance de
energa.
Tambin todos los reactantes estn a 25C Asumiendo el aire y la combustin en los
productos son gases entonces de las tablas tenemos:
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 53
Sustancia
kJ/kmol
kJ/kmol
kJ/kmol
C
2
H
2
226730 ---- ----
O
2
0 8682 49292
N
2
0 8669 47073
H
2
O
(g)
-241820 9904 57999
CO
2
-393520 9364 71078
Luego:
P.7 [15.63 (Y. Cengel)] Una camra de combustin cerradase disea de modo que mantenga una
presin constante de 300kPa durante un proceso de combustin. La cmara de combustin tiene
volumen inicial de 0.5m
3
y contiene una mezcla estequiometrica de gas octano (C
8
H
18
) y aire a
25C. La mezcla se enciendedespues y se observa que los gases producto estaa 1000k al final
del proceso de combustin. Suponga una combustin completa y trate los reactivos y los
productos como si fueran gases idelaes, para determinar la transferenciade calor de la cmara
durante este proceso.
Suposiciones: 1. Reactantes y productos son gases ideales. 2. Combustion completa
Anlisis: La ecuacin teorica de combustin del C
8
H
18
con cantidad estequiometrica de aire es:
C
8
H
18
+ a
th
(O
2
+ 3.76N
2
) 8CO
2
+ 9 H
2
O + 3.76 a
th
N
2
Donde a
th
es el coeficiente estequiometrico y es determinado por el balanceo del oxigeno:
a
th
= 8 + 4.5 = 12.5
Entonces: C
8
H
18
+ 12.5(O
2
+ 3.76N
2
) 8CO
2
+ 9 H
2
O + 47 N
2
La transferencia trmica de la combustin se determina por el balance de energa E
ent
.E
sal
=
E
sist
. En la cmara de combustin se tiene W = O Entonces se reduce a:
-Q
sal
= Np( )
p
- Nr( )
R
Para una presin constante, el proceso es cuasiequilibrado U + Wb = H
Entonces la primera laey de relacin en este caso es:
-Q
sal
= Np( )
p
- N
R
Desde los reactants estan a la temperature de 25
o
C. Entonces reactantes y productos trabajaran
como gases ideales, tendremo h= h(T). De tablas:
Sutancias (kJ/kmol) (kJ/kmol) (kJ/kmol)
C
8
H
18
-208,450 --- ---
O
2
0 8682 31,389
N
2
0 8669 30,129
H
2
O -241,820 9904 35,882
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 54
CO
2
-393,520 9364 42,769
Entonces:
-Q
sal
= (8)(-393,520 + 42,769 - 9364) + (9)(-241,820 + 35,882 - 9904) + (47)(0 + 30,129 - 8669)
(1)(-208,450) 0 0
-Q
sal
= - 3,606,428 kJ (por kmol de C
8
H
18
) Q
sal
= 3,606,428 kJ (por kmol de C
8
H
18
)
Total nmero de moles presentes inicialmente en la cmara de combustin se da por la relacin
de gases ideales:
N
1
=
De esto, 0.06054/(1+ 12.5x4.76)= 1.001x10
-3
kmol del total es C
8
H
18
La cantidad de calor
transferido de la cmara de combustin como 1.001x10
-3
kmol de C
8
H
18
es quemado es:
Q
sal
= (1.001x10
-3
kmol C
8
H
18
)(3,606,428 kJ/kmol C
8
H
18
) = 3610 kJ
P.8 [15.82 (Y. Cengel)] En una cmara de combustin de flujo estable entra octano liquido
(C
8
H
18
) a 25C y 1atm, a una tasa de 0.25Kg/min. Se quema con 50 por ciento de exceso de aire
que tambin entra a 25C y 1 atm. Luego de la combustin, se deja que los productos se enfren
hasta 25C. Suponga que la combustin es completa y que todo el agua en los productos esta en
forma lquida, y determine. a) La tasa de transferencia de calor de la cmara de combustin, b)
La tasa de generacin de entropa, c) La tasa de destruccin de exergia. Suponga que T
o
=298K y
que los productos salen de la cmara de combustin a una presin de 1atm.
Anlisis: Ecuacin de la combustin del octano
Desarrollando la ecuacin tenemos:
Entonces:
a) El calor transferido por este proceso de combustin es determinado del balance de
energa
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 55
Tambin todos los reactantes estn a 25C Asumiendo el aire y la combustin en los productos
son gases entonces de las tablas tenemos:
Sustancia
kJ/kmol
C
8
H
18(l)
-249950
O
2
0
N
2
0
H
2
O
(l)
-285830
CO
2
-393520
Sustituyendo:
Luego sabemos que ingresa una tasa de 25Kg/min de octano entonces:
Entonces:
b) La entropa de generacin en este proceso est determinado por:
El C
8
H
18
est a 25C y 1atm entonces
Los valores de las entropas de generacin son revisados por tablas y estn a una presin de
1atm, pero las entropas son calculados por:
El clculo de la entropa lo representamos por tablas
Sustancia Ni yi (T,1 atm) Ni
C
8
H
18
1 1.00 360.79 ---- 360.79
O
2
18.75 0.21 205.14 -12.98 4089.75
N
2
70.50 0.79 191.61 -1.96 13646.69
s
r
= 18097.23 kJ/K
CO
2
8 0.0944 213.80 -19.62 1867.3
H
2
O
(l)
9 ----- 69.92 ---- 629.3
O
2
6.25 0.0737 205.04 -21.68 1417.6
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 56
N
2
70.50 0.8319 191.61 -1.53 13616.3
s
p
= 17531 kJ/K
Luego:
c) La energa de destruccin esta dado por:
P.9 [15.84 (Y. Cengel)] A una cmara de combustin de flujo estable se le suministra gas CO a
37C y 110kPa a una tasa de 0.4 m
3
/min. y aire a 25C y 110kPa a una tasa de 1.5kg/min. Se
transfiere calor a un medio a 800K, y los productos de combustin salen de la cmara a 900K.
Suponga que la combustin es completa y T
o
= 25C y determine, a) la tasa de trasferencia de
calor de la cmara de combustin b) la tasa de destruccin de exerga.
Suposiciones: 1. Combustion completa 2. Opera a condiciones estables. 3. Aire y gases de
combustin son ideales. 4. Energia cinetica y potencial son nulas
Propiedades: La masa molar de CO y aire son 28 kg/kmol y 29 kg/kmol respectivamente.
Analisis: (a) Primero necesitamos hallar la cantidad de aire usada por kmol de CO, antes
podemos escribir la ecuacin de combustin
co =
- 0.836 m
3
/kg
co
= co = = 0.478 kg/min
La relacion de Aire-Combustible sera:
Entonces el numero de moles de O
2
usado por mol de CO es 3.03/4.76 = 0.637. Entonces la
ecuacin de combustin ser:
CO + 0.637(O
2
+ 3.76N
2
) CO
2
+ 0.137O
2
+ 2.4N
2
Bajo condiciones de flujo estable el balance de energa se da por E
ent
.E
sal
= E
sist
. En la cmara
de combustin se tiene W = O Entonces se reduce a:
-Q
sal
= Np( )
p
- Nr( )
R
Asumiendo que el aire y los gases resultantes sern ideales, tenemos h= h(p). De tablas.
Sutancias (kJ/kmol) (kJ/kmol) (kJ/kmol) (kJ/kmol)
CO 110,530 8669 9014 ----
O
2
0 8682 ---- 27,928
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 57
N
2
0 8669 26,890
CO
2
-393,520 9364 ---- 37,405
Ssutituyendo:
-Q
sal
= (1)(-393,520 + 37,405 + 9364) + (0.137)(0 + 27,928 - 8682) + (2.4)(0 + 26,890 - 8669)-
(1)(-110,530 + 9014 - 8669) 0 - 0 + 208,929 kJ/kmol de CO
As 208,929 kJ de calor ser tranferido de la cmara de combustin por cada kmol de CO. Esto
corresponde a 208,929/28 = 7462kJ de calor transferido por kg de CO. Entonces el promedio de
calor transferido para el flujo de masa de 0.478 kg/min para CO viene de:
= (0.478kg/min)(7462 kJ/kg) = 3567 kJ/min
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 58
14. PROBLEMAS DOMICILIARIOS
1. Empleando los datos de la entalpia de formacin de la tabla A12, calcule la entalpia de
combustin del metano (CH4), del etano (C
2
H
6
), del propano (C
3
H
8
) y del butano (C
4
H
10
).
2. Halle la entalpia estndar de combustin de a) H
2
, b) CO y c) C
2
H
5
OH.
3. Un mol de metano reacciona estequiomtricamente con aire en un recipiente adiabtico y a
volumen constante. Si los reactivos se encuentran inicialmente a 27 C y 1 atm, cul es la
temperatura final que se alcanza en el recipiente?
4. Un mol de metano reacciona estequiomtricamente con aire en un recipiente adiabtico y a
volumen constante. Si los reactivos se encuentran inicialmente a 17 C y 1 atm, cul es la
temperatura final que se alcanza en el recipiente? (Con frecuencia a la temperatura que se
calcula para un proceso a volumen constante se le llama temperatura de explosin del gas.)
5. El combustible vendido por una estacin de servicio efectivamente contiene 30% de alcohol
etlico (C
2
H
5
OH) y 70% de octano (C
g
Hj
8
) en volumen. Calcule la entalpia de combustin
de esta mezcla, considerando que inicialmente se encuentra en forma gaseosa y que todos
los productos de combustin son tambin gaseosos.
6. En la reaccin:
CaCO3 + 2HCl CaCl2 + CO2 + H2O.
(a) Cuntos gramos de carbonato de calcio se requieren para producir 1700 cm3 de bixido
de carbono a 780 mm de Hg y 17 C?. (b) Si se desprenden 360 cm3 de bixido de carbono
a 754 mm de Hg y 20 C, qu cantidad de gramos de carbonato de calcio fueron sujetos a
la reaccin?
7. Un recipiente cerrado hermticamente y cuyo volumen es de 5 m
3
, contiene CH
4
a 25C y 1
atm. Dentro del recipiente cerrado se bombea 1.75 m
3
de O
2
medido a 17C y 1 atm.
Supngase que la reaccin es total. Cul es el porcentaje de oxigeno y cul ser la
temperatura final del recipiente cerrado.
Camara de
Combustion
Productos
Secos
Aire
CH
4
Camara de
Combustion
Productos
Secos
Aire
CH
4
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 59
8. Encuentre la temperatura terica de flama adiabtica para el butano.
9. Encuentre la temperatura de los productos de combustin del butano cuando ste se quema
en un quemador adiabtico, con flujo estable, a 1 atm y con 55% de exceso de aire
precalentado a 250C.
10. Para evaporar agua saturada a 150 kPa, se emplea un homo alimentado con gas natural. El
gas natural tiene una rapidez de flujo volumtrico de 45 m/s y se quema con 15% de exceso
de aire. El aire y el gas entran al horno a 25 C y 1 atm. Si los gases de combustin deben
salir del horno a una temperatura superior a 500 C, cul es la rapidez del flujo del agua, en
kilogramos por segundo, que puede ser evaporada en este horno? (Considere el gas natural
con las mismas propiedades que el propano.)
11. Un calentador de agua en una granja emplea butano para calentar el agua. El butano se
quema con 50% de exceso de aire y tanto el aire como el butano entran al quemador del
calentador a 25C y 1 atm. Los gases de escape salen del calentador a 160C. Si la rapidez
mxima del flujo al quemador, cuando ste funciona continuamente, es igual a 0.005 m
3
/s,
cunta agua, en kilogramos por segundo, se puede calentar de 20 a 75
8
C?
12. Grafique la generacin de entropa por mol de combustible contra la temperatura, cuando el
monxido de carbono se quema adiabticamente con las cantidades estequiomtricas de
aire. Emplee temperaturas desde 800 hasta 2500C. Los reactivos entran a 25C y 1 atm.
Qu concluye de esta grfica?
13. Calcule el trabajo reversible por mol de combustible que se obtiene de la combustin de
monxido de carbono con el aire estequiomtrico, cuando los productos de combustin
salen a 360C y los reactivos entran a 25C y 1 atm. La temperatura de los alrededores es de
25C.
14. Un combustible A para aviones tiene una entalpa de formacin de -22570 kJ/kmol y una
frmula qumica equivalente a CH
4
. En el quemador de la turbina de un avin, el
combustible A se quema con 10% de exceso de aire. El aire entra a la cmara de
combustin a 1 atm y 8C, en tanto que el combustible lo hace a su estado estndar de
referencia y es gaseoso. Cul es la temperatura del gas que sale del quemador?
15. Se puede gasificar el carbn calentndolo y mezclndolo con vapor de agua mediante la
reaccin de desplazamiento del gas de agua C + H
2
O CO + H
2
. El gas de agua resultante
(CO + H
2
) se vende en muchas ciudades como gas para iluminacin. Considerando que el
gas de agua tiene volmenes iguales de CO y H
2
, a) Encuentre el valor calorfico superior
del gas de agua. b) Encuentre la temperatura de flama adiabtica del gas de agua cuando se
le quema con el aire estequiomtrico.
16. Se propone un transporte supersnico avanzado cuya meta es una eficiencia de la mquina
de 65%. La relacin de presiones en la turbina corresponde a 8 y la relacin empuje a peso
es 4.0. La temperatura de entrada a la turbina de este diseo es de 1560C. Considerando
que se emplea el combustible A para aviones (CH
4
), cul es el exceso de aire requerido
para obtener la temperatura deseada? Suponga que el combustible a la entrada es gaseoso y
se encuentra en el estado de referencia y que el aire entra a 15 C y 1 atm.
17. Se propone un transporte supersnico avanzado cuya meta es una eficiencia de la mquina
de 55%. La relacin de presiones en la turbina corresponde a 20 y la relacin empuje a peso
es 8.0. La temperatura de entrada a la turbina de este diseo es de 2800C. Considerando
que se emplea el combustible A para aviones (CH
4
), cul es el exceso de aire requerido
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 60
para obtener la temperatura deseada? Suponga que el combustible a la entrada es gaseoso y
se encuentra en el estado de referencia y que el aire entra a 25 C y 1 atm.
18. Se quema hidrgeno gaseoso con 20% de exceso de aire en un quemador adiabtico. Tanto
el hidrgeno como el aire entran a las condiciones estndar de referencia. Cul es el punto
de roco de los productos de combustin?
19. Se quema butano con 30% de exceso de aire en un horno adiabtico. El aire de combustin
se precalienta en un intercambiador de calor (pre calentador de aire) mediante el calor
transferido por los productos de combustin. La temperatura de los productos de
combustin se reduce a T en el pre calentador. El aire entra al pre calentador a ser la
temperatura de los productos de combustin a la salida del pre calentador? (El butano entra
al horno en las condiciones estndar de referencia.)
20. Se quema propano con 5% de deficit de aire en un horno adiabtico. El aire de combustin
se precalienta en un intercambiador de calor (precalentador de aire) mediante el calor
transferido por los productos de combustin. La temperatura de los productos de
combustin se reduce a T en el precalentador. El aire entra al precalentador a ser la
temperatura de los productos de combustin a la salida del precalentador? (El propano entra
al horno en las condiciones estndar de referencia.) Comente el efecto de la presencia del
precalentamiento en su resultado. Cmo se encontrara la temperatura T del aire que sale
del precalentador?
Precalentador
Aire
25 C
Butano
25 C
Camara de
Combustion
Productos de
Combustion
T
T
s
Precalentador
Aire
?? C
Propano
?? C
Camara de
Combustion
Productos de
Combustion
T
T
s
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 61
CAP II: COMPRESIN-EXPANSIN DE GASES
2.1 INTRODUCCIN
El aire comprimido es una de las formas de energa ms antiguas que conoce el hombre y lo
aprovecha para reforzar sus recursos fsicos. Lo us el griego KETESIBIOS hace ms de 2 100
aos en una catapulta de aire comprimido. Uno de los primeros libros acerca del empleo del
aire comprimido como energa procede del siglo I de nuestra era y describe mecanismos
accionados por medio de aire caliente. De los antiguos griegos procede la expresin Pneuma,
respiracin, viento, luego Neumtica, que se ha desarrollado sistemticamente desde 1950. En
la actualidad no se concibe una moderna explotacin industrial sin aire comprimido, sobre
todo en automatizacin.
Los requerimientos de gases a presiones superiores (comprimido) e inferiores (vaco) a la
atmosfrica son muy frecuentes en ingeniera. La operacin de mquinas usa la compresin
y/o expansin en sus procesos de trabajo, como sabemos en compresores, motores de
combustin interna, turbinas, etc. La compresin forma parte Integrante de los ciclos de
refrigeracin, y licuefaccin de gases como veremos ms adelanta. Juega un rol muy
Importante en la Industria mecnica, qumica, de alimentos, en ingeniera civil y en la minera,
las herramientas neumticas son indispensables por su seguridad, simplicidad y compa-
rativamente bajo peso.
Por otro lado se requieren presiones absolutas bajas y en algunos casos extremadamente bajas
en la liofilizacin y secado por vaco, en la fundicin al vaco de metales, preservacin de
alimentos, etc.
La optimizacin y desarrollo de mejores mtodos y tcnicas ms econmicas de compresin y
expansin de gases requiere el conocimiento de la teora del proceso, el funcionamiento de las
mquinas con las que se efecta estos cambios de presin y sobre todo la automatizacin y el
control.
En este captulo nos ocuparemos de los procesos de compresin de gases que se efectan en
mquinas denominadas compresores los que emplean la energa mecnica entregada en
aumentar la presin de un gas, principalmente aire.
CLASIFICACIN DE LOS COMPRESORES
a) De desplazamiento Positivo
- De pistn: alternativo
- Rotatorios: De engranajes (tornillo asimtrico), helicoidales, paletas, etc.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 62
b) Dinmicos
- Centrfugos
- Axiales
- Mixtos
2.2 PROCESOS DE COMPRESION DE GASES
Durante estos procesos, la sustancia est en la fase gas y con frecuencia, para los estados
comprendidos en el proceso, el factor de compresibilidad z tiene un valor tendiente a 1:
Z1
Lo cual implica que: RT pv , por lo que:
Para volumen de control ) T Cp(T h
1 2
Para sistema ) T Cv(T u
1 2
Dependiendo del tipo de compresor. El flujo de gas aspirado para la compresin puede ser
continuo (compresores axiales, centrfugos, etc.); en los intermitente (compresores de
desplazamiento positivo tales como los reciprocantes, de paletos deslizantes, etc.); en las
primeros las caractersticas del proceso pueden Identificarse con las de un proceso de Flujo y
Estado Estables (FEES) con un ingreso y una salida y por lo tanto analizados por la primera ley:
) h (h m W Q
1 2
1 2
h h w q
Considerando que los cambios de ec y ep, entre el ingreso y la salida. Son nulos o
despreciables, el trabajo correspondiente FEES ser:
2
1
2 - 1
vdp w
En los compresores de desplazamiento positivo, el anlisis podra efectuarse mediante un
sistema que abarque la masa admitida en cada perodo de aspiracin y por lo tanto analizada
mediante:
1 2
1 2
U U Q
u u w q
W
Recordando que el trabajo de un sistema es:
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 63
2
1
2 - 1
pdv w
Sin embargo mediante el artificio de considerar un flujo promedio que ingrese durante todo el
tiempo en el mismo estado, y salga continuamente simulamos un proceso de FEES, en un V.C.
Para poder hacer un anlisis comn de los procesos de compresin recurriremos a este
artificio siendo los resultados los mismos desde el punto de vista cuantitativo como
verificaremos ms adelante en el caso concreto de los compresores reciprocantes.
PROCESO DE COMPRESION POLITROPICO
Lo analizaremos bajo los siguientes supuestos:
FEES:
h1 h2 w q (2.1.)
RT pv 1; z (2.2.)
C pv
n
(2.3.)
1 n
n
1 n
v2
v1
p1
p2
T1
T2
(2.4.)
TRABAJO: dado que el proceso se considera de FEES:
2
1
vdp w
n
1
n
p
C
v C pv
dp P C w
2
1
n
1
n
1
n
n
p p C
w
n
n
n
n
n
1
1
1
1
2
1
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 64
Reemplazando
n
2 2
n
1 1
v p v p C
1 n
) .p v p p . v n(p
w
n
1 n
1
n
1 1
n
1 n
2
n
2 2
Efectuando el producto de potencias de Igual base:
1 - n
) v p v n(p
w
1 1 2 2
(2.5.)
Reemplazando pv = RT obtenemos una segunda expresin:
1 - n
) T - nR(T
w
1 2
(2.6.)
Dado que son las presiones desde y hasta la cual se comprime, las propiedades de mayor
Importancia en el proceso de compresin, deduciremos una expresin que nos permita
calcular el trabajo en funcin de la relacin de estas presiones.
A partir de la expresin (2.6)
1 - n
1) /T (T nRT
w
1 2 1
De la relacin (4):
n
1 n
1
2
1
2
p
p
T
T
1
1
1
1
2 1
n
n
p
p
n
nRT
w
(2.7.)
NOTA: El clculo del trabajo de compresin a partir de una cualquiera de estas expresiones nos
dar un valor positivo pues aumenta la energa del V.C.
Algunos autores designan con W
c
el trabajo de compresin es decir, el valor absoluto del
trabajo efectuado.
POTENCIA: La potencia es determinada como el producto de la masa aspirada por unidad de
tiempo, por el trabajo efectuado por o sobre la sustancie de trabajo:
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 65
w m W
As, por ejemplo, a partir de la expresin (2.7.)
1
p
p
1 - n
RT m n
n
1 n
1
2 1
W
(2.8.)
O reemplazando: RT m V p 1
1
En donde 1 V representa el flujo volumtrico al compresor o volumen aspirado por unidad de
tiempo.
1
p
p
1 - n
V p n
n
1 n
1
2 1 1
W
(2.9.)
Donde:
W : Potencia en Kw.
2 1
p y p : Presiones en kPa
1 V : Volumen -aspirado por unidad de tiempo en m
3
/s
n
: ndice o exponente politrpico cuyo valor
depende del proceso, generalmente n= 0,35
2 1
T y T : Temperaturas, en K
CAMBIO DE ENTALPIA
Considerando que z = 1, el cambio de entalpa del gas se calcula por:
) T Cp(T h
1 2
(2.10.)
CALOR TRANSFERIDO: El calor transferido depende del proceso. Es decir del valor que, se
podr calcular a partir de (2.1.)
1 2
h h w q
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 66
Usando para el trabajo w la expresin (2.6) y para el cambio de entalpa
1 2
h h , expresin
(2.10.):
) T Cp(T
1 - n
) T nR(T
q
1 2
1 2
) T (T Cp
1 - n
nR
q
1 2
Donde:
cv k Cv Cp R
-1
) T (T
1 - n
n) (k c
q
1 2
v
(2.11.)
El calor transferido por unidad de tiempo:
q m Q (2.12)
En donde:
Q : Calor por unidad de tiempo en KJ/s
m : Masa aspirada por unidad de tiempo en Kg./s
q : Calor transferido por unidad de masa en KJ/Kg. Interprtese que q es el calor
transferido al o por el gas durante el proceso de compresin, esto es:
0 q : Calor transferido por el gas al sistema de enfriamiento del compresor
0 q : Proceso de compresin adiabtico
0 q : Calor transferido al gas (o recibido por el gas> durante el proceso de
compresin.
PROCESO ISOENTROPICO
Exponente politrpico n = k
Importancia: Proceso de comparacin de los compresores en los que la transferencia de calor
al exterior es nula o despreciable:
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 67
Fig. 2.2. Proceso de compresin isoentrpica.
Trabajo: anotamos slo las expresiones ms usadas por cuanto se obtendr
reemplazando en. Cualquiera de las expresiones anteriores, n = K:
De (2.7.)
1)
p
p
(
1 - k
kRT
w
k
1 k
1
2 1
k (2.13.)
De (2.6.)
) T (T
1 - k
kRT
w
1 2 k
Dado que:
1 k
kR
Cp
) T Cp(T w
1 2
Es decir: ) h (h w
1 2
Lo cual se verifica en (2.1):
1 2
h h w q
Recordamos que si el proceso es adiabtico: q = 0
PROCESO ISOTERMICO
Exponente politrpico: n = 1
Importancia: proceso de comparacin de los compresores lentos y con un sistema de
refrigeracin bastante capaz.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 68
Fig. 2.3. Proceso isotrmico de compresin
Trabajo: si reemplazamos n = 1 en las expresiones obtenidas para el proceso politrpico,
tendremos el problema de Indeterminacin y debera procederse a levantar la
Indeterminacin; sin embargo, preferimos obtener el trabajo a partir de:
2
1
vdp w
Donde:
p
c
v c pv
2
1
p
dp
c w
p1
p
Ln c w
2
Donde
2 1 2 2 1 1
RT RT v p v p c
Calor; de (2.1.)
1 2
h h w q
Siendo el proceso isotrmico
1 2 1 2
h h T T
1
2
p
p
Ln C w q
) /p Ln(p C w wt
1 2
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 69
EFICIENCIA ISOENTRPICA: Se denomina as a la comparacin entre el trabajo
requerido para efectuar una compresin isoentrpica desde un estado inicial hasta una
presin final y el trabajo requerido para la misma compresin en un compresor politrpico
cualquiera.
La eficiencia isoentrpica toma, arbitrariamente, como patrn de comparacin, el proceso de
compresin isoentrpico n = k.
c
k
k
w
w
Donde:
k
= eficiencia isoentrpica
w
k
. = trabajo de compresin isoentrpico
1 2
k
1 k
1
2 1
k
T T
1 k
kR
1
p
p
1 k
kRT
w
Wc = trabajo de compresin politrpico
1
p1
p2
1 n
nRT1
wc
n
1 n
Fig. 2.4 Eficiencia isoentrpica.
De la Fig. 2.4, se desprende que la eficiencia Isoentrpica se puede interpretar como la
comparacin, en el plano pv, de las reas a la izquierda de 12 y 12.
EFICIENCIA ISOENTRPICA DE UN COMPRESOR ADIABTICO.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 70
En muchos casos el compresor que hay que evaluar mediante la eficiencia isoentrpica es un
compresor adiabtico, es decir que el calor transferido por el gas durante la compresin es
nulo o despreciable, sin embargo el proceso no es isoentrpico debido a las irreversibilidades
del proceso, es decir n k y n
k
<100%.
La particularidad de los procesos de compresin adiabticos es que, siendo en ellos q = O el
trabajo de compresin es, en ambos, igual al cambio de entalpa ocurrido.
h w q
0 q pero q - h w
h wc
) T Cp(T wc
1 2i
O siendo
k
1 K
p1
p2
T1 T2i (proceso isoentrpico)
1 2
1 2i
k
T T
T T
EFICIENCIA ISOTERMICA:
Ya dijimos que la importancia de estudiar el proceso isotrmico era el que ste serva como
proceso de comparacin de los compresores lentos y con un sistema de refrigeracin de gran
capacidad, es decir que podan transferir al exterior tanto calor como para mantener la
temperatura del gas constante o aproximadamente constante durante la compresin. Bien,
pues esta comparacin se da en trminos de la eficiencia isotrmica que es la comparacin
entre el trabajo de compresin correspondiente a la compresin isotrmica entre un estado
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 71
inicial y una cierta presin final y el trabajo correspondiente al proceso de compresin real de
un determinado compresor entre los mismos estados inicial y presin final.
Fig. 2.5. Eficiencia isotrmica
wc
wt
T
,
2 - 1
2t - 1
T
w
w
COMPRESIN POR ETAPAS
Segn lo visto anteriormente, el trabajo de compresin es mnimo cuando el proceso se
efecta en forma tal que, durante l, se mantiene la temperatura constante. Por otra parte
en un compresor real el proceso de compresin es, en general, politrpico (n>1) y por lo
tanto el trabajo a efectuarse, mayor.
Una de las formas de disminuir la magnitud del trabajo necesario para un proceso de
compresin consiste en efectuarlo por etapas con refrigeracin intermedia entre una y otra
etapa. As en el caso de que la refrigeracin entre dos etapas consecutivas permita enfriar el
gas hasta la temperatura de inicio del proceso, el trabajo tendera al que corresponde al
proceso isotrmico a medida que el nmero de etapas empleado tienda al infinito, como se
muestra en los diagramas.
Planta de compresin en tres etapas con dos enfriadores intermedios
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 72
Fig. 2.6. Compresin por etapas con refrigeracin intermedia.
COMPRESIN EN DOS ETAPAS
Los criterios aqu desarrollados son vlidos tanto para una compresin total que se efecta en
dos etapas con refrigeracin Intermedia como para dos etapas consecutivas, cualesquiera, de
una compresin en mltiples etapas con enfriamiento intermedio.
CONDICIN DE TRABAJO MNIMO
En el esquema se muestra un proceso de compresin en dos etapas con refrigeracin
intermedia, en el supuesto de que dicha refrigeracin intermedia sea capaz de enfriar el
gas parcialmente comprimido,
hasta la temperatura inicial.
Fig. 2.7. Compresin en
dos etapas con
refrigeracin
intermedia
En los diagramas (Fig. 2.7.), el proceso a-b representa el proceso de refrigeracin
intermedia:
Pa = Pb = Pr: presin de refrigeracin
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 73
El rea M-b-a-N en el plano T-S, (Fig. 2.7.b), representa el calor transferido en el interenfriador.
Teniendo presente que el proceso a-b es un proceso a P = cte.
o) (dp vdp. dh Tds
dh dq Tds
Tb) (Ta Cp q
Calor que tendr que ser transferido al sistema de enfriamiento. El rea a-b-2-c, en el plano
pv (Fig. 2.7 a) representa el ahorro de trabajo en la compresin, respecto a la compresin
politrpica en una sola etapa 1c.
La magnitud del rea a-b-2-c, que representa el ahorro de trabajo depende del valor de la
presin de refrigeracin (Pr).
Esta (Pr), puede variar desde Pr = Pi, valor mnimo terico, en cuyo caso no habra ningn
ahorro y el trabajo sera, en realidad el mismo que corresponde al proceso en una etapa, hasta
Pr Ps, valor mximo terico, con el mismo resultado anterior. Para cualquier otro valor de Pr,
comprendido entre los valores anteriores, el trabajo ser menor que el correspondiente a una
sola etapa.
Es decir que el trabajo total de compresin en dos etapas con refrigeracin intermedia, que es
igual a la suma de los trabajos correspondientes a cada una de las dos etapas:
2 T
bW 1Wa W
1
pr
p2
1 n
nRT
1
p1
pr
1 n
nRT
W
n
1 n
1
1 n
1
T (2.19.)
Depende del valor de Pr, como se muestra en la Fig. 2.8
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 74
Fig. 2.8. Trabajo total de compresin vs. Presin de refrigeracin intermedia
Este trabajo total W
T
tendr un valor mnimo W
T min
*
para una cierta presin intermedia de
refrigeracin pr
*
(Fig. 2.8)
DETERMINACIN DE LA PRESIN INTERMEDIA PTIMA
La presin intermedia de refrigeracin ptima, para la compresin en dos etapas es aquella
que hace que el ahorro de trabajo sea mximo o que, en otros trminos, hace que el trabajo
total sea mnimo.
Supuestos:
a) Los ndices politrpicos n de los procesos de compresin en ambas etapas son
iguales.
b) el aire se enfra en el refrigerador intermedio a presin constante hasta la temperatura
inicial.
Dado que la funcin W
T
= f (Pr) es continua entre los lmites de Pr = Pi y Pr = Ps (Fig. 2.8), el
mnimo ser determinado por el punto en que la pendiente sea igual a cero.
1
p1
p2
1 n
nRT1
1
p1
pr
1 n
nRT1
f(r) WT
n
1 n
n
1 n
n
n
n
n 1
n
1 n
n
n
n
1 n
n
1 n
pr p2
n
n 1
pr p1
n
1 n
1 n
nRT1
pr
WT
n
2n - 1
n
1 n
n
1
n
1 n
pr p2 - p1 pi
n
1 n
1 n
nRT1
pr
wt
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 75
Haciendo: 0
pr
WT
n
2n 1
n
1 n
n
1
n
n 1
pr p2 pr p1
n
1 - n
n
1 n 1 2
n
1
p1 p2 p1
n
n
p2.p1 pr
2
(2.20.)
p2.p1 pr (2.21.)
Lo que tambin puede expresarse como
*
*
pr
p2
p1
pr
Cuando la presin intermedia de refrigeracin corresponde a este valor ptimo, se cumple
que:
a) La relacin de presiones en la primera etapa de compresin o compresor de baja
presin (BP) es igual a la relacin de presiones en el compresor de alta presin (AP) o
segunda etapa de compresin.
b) como consecuencia de lo anterior inferimos que los trabajos de compresin, en cada
una de las dos etapas, son iguales:
1
pr
p2
1 n
nRT1
1 *
p1
pr
1 n
nRT1
n
1 n
*
n
1 n
1
p1
p2
1 n
nRT1
2
1
n
n
(2.23)
c) el trabajo total de compresin es igual al doble del correspondiente a una cualquiera de
las dos etapas.
1
p1
p2
1 n
2nRT1
2
1
n
n
WT (2.24.)
COMPRESIN EN MLTIPLES ETAPAS
Si la compresin se lleva a cabo en z etapas, cumplindose en todas ellas, las premisas
planteadas:
- El enfriamiento hasta la temperatura inicial
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 76
- El mismo ndice politrpico en todas las etapas
Para que el trabajo sea mnimo se requiere que sea el mnimo en cada par de etapas
consecutivas y por lo tanto:
1) La relacin de presiones es la misma en todas las etapas.
rpz ... rp3 rp2 rp1
pd
pe
pb
pc
p1
pa
2) La temperatura de salida de cada una de las etapas es la misma.
Td
Te
Tb
Tc
T1
Ta
Td Tb T1 Te Tc Ta
3) Si Pa: presin de salida de la 1 etapa:
Z
1 z
.p2 p1 pa Z
p1
p2
p1
pa
4) El trabajo total es igual a z veces el trabajo de uno cualquiera de las etapas
1
p1
p2
1 n
znRT1
WT
zn
1 n
Las principales ventajas de la compresin en mltiples etapas son:
a) Proporciona la oportunidad de refrigerar el gas en los enfriadores entre etapas
b) Requiere menos potencia de compresin
c) Menor intervalo de presiones y temperaturas en cada etapa
d) Menores prdidas de gas debido a fugas
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 77
e) Mejor eficiencia volumtrica (ver acpite 2)
f) Mayor simplicidad en el diseo de cada etapa al requerir menores relaciones de
presin.
2.3 COMPRESORES DE DEZPLAZAMIENTO POSITIVO
Su trabajo se puede modelizar como sistema, pero como dijimos se toma promedio de
entradas y salidas modelizando como un volumen de control (FEES). A este grupo
pertenecen los reciprocantes, rotativos (lbulos, aletas, tornillos) de diafragma, etc.
COMPRESORES RECPROCANTES
Se identifican como compresores recprocantes o alternativos aquellos compresores de
desplazamiento positivo constituidos por un conjunto cilindro-mbolo en el que el mbolo o
pistn. Posee un movimiento-alternativo regido por un mecanismo biela-manivela de tal forma
que la longitud del desplazamiento del mbolo, entre sus posiciones extremas, denominada
carrera (L) es igual a dos veces la longitud de la manivela (L = 2R).
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 78
Fig. 2.9 Compresor alternativo
VD: Volumen de Desplazamiento: volumen barrido por el mbolo en-su movimiento
VLVULAS DE UN COMPRESOR
RECIPROCANTE
La lmina de cierre de vlvula se
flexa por accin de las presiones.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 79
VM: Volumen Muerto: espacio no tocado por el mbolo en su movimiento
PMS: Punto Muerto Superior: posicin del mbolo ms cercana a las vlvulas de admisin
(VA) y escape (VE)
PMI: Punto Muerto Inferior: posicin extrema del mbolo ms alejada de las vlvulas.
L: Carrera: longitud del desplazamiento del mbolo entre los puntos PMS y PMI.
D: Dimetro: dimetro interior del cilindro
C: Relacin de volumen muerto: relacin entre el volumen muerto y el volumen de
desplazamiento.
VD
VM
c
COMPRESOR IDEAL SIN VOLUMEN MUERTO
Con esta denominacin se identifica al compresor reciprocante en el que el PMS coincide con
el fondo del cilindro.
La descripcin de su funcionamiento sera la siguiente (Fig. 2.10):
01: Con la VA abierta, por accin de p
1
, el
mbolo, en su desplazamiento del PMS
al FMI, admite el gas a la presin de
ingreso o presin inferior Pi que llena
completamente el VD.
12: Cerrada la VA, el mbolo en su
desplazamiento del PMI al PMS
comprime el gas en un proceso
politrpico pv
n
=C, hasta que el gas
llega a la presin Ps(2) se abre la vlvula
de escape VE y el cilindro se pone en
comunicacin con el ducto de salida a la
presin Ps.
Fig. 2.10 Compresor ideal sin volumen muerto
23: Abierta la vlvula de escape, en el punto (2), contina el desplazamiento del mbolo
que expulsa el gas hasta llegar al PMS, punto en el cual todo el gas comprimido ha sido
expulsado.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 80
30: Estando el mbolo en el PMS se cierra la VE y se abre la VA pasando el interior del
cilindro de estar comunicado con la presin superior (Ps), por medio de la VE, a
comunicarse con la presin inferior (Pi), por medio de la vlvula de admisin (VA).
El rea 01230, en el plano pv, representa el trabajo del compresor
ideal sin volumen muerto. Como se puede apreciar, representa el trabajo bajo
cualquiera de los puntos de vista: de proceso con flujo o sin l.
Desde el primer punto de vista, considerando que el proceso se efecta mientras el gas
fluye a travs del compresor (W=vdp) tendramos el razonamiento siguiente:
0-1: Proceso o presin constante Pi, no hay trabajo efectuado y el proceso no determina un
rea hacia la izquierda del mismo.
12: proceso politrpico trabajo identificado con el rea comprendida entre la curva del
proceso y el eje p.
23: proceso a presin constante Ps, no hay trabajo y por lo tanto no hay rea entre lo
grfico del proceso y el eje p.
30: en este proceso virtual no hay masa y por lo tanto el trabajo y el rea correspondiente
son nulos.
Desde el segundo punto de vista, tomando como sistema la masa de gas aspirada por el
compresor (W=-pdv), el razonamiento sera el siguiente:
01: proceso de admisin a presin constante, trabajo identificado con el rea debajo del
grfico del proceso, de signo positivo. En el diagrama (Fig. 2.11): rea achurada de
izquierda a derecha y de abajo haca arriba.
Fig. 2.11 Trabajo en el compresor ideal sin volumen
muerto
12: proceso de compresin, trabajo positivo, identificado por el rea comprendida entre la
curva del proceso y el eje V, achurada verticalmente.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 81
23: proceso de expulsin a presin constante ps, trabajo positivo, representado por el rea
comprendida entre la grfica del proceso y el eje y achurada, por ser positiva,
igualmente en forma vertical.
Efectuada la suma algebraica de los trabajos, se encuentra que el trabajo neto est
igualmente, bajo el anterior punto de vista, representado por el rea 0123O.
Otro aspecto que se debe notar es el siguiente: aunque el funcionamiento del compresor
alternativo es cclico, el ciclo de compresin (0 123--O) es slo mecnico, ya que desde
el punto termodinmica lo que sufre la sustancia es nicamente un proceso (12). Lo que se
puede apreciar mejor si se contrasta los diagramas en los planos pV (presin-volumen total)
y pv (presin volumen especfico) Fig. 2 12.
Fig. 2.12 Funcionamiento de un compresor ideal sin volumen muerto en los planos p-V
y p-v.
En los diagramas mostrados se puede apreciar que de O 1 el gas es admitido sin sufrir ningn
proceso, pues en el plano pv el estado del gas es el mismo. Idntica apreciacin se puede
hacer respecto al proceso 23 de expulsin del gas. Siendo en realidad el proceso 12 del
compresor el nico que representa un proceso termodinmico.
Por otro lado es conveniente, adems, observar que el rea 0-12 3O en el plano pV
representa el trabajo de compresin por ciclo del compresor y es igual al trabajo de
compresin por unidad de masa del gas o trabajo especifico de compresin representado por
el rea M1 2N en el plano p-v, multiplicado por la masa de gas admitida y por lo tanto
comprimida en cada ciclo por el compresor.
w m w
a
COMPRESOR IDEAL CON VOLUMEN MUERTO
El compresor ideal sin volumen muerto si bien presenta la ventaja de aprovechar en forma
efectiva todo el volumen de desplazamiento, su funcionamiento no puede pasar de la mera
concepcin ideal pues, en la prctica, los frecuentes choques entre el mbolo y el fondo del
compresor haran muy corta su vida til.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 82
Por esta razn deber haber un volumen entre el PMS y fondo del cilindro, denominado
volumen muerto (VM) que no permitir Contacto ni choque alguno entre el mbolo y el fondo
del cilindro.
Por otro lado la existencia de este volumen muerto, denominado tambin volumen perjudicial.
significar que no todo el gas comprimido en el cilindro ser entregado o expulsado a travs de
la vlvula de escape, pues dada la limitacin habida en el desplazamiento del mbolo, el gas
comprimido, correspondiente al volumen, muerto quedara dentro del cilindro.
El funcionamiento del compresor. Partiendo del punto 1, es decir con el cilindro del compresor
(VM +V
D
) completamente lleno de gas a la presin Pi, es el siguiente:
1-2: cerradas las vlvulas, el desplazamiento del mbolo comprimir el gas a lo largo de la
politrpica pP hasta que alcanzada, en 2, la presin Ps, se abre la VE.
2-3: con la VE abierta el desplazamiento del mbolo del punto 2 al PMS, no continuar
comprimiendo el gas, sino que originar la expulsin del gas comprimido a travs de la
VE, a la presin Ps.
34: terminado el proceso de expulsin se cierra la VE y el VM quedar lleno de gas
comprimido que se abriera la VA, escapara al exterior, para ser luego nuevamente
captado y comprimido. Por esta razn con ambas vlvulas cerradas se deja que el gas
se expanda a lo largo de la politrpca pv
n
a medida que el mbolo se desplaza del PMS
al FMI hasta que en el punto 4 alcanza la presin pi y en este punto se abre la VA con la
que termina la expansin.
41: con la VA abierta el desplazamiento del mbolo de 4 a 1 (PMI) da lugar a la admisin
del gas a la presin Pi en un volumen correspondiente al desplazamiento 41.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 83
Fig. 2.13. El compresor alternativo ideal con VM en los planos presin-volumen
total y masa de gas en el compresor-volumen total
EFICIENCIA VOLUMTRICA CONVENCIONAL (evc)
Debido al efecto perjudicial del VM, el volumen de gas admitido es el volumen:
V4 V1 Va (2.29.)
y no el volumen VD, como podra esperarse a la luz del funcionamiento del
Fig. 2.14. Compresor ideal con VM.
Compresor Ideal sin volumen muerto.
A la relacin entre el volumen admitido Va en las condiciones ideales de funcionamiento del
compresor con VM y el volumen de desplazamiento se le denomina eficiencia volumtrica
convencional evc.
VD
Va
evc
Tomando en cuenta la igualdad (2.29) y la Fig. 2.14:
VD
V4 - V1
evc
Donde V
1
= VM + VD Y
n
1
n
1
n
1
P1
P2
VM
p1
p2
p4
p3
V3 V4
Adems se define c relacin de volumen muerto a:
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 84
D
M
V
V
c
(2.32.)
Reemplazando en (2.31):
D
n
1
1 2 M M D
V
) /p (p V V V
evc
n
1
1
2
p
p
C C 1 evc
(2.33)
1
p
p
C 1 evc
n
1
1
2
(2.34.)
La evc, que ordinariamente se expresa en %, se interpreta como la parte del VD que se usa
en forma efectiva para admitir el gas que ser comprimido y entregado a la presin Ps.
La evc disminuya medida que:
a) se aumenta el VM o, en otros trminos, a medida que aumenta la relacin de VM: c
b) se aumenta la relacin de presiones (ps/pI) Fig. 2.15
c) se disminuye el exponente politrpico del proceso: n.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 85
Fig. 2.15. Efecto de la relacin Fig. 2.16. evc vs.
pa/pi
De Presiones sobre la evc. n=14
Fig. 2.16. a. Diagrama para la determinacin de la e.v.c.
En la Fig. 2.16 se aprecia la variacin de la evc en funcin de la relacin de presiones para c=5%
y c=7%, valores entre los que oscila c en los compresores alternativos de aire. Se ha supuesto
un compresor isentrpico que trabaja con aire (1 <=1.4).
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 86
Para otros anlisis de la variacin de la eficiencia volumtrica en funcin de la relacin de
presiones: (p
2
/p
1
), el ndice politrpico n y la relacin de volumen muerto c. puede usarse el
grfico de correlacin 2.16.a.
EFICIENCIA VOLUMETRICA REAL. [ev]
Se denomina capacidad de un compresor al flujo real en m
3
/min del gas admitido, medido
mediante un orificio u otro elemento medidor, a las condiciones de aspiracin.
Dado que el funcionamiento de un compresor no corresponde a las condiciones ideales
asumidas, su eficiencia volumtrica real:
D
V
Va
ev
Es menor que la convencional, ya que en este Caso el volumen admitido Va es menor que el
que corresponde al caso ideal;
evc ev
La ev real de un compresor debe ser determinada experimentalmente.
TRABAJO Y POTENCIA EN UN COMPRESOR CON V.M.
Teniendo en cuenta los siguientes aspectos:
a) el ndice politrpico n de los procesos de compresin (12) y expansin (34) es
el mismo, y por lo tanto el trabajo por Kg. de gas (w) es el mismo en valor absoluto
pero de signo opuesto (Fig. 2.17b) su valor es:
1
pi
ps
1 n
nRT1
3w 1w
n
1 n
4 2
b) el trabajo total efectuado por el compresor en el proceso 1-2 (
1
W
2
) es igual al
producto del trabajo especifico correspondiente, por la masa presente durante ese
proceso en el compresor mA + mM.
Este trabajo es de
signo positivo. Fig. 2.17. c.
Fig. 2.17.
Trabajo de un
compresor con VM
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 87
c) el trabajo efectuado por el gas correspondiente al VM, durante su expansin (
3
W
4
) es
el producto del trabajo especifico (positivo) por la masa remanente (Fig. 2.17d.) mM
d) el trabajo neto de compresin es el correspondiente a la diferencia Wc =
1
W
2
-
3
W
4
y
est representado por el rea 1234 (Fig. 2.17.e)
e) este trabajo neto de compresin por ciclo del compresor puede tambin expresarse
en trminos del valor absoluto del trabajo especfico (w), as:
mM)w (mA Wc
Es decir que el trabajo de compresin efectivamente realizado por ciclo es el correspondiente
slo a la masa aspirada en cada ciclo ma (Fig. 2.16a)
f) la potencia es el producto de la masa realmente aspirada o admitida por unidad de
tiempo, magnitud que se usa para medir la capacidad del compresor, por el trabajo
especifico.
w m W
1
p1
p2
1 - n
RT1 nm
W
n
1 n
(2.36.)
Donde:
m = masa aspirada en Kg./s
R = constante particular del gas en KJ/Kg.-K
T
1
= temperatura del gas al inicio de la compresin en K
w = potencia en KW
1
p1
p2
1 - n
np1V1
W
n
1 n
(2.37.)
Donde:
pi = presin de aspiracin en KN/m
2
(0.01 bar)
1 V = volumen aspirado medido en tas condiciones de
aspiracin: m /s W = potencia de compresin en KW.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 88
W = potencia de compresin en KW.
POTENCIA INDICADA DE UN COMPRESOR
Se denomina diagrama indicado de un compresor al diagrama p-V del funcionamiento real del
compresor y que se obtiene mediante un dispositivo denominado indicador de diagrama.
Dicho diagrama difiere del diagrame ideal, anteriormente asumido, principalmente por las
siguientes razones:
a) la presin a la que el fluido ingrese al cilindro es en realidad menor que la presin pi
desde la cual se quiere comprimir, por efecto de las prdidas de presin a travs de la
vlvula, filtro y ducto de admisin
b) la temperatura del gas durante la admisin no permanece constante, sino que
aumenta por efecto de la transferencia de calor desde las paredes del cilindro hacia el
gas que Ingrese.
c) la presin del gas durante la expulsin es mayor que la presin ps por efecto de la
cada de presin a travs de la vlvula de escape.
d) las vlvulas automticas dan lugar a las protuberancias caractersticas en el diagrama al
inicio de los procesos de admisin y expulsin.
e) el exponente politrpico correspondiente al proceso de compresin no es
necesariamente el mismo que el correspondiente al proceso de expansin.
Diagrama indicado de un compresor reciprocante.
Por estas razones el trabajo real de compresin por ciclo es mayor que el correspondiente al
compresor ideal y por el hecho de obtenerse a partir del diagrame indicado se le denomine
trabajo Indicado Wi y a la potencia correspondiente potencia indicada Wi.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 89
Para la obtencin de la potencia indicada muchas veces se define un concepto operativo,
denominado presin media indicada pmi. Cuya definicin operacional es:
D
V
pdV
pmi
(2.38.)
De tal forma que el trabajo indicado sera:
D
pmiV Wi
(2.39.)
Siendo:
Wl : trabajo Indicado por ciclo en kJ
pml : presin media Indicada en k N/m
2
VD : volumen de desplazamiento en m
3
Y la Potencia indicada:
.N pmi.V 1 W
D
(2.40.)
N : Nmero de ciclos por segundo
1 W : Potencia indicada en KW
POTENCIA AL EJE
El compresor no es un dispositivo en abstracto en el que se lleve a cabo la compresin,
descrita en los puntos anteriores, sino que, como conjunto de elementos mecnicos, es una
mquina en la que hay prdidas mecnicas, es decir, prdidas por rozamientos.
Por tal motivo la energa mecnica que se tiene que entregar al eje del compresor es mayor
que la necesaria para la compresin, en el valor de las prdidas mecnicas.
t W t W e W (2.41.)
e W : potencia al eje
I W : Potencia indicada
t W : Potencia de prdidas por friccin
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 90
EFICIENCIA MECNICA
Se define la eficiencia mecnica de un compresor como la relacin entre la potencia efectiva
de compresin o potencia Indicada y la potencia al eje.
We
W
1
M (2.42.)
DEFINICIONES IMPORTANTES
Compresor: Mquina que, con diferentes principios operativos, comprime gases desde una
presin Inicial, denominada presin de aspiracin, hasta una presin final, mayor, denominada
presin de descarga.
Compresor de alta presin: Se denomine as, en una planta de compresin en varias etapas, al
compresor de la ltima etapa, es decir al que trabaja entre las ms altas presiones.
Compresor de baja presin: Se denomine as en una planta de compresin en varias etapas al
compresor de la primera etapa, es decir, el que trabaja en el rango ms bajo de presiones.
Bomba de vaco: Se denomina as al compresor que trabajando entre una presin de succin
inferior a la atmosfrica y una presin de descarga igual o superior a la atmosfrica, tiene por
objeto mantener una presin de vaci en un ambiente, denominado cmara de vaco.
Presostato: Dispositivo de regulacin que, va La operacin automtica del compresor se
encarga de mantener la presin en un valor o dentro de un rango.
Compresores reciprocantes: son mquinas de desplazamiento positivo usadas para
incrementar la presin de una cierta masa de gas, por ciclo de funcionamiento, mediante
reduccin de volumen.
Compresor de simple accin efecto: son compresores reciprocantes que comprimen,
mediante la accin de una sola cara del pistn. La compresin tiene lugar en una sola de las
dos carreras del pistn, es decir que el compresor efecta un solo ciclo por revolucin.
Compresor de doble efecto: son compresores reciprocantes que comprimen a ambos lados
del pistn. La compresin tiene lugar en ambas carreras del pistn, Una con cada cara del
mbolo, es decir que el compresor efecta dos ciclos por revolucin, uno hacia cada lado del
pistn. El compresor tiene dos volmenes muertos y dos juegos de vlvulas. En este tipo de
compresores, para efectos del volumen de
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 91
Fig. 2.19 Compresor reciprocante de Fig. Compresor reciprocante de doble
Simple accin accin o efecto.
desplazamiento debe descontarse volumen correspondiente al vstago salvo que en trminos
relativos su dimensin no afecte el clculo.
Compresor de una etapa: compresor que en una sola etapa, comprime el gas desde la presin
Inicial o de aspiracin hasta la presin final. El mximo generalmente recomendado es de 1
MPa (10 bar).
Compresor de mltiples etapas: compresores que efectan la compresin en ms de una
etapa, pudiendo hacer uso de Interenfriador.
Fig. 2.21. Compresor de dos etapas con interenfriador
Interenfriador: intercambiador de calor usado para enfriar el gas entre dos etapas de
compresin en un compresor de mltiples etapas.
Postenfriador: intercambiador de calor usado para enfriar el gas comprimido despus de la
ltima etapa, caso de compresin en mltiples etapas, o de la nica etapa, en el caso de
compresin en una etapa. Adicionalmente sirven para extraer el condensado.
Separadores de humedad: son usados generalmente en los enfriadores intermedios,
posteriores o tanques de aire comprimido. Colectan y separan la humedad o condensado.
Tanques recibidores: amplios tanques receptores del gas comprimido que cumplen las
siguientes funciones:
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 92
a) eliminar el flujo pulsante cuando se trata de compresores de desplazamiento positivo.
b) proveer capacidad adicional momentnea, de reserva, cuando hay sbitas demandas
en cantidades mayores que la capacidad del compresor.
c) permitir la remocin de humedad condenada y lubricante arrastrada por el gas
comprimido.
Fig. 2.22. Tanque recibidor
d) instalar en ellos los elementos reguladores de presin a fin de que sta se mantenga
estable entre ciertos lmites prefijados.
Volumen de desplazamiento (VD): es el volumen barrido
por el pistn en su carrera. Se expresa generalmente en
m
3
/min.
Compresor de simple efecto:
L.RPM D
4
1
V
2
D
Compresor de doble efecto:
RPM L2 D
4
1
V
2
D
D y L en m.
Para compresores de mltiples etapas se considera slo el volumen de desplazamiento de la
primera etapa.
Velocidad del pistn: es la velocidad media de desplazamiento del pistn.
60
2L.RPM
V
(m/s)
Capacidad real: es el volumen de gas realmente admitido por el compresor en rgimen
estable. La capacidad real es expresada en m
3
/min m/s a las condiciones de presin y
temperatura existentes en el ingreso de la primera etapa.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 93
Eficiencia volumtrica: es la relacin entre la capacidad real y el volumen de desplazamiento.
Aire libre: describe generalmente el aire a las condiciones de presin y temperatura del
ambiente, esto es a las condiciones atmosfricas.
Factor de carga: es la relacin entre el flujo de un compresor durante un cierto perodo y el
mximo flujo o capacidad del compresor.
Potencia al freno: es la potencia medida o entregada en el eje del compresor.
Prdidas mecnicas: es la potencia necesaria para vencer los rozamientos; tambin
denominado potencia friccional. Es una funcin del tamao del compresor y puede estimarse
segn la siguiente frmula emprica para clculos aproximados.
3/4
D
) 0.0054(V Wf
/min m en V
kW en Wf
3
D
Balance energtico: es La determinacin experimental de la forma, cuantitativa y cualitativa,
en que se distribuye la potencia entregada al eje de un compresor.
COMPRESORES DE DESPLAZAMIENTO POSITIVO FLUJO CONTINUO: son aquellos, que no
disponiendo de vlvulas, tienen flujos continuos en la succin y en la descarga.
Fig. 2.23. Compresores de flujo continuo a) de Rotos b) de paletas deslizantes
2.4 COMPRESORES DE TORNILLO ROTATIVO ASIMTRICO
Siempre es necesario disponer de aire exento de aceite, y con una legislacin cada vez ms
rigurosa en materia de eliminacin de aceites y condensados contaminados con aceites que
daan el medio ambiente. La mayora de los compresores utilizados (de pistones), utiliza aire
con inyeccin de aceite para lubricar, refrigerar y sellar los elementos anillos cilindro u otros.
Esto requiere el uso de filtros para eliminar el aceite usado antes de entregar a la red de aire.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 94
Sin embargo, al usar incuso los filtros de mayor calidad, necesitan mucha atencin en limpieza
y sustitucin, pues si falla el filtro, el aceite residual afectar la calidad del producto y la
produccin. Por ello, los compresores de uso industrial, estn siendo reemplazados por los
compresores de tornillos.
Los tornillos rotativos asimtricos, trabajan exentos de aceite, han sido patentados por Atlas
Copco. Este diseo elimina totalmente la necesidad de lubricacin dentro del elemento, pues
es diseado para funcionar sin contacto de los sellos de eje tambin aseguran que no exista
desgaste ni arrastre de aceite en la cmara de compresin. Los rotores totalmente
sincronizados, equilibrados y fabricados con precisin, estn soportados por rodamientos de
bolas y de rodillos, capaces de soportar frecuentes cargas axiales, y permitir un arranque sin
riesgo. Ello permite: Baja vibracin, instalacin menos compleja (son compactos), menor
mantenimiento, sin ruidos.
Estos compresores son fabricados en forma compacta, ya tienen motor de accionamiento,
refrigeradores, filtros de aire, sistema silenciador, controles y todas las conexiones necesarias.
No necesita casa de mquinas, ello facilita acceso a todos los puntos de mantenimiento que
son pocos como: Cambio de aceite, filtro de aceite y de aire.
Si la instalacin necesita aire de calidad sin aceite y seco, es necesario colocar un secador MD
el cual garantiza un aire absolutamente seco, con bajo costo y sin usar energa adicional, pues
utiliza el calor de compresin para regenerar y precisando un mnimo de potencia elctrica
para girar el tambor, no usa fren CFC, por lo cual son ambientalmente aceptables.
Fig. Compresor de Tornillo de Atlas Copco.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 95
Fig. (a)Compresor de tornillo de Atlas Copco (b) tornillo Enduro de Gardner Denver
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 96
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 97
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 98
Las presiones de trabajo de compresores son diseados para
relacin de presiones de 15 bar en una etapa y para 25 bar
en dos etapas, con velocidades de rotacin bajas, ello
minimiza el desgaste
Gardner Denver fabrica compresores de tornillo desde 4 a 500 kw. Adems de su gama de
compresores estndar, Gardner Denver dispone de compresores de velocidad variable desde
10 a 250 kw.
La automatizacin y el control de uno ms compresores se realiza en forma fcil, pues ya
vienen con mdulos de comunicacin con una PC. El ES es un gerente del compresor, como se
ve en la figura, es posible acceder a ella desde cualquier punto de la planta del planeta va
internet usando una PC.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 99
2.5 COMPRESORES DINMICOS:
Pueden ser centrfugos, axiales y mixtos.
Fig. (a)Rotor Centrfugo (b) Rotor axial
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 100
2.6 CRITERIOS DE SELECCIN Y PLANTAS DE COMPRESORES:
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 101
Fig. Campos de aplicacin de los compresores: 1. reciprocantes , 2 reciprocantes opuestos
, 3 opuestos 4 compresores centrfugos , 5 rotativos helicoidales , 6 axiales , 7 combinados
ESQUEMAS DE INSTALACIN BSICA DE AIRE COMPRIMIDO
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 102
Fig. Esquema de instalacin de aire comprimido con dos compresores de 1 etapa: 1 toma de
aire, 2 filtro, 3 compresor, 4 enfriador con separador de aceite y agua, 5 recipiente de aire, 6
vlvula de seguridad, 7 compuerta de cierre, 8 vlvula de retencin, 9 vlvula de descarga,
10 compuerta de cierre, 11 vlvula de seguridad
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 103
Fig. Esquema de instalacin de aire comprimido con un compresores de 2 etapas: 1 motor
elctrico, 2 compresor, 3 toma de aire, 4 conducto de admisin, 5 filtro, 6 tubera de
aspiracin, 7 tubera intermedia, 8 enfriador intermedio, 9 y 12 tuberas de presin, 10 Post
enfriador, 11 separador de aceite y agua, 13 recipiente de aire, 14 tubera maestra, 15
vlvula de seguridad sin derivacin, 16 y 20 vlvulas de compuerta, 17 vlvula de retencin
18 vlvula de seguridad con derivacin, 19 grifo, 21 tanque de acumulacin de aceite y
condensado durante el barrido.
La serie XA(T,H)S 37-97 de Atlas Copco es una gama innovadora de compresores transportables
monoeje de tornillo rotativos con inyeccin de aire.
Accionados por motores KUBOTA de 3 cilindros o DEUTZ de
2 o 3 cilindros, los compresores de la Serie 7, ofrecen un
suministro fiable de aire comprimido para accionar varias
herramientas neumticas, como cinceladores, rompedores,
aprietatuercas, amoladoras y pisones.
Tambin cubre aplicaciones que requieren un elevado
caudal de aire libre, como las de chorro de arena. Se puede
especificar un generador integral opcional de 6,5 o 12 kVA para suministrar potencia adicional
para soldadura, iluminacin, calentamiento, equipo de obra y herramientas elctricas.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 104
El Motor de Aire Comprimido MDI (Moteur Developpment International)
Tras doce aos de estudio, Guy Ngre ha conseguido desarrollar un motor que puede
convertirse en uno de los mayores avances tecnolgicos de este siglo. Su aplicacin a los
vehculos CAT's aporta grandes ventajas tanto en su coste econmico como su coste
medioambiental. Con la incorporacin de la bi-energa (Aire
comprimido + combustible), adems de la monoernerga (Solo aire),
los vehculos CAT's han aumentado su autonoma hasta cerca de los
2.000 km, con una contaminacin nula en ciudad y muy reducida
fuera del rea urbana.
A su vez, las nuevas aplicaciones del motor MDI abren multitud de
posibilidades en campos como la nutica, co-generacin, motores
auxiliares, grupos electrgenos, etc. El aire comprimido es un nuevo
vector energtico que permite, de forma viable, la acumulacin y el
transporte de la energa.
MDI est muy cerca de iniciar la produccin en serie de motores y
vehculos y se financia con la venta y cesin de licencias de
fabricacin de sus patentes en todo el mundo
Prctica dirigida de Compresores
1.- (6) A un proceso de compresin isoentrpica ingresan 35 m
3
/s de aire a 1 bar y 300K y son
comprimidos hasta una presin tal que si el proceso se hiciera en 3 etapas con refrigeracin
intermedia ptima, el calor total transferido en los interenfriadores sera de 5 300KW.
Determine:
a) La potencia requerida para comprimir en cada etapa y la Potencia elctrica en KWe
b) el flujo de aire en m
3
/s a la salida de la segunda etapa.
2.- (21) Un compresor alternativo de simple efecto y dos etapas comprime aire de 1 a 100 bar.
La temperatura al inicio de la primera etapa es de 300K. Las compresiones son mediante
procesos politrpicos en los que n=1,3. La presin intermedia es la ptima terica, pero la
temperatura despus del interenfriador es de 308 K. En las dos etapas el dimetro del pistn
es igual a la longitud de su carrera, la velocidad es 200 RPM, la relacin de volumen muerto (c)
es 5%, hay cuatro cilindros por etapa y se comprime 1,8 m
3
/s. Determine:
a) El calor intercambiado en el intercambiador en KW
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 105
b) El dimetro del pistn de la primera etapa en cm
c) La potencia requerida en KW y en KWe.
3.- Un compresor de doble efecto y dos etapas aspira 0,038 kg/s de H2 a 27C y 0,07 bar. La
descarga del compresor de baja presin es de 0,35 bar y entre las etapas la cada de la presin
es de 0,07 bar. El compresor de alta presin recibe el agua desde un refrigerador intermedio a
32 C y lo descarga a 1,4 bar. La compresin es politrpica con n= 1,3, el espacio muerto es 5%
en cada cilindro, determine:
a) La cantidad de agua que ha de circular en el refrigerador intermedio si su aumetode
temperatura es de 6C. b) La potencia de compresin c) El tamao del cilindro de
baja presin para una velocidad de 300 RPM y L/D=1,25
Problemas de Compresores ( Cruz Postigo y Habich)
1.-(H) En un compresor de aire ingresa a razn de 3 m
3
/s. , el cual ha sido tomado del medio
ambiente ( Po= 1 bar, To= 25C La descarga se realiza a 3 bar. Determnese la temperatura T2 y
la potencia, si el proceso es realizado a:
a).- Politrpico internamente reversible con n=1,3.
b).- Isotrmico.
c).- Isentrpico.
d).- Si el compresor consume 420kw. Determine la deficiencia adiabtica y la eficiencia
isotrmica de compresin.
Rpta a) 375,04 KW b) 329,517 c) 387,097 d) 92,166% y 78,45%
2.- (H) En un compresor ingresa el aire a 120m
3
/s a la presin y temperatura de 0.8 bar y 27 C,
la cual es comprimida hasta 4bar, en dos etapas con refrigeracin intermedia, siendo la
velocidad del compresor reciprocante de 960 RPM, volumen muerto de 5%. ndice Politrpico
en este proceso 1.42 determinar:
a).- La potencia de compresin mnima.
b).- El volumen de desplazamiento en la segunda etapa.
c).- El % de la carrera a que se abre la v. e. Del compresor de la primera etapa.
d).- La eficiencia isoentrpica en la primera etapa.
e).- La eficiencia isotrmica total del compresor.
Rpta a) 17 444,34 Kw b) 55,792 c) 54,58% d) 99,58% e) 88,57%
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 106
3.- (H) Un compresor de una etapa y simple efecto tiene un dimetro de 12.7 cm. Y una carrera
de 11,43 cm, el volumen muerto es de 73,75 cm
3
. La succin se realiza a la presin de 1 bar y
18C y la descarga a una presin de 5,25 bar. Este compresor trabaja a 105 RPM con un
exponente de n=1,32, determinar:
a) El porcentaje de espacio muerto, b) la evc c) la masa de aire que comprime este
compresor
d) La potencia de compresin necesario e) Si el compresor fuera de doble efecto Cmo
varan los resultados?
Si la presin de descarga se incrementa a 25 bar mediante la adicin de un compresor de alta
presin con 10 cm de carrera y un enfriador intermedio que reduce la temperatura a 38C,
calcular:
f) El dimetro del compresor de alta presin g) El trabajo necesario de compresin
h) El calor extrado por el enfriador intermedio, considere C
AP
=4,5%
Rpta: a) C= 5,093% b) 0,8721 c) 1,512x10
-3
kg/min d) 0,451 Kw
4.- (H) En un proceso de compression de 6 m
3
/min de aire desde 1 bar y 300K hasta 5 bar, el
cambio de entalpa es de 183,5 KJ/kg, Cp= 1,004KJ/kg.K; K= 1,4 Determine:
a) La potencia de compresin en KW
b) El flujo de aire a la salida del compresor en m
3
/s
Rpta: a) 20,612 Kw b) 0,0322 m
3
/s
5.- (H) Se desea comprimir 50 m
3
/min de Nitrgeno desde 30 KPa 290 K hasta 1,8 MPa en un
compresor en donde el ndice politrpico del proceso es de 1,35. La compresin se efecta en
dos etapas con refrigeracin intermedia. En el enfriador solo se logra enfriar el nitrgeno
comprimido hasta 295K. Considere para el N2 que M=28, R= 0,2968 KJ/kgK, Cp= 0,7448 KJ/kgK
y determine :
a) La potencia necesaria en las condiciones dadas y la eficiencia isoentrpica del proceso
b) La capacidad del sistema de refrigeracin del compresor incluidos los interenfriadores en
KJ/min.
c) La potencia elctrica del compresor necesaria en las condiciones dadas si la eficiencia
mecnica es de 85% y elctrica del motor es de 90%. (Respuesta en KWe)
d) Si el compresor de la primera etapa fuese un compresor reciprocante con 4% de volumen
muerto. A qu porcentaje de la carrera de compresin se debe abrir la vlvula de escape ?.
Rpta: a) 136,19 KW, 117% b) Q
T
= 5,448 KJ/min c) d) 18,28%.
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 107
6.- (14CP)Un compresor reciprocante tiene las siguientes caractersticas: Longitud total de la
cmara 0,5 m, dimetro 0,5 m, carrera 0,46; velocidad 750 RPM, eficiencia mecnica, 85%, la
vlvula de admisin se abre 33% de la carrera Determine la evc. Rta
77%
7.- (21CP) Un turbocompresor aspira 500 m
3
/min de gas natural a la presin de 1 bar 17C, con
una composicin de 17% de C2H6 y 83% CH4 en volumen y lo comprime hasta la presin de
1,8 bar. Cul es la potencia de compresin si la eficiencia isoentrpica del compresor es de
75%?.
8.- En una instalacin de compresin se aspiran 90 m
3
/min de aire a 1 bar 17C, si se desea
comprimirlos hasta 6 bar siendo la eficiencia isoentrpica de 90%. Determinar la potencia de
compresin y la eficiencia isotrmica del proceso. Rpta: Wc=390
KW,
T
= 68,9%
BIBLIOGRAFA
M.J. MORAN y H.N. SHAPIRO, Fundamentos de Termodinmica Tcnica, 2da
edicin 2004 Editorial Revert
K. WARK Donald Richards: Termodinmica (6 ed.), Mxico, McGraw-Hill,
2001,
YUNUS A. ENGEL y MICHAEL A. BOLES Termodinmica (5 ed.) Editorial
McGraw-Hill. Ao 2006
CRUZ POSTIGO , Termodinmica Aplicada Ediciones UNI
Habich ediciones de UNI Termodinmica II
Varios. http://www.atlascopco
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 108
INDICE (Combustin)
A
Anlisis de la primera ley 21
Anlisis de la segunda ley 31
Anlisis de los procesos de combustin 12
Aparato de Orsat 12,14
Auto mantenida 3
B
Biomasa 37
C
Calefaccin 3, 6
Calormetro 16
Cmara de combustin 23
Cambio de entropa de sistemas reactivos 29
Catalizador 31
Ctodo 34
Celdas de combustible 34
Chimenea 11, 12
Comburente 4
Combustibles 4, 5
Combustin 3, 4 - 5-7
Combustleo 7
Conduccin 3
Cuasi equilibrio 23
D
Departamento de Energa de los EEUU 35
Diatmico 16
Difusin 3
E
Eficiencia termodinmica 31
Electrolitos 34,35
Electroqumico 34
Energa interna 23
Entalpa de combustin 25, 31
Entalpia de formacin 23
Entalpias 5,16 -17-20-23
Entropas 5, 23-29
Equilibrio metastable 3
Estequiomtricas 7, 9 -15-19
Exceso o Deficiencia 9
Exerga 29
Exotrmica 3, 4
Exotermicidad 3
F
FEES 5
Fenmenos de no equilibrio 3
Flama adiabtica 5, 26-27
Fluido dinmico 3
Flujo estable 22, 32
Flujo molar 20
G
Gases ideales 30
Gibbs 33
Gravimtrico 6
H
Higher 16
Hidrocarburos 6, 12-19
Humedad 13
I
Iluminacin 3
Incineracin 3
Incompresible 18
Isotrmico 19, 25
L
Ligadura nuclear 16
Lower 16
M
Masa relativa 9
MATT 4
Mezclas reactivas 3
Multidisciplinario 3
O
Oxidacin 4
P
Poder calorfico 16
Premezclados 23
Propulsin 3, 6
Punto de roci 5, 11
Q
Quimioluminiscencia 3
S
Sistema cerrado 23
T
Temperatura de la flama adiabtica 25
Temperatura de roco 24
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 109
Termoqumico 3
V
Viabilidad 3
Volumtrico 6
TERMODINAMICA APLICADA 1ra Fase
Ing. Camilo Fernndez B. 110
También podría gustarte
- Tablas Termodinámicas CengelDocumento50 páginasTablas Termodinámicas CengelJMarce1686% (21)
- Un Generador de Vapor VaporizaDocumento4 páginasUn Generador de Vapor VaporizaDaniel'Cisneros67% (3)
- Balance Potencial Respuestas de Tareas 2020Documento16 páginasBalance Potencial Respuestas de Tareas 2020Alvin Jakitori50% (4)
- Manrique Transferencia de Calor 2ed - PDF 115-207 PDFDocumento93 páginasManrique Transferencia de Calor 2ed - PDF 115-207 PDFDameron Cab100% (1)
- Cuestionario U3 - MotricesDocumento5 páginasCuestionario U3 - MotricesPABLO GERARDO PRADO VILLAMARIN100% (1)
- Termodinámica 2 - Clase 5Documento19 páginasTermodinámica 2 - Clase 5Miguel Tasayco100% (1)
- Transferencia de CalorDocumento34 páginasTransferencia de CalorMonseAún no hay calificaciones
- Unidad 4 Intercambiadores de Calor CopiarDocumento14 páginasUnidad 4 Intercambiadores de Calor CopiarRoberto Leon50% (6)
- Procesos de Combustion Teorico y RealDocumento10 páginasProcesos de Combustion Teorico y RealVicente Lopez PosadaAún no hay calificaciones
- TC Tema 4Documento129 páginasTC Tema 4Jair Peña75% (4)
- Deber 1 Intercambiadores de CalorDocumento12 páginasDeber 1 Intercambiadores de CalorIsraguilarAún no hay calificaciones
- 5.1 Fracciones Molares y de MasaDocumento2 páginas5.1 Fracciones Molares y de MasaMoises Jimenez Gomez75% (4)
- Termodinamica IiDocumento5 páginasTermodinamica IiTeresa Barrios De La CruzAún no hay calificaciones
- Ciclos de VaporDocumento7 páginasCiclos de Vapormarquez_92_4Aún no hay calificaciones
- Trabajo Final de Operaciones Unitarias 2Documento8 páginasTrabajo Final de Operaciones Unitarias 2Henry Arias Soliz0% (1)
- Coeficiente Global de Transferencia de CalorDocumento10 páginasCoeficiente Global de Transferencia de Caloryamicris80% (5)
- Examen Maquinas Electricas 1Documento1 páginaExamen Maquinas Electricas 1juanchofercho20Aún no hay calificaciones
- Guía de Almacenamiento Fluido Envirotemp FR3Documento38 páginasGuía de Almacenamiento Fluido Envirotemp FR3Felipe Hernandez100% (1)
- EXPOSICIÓN-02 Calentamiento GlobalDocumento4 páginasEXPOSICIÓN-02 Calentamiento Globalkaren kala yucraAún no hay calificaciones
- 11.4 Analisis Del Intercambiador de Calor. El Método E-NUTDocumento41 páginas11.4 Analisis Del Intercambiador de Calor. El Método E-NUTAnonymous vMzz6q3qAún no hay calificaciones
- Tipos de Generadores de Vapor Utilizados en La IndustriaDocumento8 páginasTipos de Generadores de Vapor Utilizados en La IndustriaAlanAún no hay calificaciones
- 1.7 Temperatura de Flama AdiabáticaDocumento6 páginas1.7 Temperatura de Flama Adiabáticajosellamas21100% (1)
- Medidas CorrectivasDocumento8 páginasMedidas CorrectivasFrancisco PerezAún no hay calificaciones
- 4.2 Balances de Materia, Energia y Exergia.Documento4 páginas4.2 Balances de Materia, Energia y Exergia.MIZRAIM JAZEL POLITO TENORIOAún no hay calificaciones
- Unidad2 Generadores de VaporDocumento11 páginasUnidad2 Generadores de VaporEliu ChavezAún no hay calificaciones
- U2 Combustión y Aplicación de Los Ciclos TermodinámicosDocumento22 páginasU2 Combustión y Aplicación de Los Ciclos TermodinámicosMiguel Steve Cena100% (1)
- Ahorro de Energía en Máquinas Térmicas.Documento30 páginasAhorro de Energía en Máquinas Térmicas.Dertio Acos Acos89% (9)
- ExergiaDocumento88 páginasExergiaDaniel ParrillaAún no hay calificaciones
- Conducción UnidireccionalDocumento3 páginasConducción UnidireccionalAlondra GallardoAún no hay calificaciones
- Ejemplo de Calculo de Aire Teórico en Una Reaccion de CombustibleDocumento4 páginasEjemplo de Calculo de Aire Teórico en Una Reaccion de CombustibleHector GuzmanAún no hay calificaciones
- Balance de Materia, Energía y ExergíaDocumento31 páginasBalance de Materia, Energía y ExergíaYosimar NC67% (3)
- Tarea Refrigeracion2Documento10 páginasTarea Refrigeracion2Guillermo PadillaAún no hay calificaciones
- Eficiencia Energetica de Los Ciclos Combinados ExposicionDocumento22 páginasEficiencia Energetica de Los Ciclos Combinados ExposicionElizabeth Alvarez100% (4)
- Grupo F... Resistencia Termica Cilindros y EsferasDocumento16 páginasGrupo F... Resistencia Termica Cilindros y EsferasFernando GodoyAún no hay calificaciones
- Pared Compuesta Termo LL FinalDocumento12 páginasPared Compuesta Termo LL FinalJank SuarezAún no hay calificaciones
- Ejercicios Unidad 1 (Equipos Térmicos 1)Documento9 páginasEjercicios Unidad 1 (Equipos Térmicos 1)André HinojosaAún no hay calificaciones
- Mezcla de Gases Ideales y Vapores Tema 3Documento33 páginasMezcla de Gases Ideales y Vapores Tema 3ADFDFG50% (2)
- Problemario Examen Final-Transferencia de Calor .Documento4 páginasProblemario Examen Final-Transferencia de Calor .Luis Vi llamar malvaezAún no hay calificaciones
- CombustiónDocumento32 páginasCombustiónRoddy Ignacio67% (3)
- Analisis de La Primera Ley de La Termodinamica en Un Compresor ReciprocanteDocumento1 páginaAnalisis de La Primera Ley de La Termodinamica en Un Compresor ReciprocanteCinthia Morales Rendon100% (1)
- 1 Ejercicios Entregables Cap. 1Documento9 páginas1 Ejercicios Entregables Cap. 1RICARDO ENRIQUE MENESES NIÑO100% (1)
- Ejer Cici OsDocumento7 páginasEjer Cici OsVictor Timana SilvaAún no hay calificaciones
- Intercambio de Calor Por Radiación Entre Superficies GrisesDocumento10 páginasIntercambio de Calor Por Radiación Entre Superficies GrisesJafet Carmine FinixAún no hay calificaciones
- Texto 4Documento18 páginasTexto 4Bryan LoaizaAún no hay calificaciones
- 2.3 Motores DieselDocumento3 páginas2.3 Motores DieselRodrigo Tito ConchaAún no hay calificaciones
- Intercambiadores de Calor CompactosDocumento5 páginasIntercambiadores de Calor CompactosRonald FrankieAún no hay calificaciones
- ConvencioneDocumento6 páginasConvencioneDiamante Hernandez MeridaAún no hay calificaciones
- Taller Sistemas Cerrados. Tema 4 PDFDocumento4 páginasTaller Sistemas Cerrados. Tema 4 PDFAna Melissa Ortiz MuñozAún no hay calificaciones
- Mezclas de GasesDocumento4 páginasMezclas de Gasesdomingo osorioAún no hay calificaciones
- Ciclo BraytonDocumento13 páginasCiclo BraytonFrank Olano Castro80% (5)
- Sin GeneracionDocumento9 páginasSin GeneracionFroi CadeAún no hay calificaciones
- Deber FinalDocumento25 páginasDeber FinalAlexMiguel0% (1)
- Consideraciones de PotenciaDocumento20 páginasConsideraciones de PotenciaMiguel AngelAún no hay calificaciones
- Las Condiciones de Diseño para Las Principales Ciudades de MéxicoDocumento8 páginasLas Condiciones de Diseño para Las Principales Ciudades de Méxicokevinmc 181Aún no hay calificaciones
- PROBLEMAS DE Ciclos de PotenciaDocumento6 páginasPROBLEMAS DE Ciclos de PotenciaCristian GuijarroAún no hay calificaciones
- Análisis de La Primera y Segunda Ley de La Termodinámica en Sistemas Reactivos PDFDocumento4 páginasAnálisis de La Primera y Segunda Ley de La Termodinámica en Sistemas Reactivos PDFNeftaly EsquivelAún no hay calificaciones
- Flama Adiabatica ResumenDocumento2 páginasFlama Adiabatica Resumenfernandoalex16Aún no hay calificaciones
- Cap 10Documento4 páginasCap 10Jonnathanthan JmAlAún no hay calificaciones
- Maquinas y Equipos Termicos Unidad 1.ppsDocumento75 páginasMaquinas y Equipos Termicos Unidad 1.ppsVictor Manuel Montaño Aguilar0% (1)
- InvestigacionDocumento26 páginasInvestigacionAnaluz Peralta Amador67% (3)
- CombustionDocumento17 páginasCombustionFulk UlisesAún no hay calificaciones
- Balances de Materia en Procesos de CombustionDocumento9 páginasBalances de Materia en Procesos de CombustionAnonymous m7B7PVUh100% (1)
- TEMA 3 Quimica y Calor de CombustionDocumento18 páginasTEMA 3 Quimica y Calor de CombustionVictor Antonio Ordenes GonzalezAún no hay calificaciones
- Edoc - Pub - Combustion Ucsm 2010 CFB PDFDocumento110 páginasEdoc - Pub - Combustion Ucsm 2010 CFB PDFANTHONY PERCY INGA HUANCAAún no hay calificaciones
- UNIDAD I Tecsup-SoldaduraDocumento30 páginasUNIDAD I Tecsup-Soldadurajuanchofercho20Aún no hay calificaciones
- Cadena de Valor de Diferentes Epresas.Documento32 páginasCadena de Valor de Diferentes Epresas.Jose Miguel Paredes LajoAún no hay calificaciones
- Cadena de Valor de Diferentes Epresas.Documento32 páginasCadena de Valor de Diferentes Epresas.Jose Miguel Paredes LajoAún no hay calificaciones
- RealimentaciónDocumento29 páginasRealimentaciónHenry H. Huaman GarcíaAún no hay calificaciones
- Calculo Longitud de La CatenariaDocumento1 páginaCalculo Longitud de La Catenariajuanchofercho20Aún no hay calificaciones
- Sesion 2Documento43 páginasSesion 2juanchofercho20Aún no hay calificaciones
- Maquina Sincrona en Estado TransitorioDocumento15 páginasMaquina Sincrona en Estado TransitorioJaime ContrerasAún no hay calificaciones
- Sesion 1Documento62 páginasSesion 1juanchofercho20Aún no hay calificaciones
- Tema A Examen Fase 1transferencia de Calor 2012Documento4 páginasTema A Examen Fase 1transferencia de Calor 2012juanchofercho20Aún no hay calificaciones
- Informe Tecnico 2Documento44 páginasInforme Tecnico 2juanchofercho20Aún no hay calificaciones
- Tema A Examen Fase 1transferencia de Calor 2012Documento4 páginasTema A Examen Fase 1transferencia de Calor 2012juanchofercho20Aún no hay calificaciones
- Mecánica de FracturasDocumento242 páginasMecánica de FracturasJosé Miguel LO100% (3)
- Examen Maquinas Electricas 1 2008Documento2 páginasExamen Maquinas Electricas 1 2008juanchofercho20Aún no hay calificaciones
- Circuitos Electronicos 2 Logica Secuencial UcsmDocumento14 páginasCircuitos Electronicos 2 Logica Secuencial Ucsmjuanchofercho20Aún no hay calificaciones
- Turbomaquinas - Turbinas If - Garcia Perez - FieeDocumento147 páginasTurbomaquinas - Turbinas If - Garcia Perez - Fieejuanchofercho20100% (2)
- Examen de Circ Electricos II UcsmDocumento11 páginasExamen de Circ Electricos II Ucsmjuanchofercho20100% (2)
- Parte Del Examen de Circ Electricos II UcsmDocumento1 páginaParte Del Examen de Circ Electricos II Ucsmjuanchofercho20Aún no hay calificaciones
- Diseño Digital - Morris Mano - en Español PDFDocumento349 páginasDiseño Digital - Morris Mano - en Español PDFEdGar PalmerosAún no hay calificaciones
- Ciencia, Tecnología Y Sociedad - Clase 1: Eichhornia CrassipesDocumento9 páginasCiencia, Tecnología Y Sociedad - Clase 1: Eichhornia CrassipesCCJAún no hay calificaciones
- TRabajo Del LitioDocumento25 páginasTRabajo Del LitioCristian Palma TapiaAún no hay calificaciones
- Cuestionario Chemical Engineering Quizz 2Documento3 páginasCuestionario Chemical Engineering Quizz 2Piripitiflautico LeoAún no hay calificaciones
- Practica de Contaminacion AmbientalDocumento12 páginasPractica de Contaminacion AmbientalAddy Pujols100% (1)
- Texto Una Reforma Energética para La Supervivencia de La Vida en La TierraDocumento14 páginasTexto Una Reforma Energética para La Supervivencia de La Vida en La TierraRaúl AlvaAún no hay calificaciones
- Segunda Actividad.Documento9 páginasSegunda Actividad.JUAN DE RAMIREZ RIVERAAún no hay calificaciones
- Msds Barniz Ther-O-Core InterpaintDocumento3 páginasMsds Barniz Ther-O-Core InterpaintErik Evans SaraviaAún no hay calificaciones
- Ejercicios Pendientes FyQ 1ºbachDocumento6 páginasEjercicios Pendientes FyQ 1ºbachVanesa SÁlvarAún no hay calificaciones
- Shell Mysella S5 S 40Documento20 páginasShell Mysella S5 S 40juanmanuel_4615958Aún no hay calificaciones
- Cuestionario Tipo Icfes de QuimicaDocumento19 páginasCuestionario Tipo Icfes de QuimicaSebastian Dulcey LopezAún no hay calificaciones
- HDS Gas Licuado de Petroleo.Documento10 páginasHDS Gas Licuado de Petroleo.Cristian Romero0% (1)
- S11.s2 - Ejercicios Adicionales para Repaso de PC2 QG - 2021Documento12 páginasS11.s2 - Ejercicios Adicionales para Repaso de PC2 QG - 2021ximena de la cruzAún no hay calificaciones
- Evaluacion y Optimizacion de Ventilacion en Mina-Quispe LazoDocumento30 páginasEvaluacion y Optimizacion de Ventilacion en Mina-Quispe LazoPaúl Irvin De La Cruz SaldañaAún no hay calificaciones
- Informe de Laboratorio N 6Documento13 páginasInforme de Laboratorio N 6lee0% (1)
- Cuadro Comparativo de Los Diferentes Tipos de Emisiones AtmosfericasDocumento3 páginasCuadro Comparativo de Los Diferentes Tipos de Emisiones AtmosfericasBeto OsorioAún no hay calificaciones
- Transportes y Medio AmbienteDocumento8 páginasTransportes y Medio AmbienteAna Isabel Andrade CedeñoAún no hay calificaciones
- ADITIVOS DE CombustibleDocumento10 páginasADITIVOS DE CombustibleBrandon UscaAún no hay calificaciones
- Manual de Operaciones de Tanque CorneliusDocumento15 páginasManual de Operaciones de Tanque Corneliusgagter18Aún no hay calificaciones
- Problemas de Combustion 2016Documento7 páginasProblemas de Combustion 2016Santiago GranoblesAún no hay calificaciones
- Presentación Espacios Confinados. DINPRODocumento97 páginasPresentación Espacios Confinados. DINPROLeidy Zapata AmarilesAún no hay calificaciones
- Intoxicación Por GasesDocumento8 páginasIntoxicación Por GasesNilda fernandezAún no hay calificaciones
- Consecuencias Del Calentamiento GlobalDocumento42 páginasConsecuencias Del Calentamiento GlobalRosa SucasacaAún no hay calificaciones
- Normas ANSI para Marcado de TuberíasDocumento5 páginasNormas ANSI para Marcado de TuberíasBraulio Samayoa OchoaAún no hay calificaciones
- Final Termodinamica PDFDocumento38 páginasFinal Termodinamica PDFRocío Minguillon JacobAún no hay calificaciones
- DS Agorex 60Documento2 páginasDS Agorex 60Evelyn MejíasAún no hay calificaciones
- Preguntas Shulas FUNVIVEDocumento7 páginasPreguntas Shulas FUNVIVEJeferson AquinoAún no hay calificaciones
- La Atmósfera Actúa de Abrigo para Que El Calor Que Nos Llega Del SolDocumento4 páginasLa Atmósfera Actúa de Abrigo para Que El Calor Que Nos Llega Del SolOrlando Pérez VargasAún no hay calificaciones