Documentos de Académico
Documentos de Profesional
Documentos de Cultura
UNIDAD I ESTRUCTURA DEL +üTOMO
Cargado por
FranciscoSalazar0 calificaciones0% encontró este documento útil (0 votos)
8 vistas19 páginasTítulo original
UNIDAD I ESTRUCTURA DEL +üTOMO
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PPTX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
8 vistas19 páginasUNIDAD I ESTRUCTURA DEL +üTOMO
Cargado por
FranciscoSalazarCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 19
1.1 Describir el modelo cuntico del tomo.
1.2 Explicar los diferentes tipos de enlaces qumicos.
1.3 Describir los grupos funcionales.
1.4 Explicar las diferentes unidades para expresar la concentracin de una solucin.
1.5 Explicar el fenmeno de difusin.
1.6 Describir las caractersticas del estado coloidal.
1.7 Explicar los fenmenos de tensin superficial y viscosidad.
1.8 Describir la composicin qumica de la materia viviente.
1.9 Definir bioqumica.
1.10 Describir las principales ramas de la bioqumica.
1.1) Describir el modelo cuntico del tomo.
La unidad fundamental de la materia es el tomo, una partcula muy pequea, a su vez
constituida por subpartculas: protn (carga positiva), neutrn (no tiene carga) y electrn (carga
negativa). Los protones y neutrones se localizan en el ncleo del tomo, en el que se concentra
casi toda su masa. Los electrones se encuentran alrededor de ste en los orbitales atmicos
(zonas que rodean al ncleo donde existe la mayor probabilidad de encontrar electrones).
Para cada tomo concreto existe un nmero definido de orbitales que se caracterizan por
poseer una determinada energa potencial. Sin profundizar en las matemticas, cada orbital
queda definido por tres nmeros, llamados nmeros cunticos:
Nmero cuntico principal (representado por la letra n) describe el tamao y la energa del
orbital. A medida que aumenta su tamao, lo hace su energa y su distancia al ncleo.
Nmero cuntico acimutal (representado por la letra l) representa un subnivel de energa y
define la forma geomtrica del orbital (esfrico, lobulado, etc.). Se representan con las letras s,
p, d y f.
Nmero cuntico magntico (representado por la letra m) define la orientacin en el espacio si
se fijan unos ejes de referencia arbitrarios (x, y, z).
En condiciones normales, los tomos no presentan carga neta: su nmero de protones y
electrones es el mismo. Existen tomos cargados (iones) con una diferencia de carga. Si
pierden electrones, los tomos presentan mayor nmero de protones que de electrones y su
carga ser positiva (cationes); y, si los ganan, tendrn mayor nmero de electrones que de
protones (aniones)
Cada elemento qumico est formado por un tipo de tomo que se diferencia en el nmero de
protones presentes en el ncleo (nmero atmico). Este nmero atmico define a cada
elemento. Sin embargo, un mismo elemento puede variar en su nmero de neutrones, lo que
determina la existencia de istopos, que son distintas formas atmicas de un mismo elemento
que se diferencian en su masa.
ENLACE QUMICO: Unin qumica entre dos tomos enlazados, considerando las interacciones
entre los electrones de valencia de enlazamiento qumico.
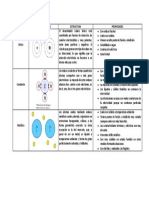
1.2) Explicar los diferentes tipos de enlaces qumicos.
ENLACE
QUMICO
INICO
COVALENTE
PUENTE DE HIDRGENO
FUERZA DE VANDERWALS
Se produce entre dos tomos cuando uno de ellos pierde un electrn quedando
cargado positivamente, y el otro gana un electrn resultando ser cargado negativamente; stos
tomos se atraen por fuerzas electrostticas y forman compuestos inicos.
Se produce cuando dos tomos enlazados comparten 1, 2 y hasta 3 pares de
electrones de enlace. El enlace covalente es la unin entre tomos en donde se da un
compartimiento de electrones.
Es una atraccin que existe entre un tomo de hidrgeno (carga positiva) con un
tomo de O, N o X (halgeno) que posee un par de electrones libres (carga negativa).
Son fuerzas de estabilizacin molecular; forman un enlace qumico no covalente en el
que participan dos tipos de fuerzas o interacciones, las fuerzas de dispersin (que son fuerzas de
atraccin) y las fuerzas de repulsin entre las capas electrnicas de 2 tomos contiguos.
ENLACE COVALENTE
PUENTE DE HIDRGENO
FUERZA DE
VANDERWALS
Son estructuras submoleculares, caracterizadas por una conectividad y
composicin especfica elemental, que confiere reactividad a la molcula que los contiene.
1.3) Describir los grupos funcionales.
un sistema material homogneo, monofsico, formado por dos componentes
como mnimo, el que se encuentra en menor cantidad, se llama soluto y el que se
encuentra en mayor cantidad, solvente o disolvente.
1.4) Explicar las diferentes unidades para expresar la concentracin de una
solucin.
preparado lquido homogneo de cualquier sustancia disuelta en
agua.
LA CONCENTRACIN DE UNA SOLUCIN expresa la cantidad de soluto presente en una
cantidad de solvente o de solucin. en trminos cuantitativos, esto es, la relacin o proporcin
matemtica entre la cantidad de soluto y la cantidad de solvente o, entre soluto y solucin.
esta relacin suele expresarse en porcentaje.
Fsicas
Qumicas
% referido a la masa
% referido al volumen
% masa volumen
Partes por milln
Molaridad
Normalidad
Molalidad
Fraccin molar
Unidades
qumicas
1.5) Explicar el fenmeno de difusin.
Se produce cuando una solucin acuosa se separa del agua pura con una membrana que es
permeable tanto para el agua como para los solutos, stos salen de la solucin an cuando el
agua entra. las molculas se mueven al azar, o se difunden, hasta que la concentracin de
soluto es la misma a ambos lados de la membrana. en este punto se establece el equilibrio, o
sea, ya no hay un flujo neto de agua o soluto.
1.6) Describir las caractersticas del estado coloidal.
UN COLOIDE, SISTEMA COLOIDAL, SUSPENSIN COLOIDAL O DISPERSIN COLOIDAL es un
sistema formado por dos o ms fases, principalmente: una continua, normalmente fluida, y
otra dispersa en forma de partculas; por lo general slidas. La fase dispersa es la que se halla
en menor proporcin. Normalmente la fase continua es un lquido, pero pueden encontrarse
coloides cuyos componentes se encuentran en otros estados de agregacin.
CARACTERSTICAS:
Incapacidad para formar estructuras ordenadas.
Sus partculas no pueden ser observadas.
Tanto la fase dispersa como el medio en el que se produce la dispersin pueden ser
solido liquido gaseoso.
Su difusin es lenta en los medios de dispersin.
Las entidades dispersas son mucho mayores que las molculas del disolvente
Son contaminantes.
Presentan determinada viscosidad.
. La TENSIN SUPERFICIAL de un lquido est
asociada a la cantidad de energa necesaria para
aumentar su superficie por unidad de rea.
Es causada por los efectos de las fuerzas
intermoleculares que existen en la interfase. Depende
de la naturaleza del lquido, del medio que le rodea y
de la temperatura. Lquidos cuyas molculas tengan
fuerzas de atraccin intermoleculares fuertes tendrn
tensin superficial elevada.
1.7) Explicar los fenmenos de tensin superficial y viscosidad.
LA VISCOSIDAD es la propiedad de un fluido que tiende a oponerse a su flujo
cuando se le aplica una fuerza. Los fluidos de alta viscosidad presentan una cierta resistencia
a fluir; los fluidos de baja viscosidad fluyen con facilidad.
La TENSIN SUPERFICIAL de un lquido est asociada a la cantidad de energa necesaria para
aumentar su superficie por unidad de rea.
Es causada por los efectos de las fuerzas intermoleculares que existen en la
interfase. Depende de la naturaleza del lquido, del medio que le rodea y de la temperatura.
Lquidos cuyas molculas tengan fuerzas de atraccin intermoleculares fuertes tendrn
tensin superficial elevada.
a) BIOELEMENTOS PRIMARIO, proporcin media del 96% en la materia viva, y son: H-O-C-N-S
y P.
b) BIOELEMENTOS SECUNDARIOS, que aparecen en una proporcin cercana al 3,3%. Son: Ca,
Na, K, Mg y Cl, y desempean funciones de vital importancia en fisiologa celular.
c) OLIGOELEMENTOS o micro constituyentes, que aparecen en la materia viva en proporcin
inferior al 0,1% y que tambin son esenciales para la vida: hierro, manganeso, cobre, zinc,
flor, yodo, boro, silicio, vanadio, cobalto, selenio, molibdeno y estao.
BIOMOLCULAS
1.8) Describir la composicin qumica de la materia viviente.
INORGNICOS: son aquellos que adems de encontrarse en los seres vivos se
encuentra en la materia inerte, son el agua y los sales minerales.
ORGNICOS: se hallan slo en los seres vivos o como resultado de su actividad,
cuyo enlace qumico principal es el carbono, son glcidos, lpidos, protenas y cidos
nucleicos.
Bioelementos presentes en el cuerpo
humano
Principales Bioelementos y Oligoelementos
presentes en el cuerpo humano
LA BIOQUMICA es la ciencia que estudia los componentes qumicos de los seres
vivos.
Su objetivo principal es la comprensin completa a nivel molecular de todos los procesos
relacionados con las clulas vivas. Pretende describir la estructura, la organizacin y las
funciones de la materia viva en trminos moleculares
1.9) Definir bioqumica.
BIOQUMICA DESCRIPTIVA: Estudia la naturaleza qumica de los componentes celulares.
BIOQUMICA DINMICA: Comprende los diversos aspectos del metabolismo, regulacin
qumica, y cambios estructurales que ocurren dentro de las clulas vivas.
1.10) Describir las principales ramas de la bioqumica.
BIOQUMICA
QUMICA ORGNICA
BIFISICA
INVESTIGACIN MDICA
NUTRICIN
MICROBIOLOGA
FISIOLOGA
BIOLOGA CELULAR
GENTICA
La bioqumica extrae sus principales temas de muchas disciplinas:
Qumica orgnica, que describe las propiedades de las biomolculas.
Biofsica, que aplica las tcnicas de la fsica al estudio de las estructuras de las
biomolculas.
Investigacin mdica, que intenta comprender los estados patolgicos en
trminos moleculares.
Nutricin, estudia el metabolismo mediante la descripcin de la necesidades
alimentarias para el mantenimiento de la salud.
Microbiologa, demuestra que los organismos unicelulares y los virus son
especialmente adecuados para la determinacin de muchas rutas metablicas y
mecanismos de regulacin.
Fisiologa, que investiga los procesos vitales a nivel tisular y del organismo.
Biologa celular, que describe la divisin bioqumica del trabajo en el interior de
una clula.
Gentica, que describe el mecanismo que proporciona a una determinada
clula u organismo su identidad bioqumica.
La bioqumica adquiere su fuerza de todas estas disciplinas y a cambio, las nutre
tambin.
También podría gustarte
- Cantos para EggunDocumento8 páginasCantos para EggunHathor_Isis90% (70)
- Rogaciones de VientreDocumento2 páginasRogaciones de VientreJosé Gregorio71% (7)
- El Oráculo Del DILOGÚN IndiceDocumento7 páginasEl Oráculo Del DILOGÚN IndiceFranciscoSalazarAún no hay calificaciones
- Definición de Los SentidosDocumento1 páginaDefinición de Los SentidosLeo KbreraAún no hay calificaciones
- Ponencia Disec3b1o de Un Horno de Fundicion de AluminioDocumento13 páginasPonencia Disec3b1o de Un Horno de Fundicion de AluminioDeivis Rojas HerreraAún no hay calificaciones
- Cuidados de Enfermeria en ArteriografiasDocumento6 páginasCuidados de Enfermeria en ArteriografiasGiovanni GabrielAún no hay calificaciones
- AladiDocumento12 páginasAladiFranciscoSalazarAún no hay calificaciones
- ArteriaDocumento7 páginasArteriaFranciscoSalazarAún no hay calificaciones
- Exorcism oDocumento5 páginasExorcism orantellaAún no hay calificaciones
- 218-2-2002 Proteccion de Radiaciones Ionizantes Usadas en MedicinaDocumento41 páginas218-2-2002 Proteccion de Radiaciones Ionizantes Usadas en MedicinaSandra TaboniAún no hay calificaciones
- Como Construir Una Fresadora Con ArduinoDocumento34 páginasComo Construir Una Fresadora Con ArduinoFranciscoSalazarAún no hay calificaciones
- Como Construir Una Fresadora Con ArduinoDocumento34 páginasComo Construir Una Fresadora Con ArduinoFranciscoSalazarAún no hay calificaciones
- Como Construir Una Fresadora Con ArduinoDocumento34 páginasComo Construir Una Fresadora Con ArduinoFranciscoSalazarAún no hay calificaciones
- Dima MangaDocumento20 páginasDima MangaFranciscoSalazarAún no hay calificaciones
- Solicitud Deposito Legal para Libros y FolletosDocumento2 páginasSolicitud Deposito Legal para Libros y FolletosFranciscoSalazarAún no hay calificaciones
- Test DiskDocumento8 páginasTest DiskFranciscoSalazarAún no hay calificaciones
- TutorialyguasparacrearcomandosybatchenmsdosparawindowsDocumento68 páginasTutorialyguasparacrearcomandosybatchenmsdosparawindowsJohnny QuispeAún no hay calificaciones
- FirmasDocumento26 páginasFirmasFranciscoSalazar100% (1)
- TutorialyguasparacrearcomandosybatchenmsdosparawindowsDocumento68 páginasTutorialyguasparacrearcomandosybatchenmsdosparawindowsJohnny QuispeAún no hay calificaciones
- TutorialyguasparacrearcomandosybatchenmsdosparawindowsDocumento68 páginasTutorialyguasparacrearcomandosybatchenmsdosparawindowsJohnny QuispeAún no hay calificaciones
- Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye BaleDocumento4 páginasEye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye Bale Eye BaleAlí BlancoAún no hay calificaciones
- Letras DiloggunDocumento88 páginasLetras DiloggunFranciscoSalazarAún no hay calificaciones
- HackingDocumento96 páginasHackingFranciscoSalazarAún no hay calificaciones
- Diloggun LetrasDocumento311 páginasDiloggun LetrasFranciscoSalazarAún no hay calificaciones
- Unidda II Aminoacidos y ProteinasDocumento27 páginasUnidda II Aminoacidos y ProteinasFranciscoSalazarAún no hay calificaciones
- UNIDAD X L+ìQUIDOS ORG+üNICOSDocumento14 páginasUNIDAD X L+ìQUIDOS ORG+üNICOSFranciscoSalazarAún no hay calificaciones
- Unidda II Aminoacidos y ProteinasDocumento27 páginasUnidda II Aminoacidos y ProteinasFranciscoSalazarAún no hay calificaciones
- Eggun y OshaDocumento2 páginasEggun y OshaFranciscoSalazar100% (1)
- Unidad Xi Nitrogeno No ProteicoDocumento12 páginasUnidad Xi Nitrogeno No ProteicoFranciscoSalazarAún no hay calificaciones
- Unidad Viii MineralesDocumento8 páginasUnidad Viii MineralesFranciscoSalazarAún no hay calificaciones
- Química Inorgánica Industrial Oxoborato PDFDocumento8 páginasQuímica Inorgánica Industrial Oxoborato PDFStiven Martinez GiraldoAún no hay calificaciones
- 3 Prob Enlace 2010-11Documento2 páginas3 Prob Enlace 2010-11Lorenzo R. RamirezAún no hay calificaciones
- Contenido Programático Quimica Ing. (CIV IND TEL MUL MEC) 2020 IIDocumento20 páginasContenido Programático Quimica Ing. (CIV IND TEL MUL MEC) 2020 IIkevin romeroAún no hay calificaciones
- Cuaderno Trabajo BioquimicaDocumento92 páginasCuaderno Trabajo BioquimicaVioleta RamírezAún no hay calificaciones
- Audiolibro - Guión.!!Documento39 páginasAudiolibro - Guión.!!Isabel SerratosAún no hay calificaciones
- Sílabo Cpu 2021-Ii QuimicaDocumento4 páginasSílabo Cpu 2021-Ii QuimicaFabricio Yucra becerraAún no hay calificaciones
- Evidencias Del Bloque V de Quimica 1Documento7 páginasEvidencias Del Bloque V de Quimica 1EUDALDOAún no hay calificaciones
- Informe de AlquenosDocumento8 páginasInforme de AlquenosLuis Córdova CoxAún no hay calificaciones
- Esquema de EnlaceDocumento8 páginasEsquema de EnlaceDanielAún no hay calificaciones
- Ciencias FARO 1Documento23 páginasCiencias FARO 1jairolgofbkAún no hay calificaciones
- Polimerización Catalizada Por MetalocenosDocumento11 páginasPolimerización Catalizada Por MetalocenosHideky Pantoja CabreraAún no hay calificaciones
- Enlaces QuímicosDocumento21 páginasEnlaces QuímicosDavid YungaAún no hay calificaciones
- Descripcion de La Materia VivaDocumento8 páginasDescripcion de La Materia VivaFERNANDOAún no hay calificaciones
- Práctica EnlaceDocumento3 páginasPráctica EnlaceArturo ZetaAún no hay calificaciones
- Cuadro Comparativo de QuimicaDocumento1 páginaCuadro Comparativo de QuimicaFernanda RomeroAún no hay calificaciones
- Foro de Ingeniería e Investigación en MaterialesDocumento8 páginasForo de Ingeniería e Investigación en MaterialesMax RiverAún no hay calificaciones
- Teorías Del Enlace MetálicoDocumento23 páginasTeorías Del Enlace Metálicocoreano63Aún no hay calificaciones
- Texto PolímerosDocumento204 páginasTexto PolímerosAlejandro MoscosoAún no hay calificaciones
- Póster Las Propiedades Químicas Doodle Infantil Violeta y BlancoDocumento2 páginasPóster Las Propiedades Químicas Doodle Infantil Violeta y BlancoRicardo AtehortúaAún no hay calificaciones
- Teoría de LewisDocumento5 páginasTeoría de LewisAlex Garcia RabadeAún no hay calificaciones
- Materiales CeramicosDocumento23 páginasMateriales Ceramicoslord_helix_hell666Aún no hay calificaciones
- Informe de Tecnología de Los MaterialesDocumento97 páginasInforme de Tecnología de Los MaterialesNarjax100% (1)
- Pca Quimica Organica (1) 2020 TercerosDocumento8 páginasPca Quimica Organica (1) 2020 TercerosNoemi BarrosAún no hay calificaciones
- Quimica Del PetroleoDocumento9 páginasQuimica Del PetroleoRojo AviadorAún no hay calificaciones
- Seminario Refor Jaime Peña 2Documento1 páginaSeminario Refor Jaime Peña 2Jaime Peña ChinchayAún no hay calificaciones
- Unidad 2. Estructura Atómica y Enlaces IIDocumento29 páginasUnidad 2. Estructura Atómica y Enlaces IIperezlobito2.0Aún no hay calificaciones
- Mapa Mental Del Enlace MetálicoDocumento2 páginasMapa Mental Del Enlace MetálicoNorma Antonella LGAún no hay calificaciones
- 11CNLL 023Documento24 páginas11CNLL 023Melvin Armando CamposAún no hay calificaciones
- Silabo Del Curso Química InorgánicaDocumento3 páginasSilabo Del Curso Química InorgánicaMavi MagdielAún no hay calificaciones