Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Guía Nomenclatura
Cargado por
Danny GonzalezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Guía Nomenclatura
Cargado por
Danny GonzalezCopyright:
Formatos disponibles
Colegio Nacional de Buenos Aires
Nomenclatura básica
de
compuestos inorgánicos
Tercer y Cuarto Año
Guía de Nomenclatura de compuestos inorgánicos
Página 1 de 11
Colegio Nacional de Buenos Aires – Departamento de Química
Nomenclatura básica
de compuestos inorgánicos
Actualización junio 2018. Ajustado a las últimas recomendaciones de la IUPAC
Departamento de Química – Colegio Nacional de Buenos Aires
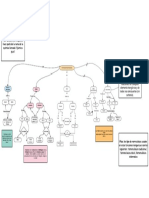
Los compuestos químicos inorgánicos pueden clasificarse, teniendo en cuenta su composición y propie-
dades, en las siguientes familias.
Según la cantidad de Según el tipo de
elementos se los clasifica en: elemento se los clasifica en:
Óxidos básicos
Son
compuestos
Hidruros básicos iónicos
Sales binarias
Binarios
Óxidos ácidos
Son
compuestos
Comp. hidrogenados covalentes
Compuestos Comp. No hidrogenados
químicos
inorgánicos
Hidróxidos
Ternarios Oxoácidos
Oxosales
Sales ácidas
Cuaternarios
Sales básicas
Además de estos existen otros compuestos como los óxidos anfóteros, neutros, peróxido, superóxidos,
etc. que por cuestión de simplicidad no se agregaron en este esquema.
El estudio de este capítulo se centrará en: - Clasificar los compuestos inorgánicos.
- Aplicar las reglas básicas para su formulación.
- Nombrarlos según las distintas nomenclaturas.
Nomenclaturas Químicas
Para establecer el nombre de los compuestos tenemos actualmente tres tipos de nomenclaturas:
- Nomenclatura tradicional: Es una de las más antiguas y difundidas.
- Nomenclatura de numerales de stock: Es más actual y sistemática. Tiene mayor alcance y aplicación
que la tradicional.
- Nomenclatura de atomicidad: Denominada también “estequiométrica”. Es la más simple y si bien
permite nombrar todos los compuestos en la actualidad se la aplica a un pequeño número de estos,
como los óxidos ácidos.
Guía de Nomenclatura de compuestos inorgánicos
Página 2 de 11
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
COMPUESTOS IÓNICOS BINARIOS
Óxidos básicos: Se forman por combinación entre un metal y oxígeno, generalmente presentan uniones
iónicas. Los óxidos básicos abundan en la naturaleza. Por ejemplo, el óxido de calcio (fórmula CaO) es
conocido como cal viva, compuesto de gran importancia en la construcción.
Para escribir la fórmula de un óxido debemos tener en cuenta los números de oxidación de los elementos
que forman el compuesto, el del oxigeno es -2, y el del metal varía según la naturaleza de este. Los metales
alcalinos poseen número de oxidación +1, por lo tanto, los óxidos que resultan de estos metales tienen
fórmula general X2O (donde X es cualquier metal alcalino y el subíndice 2 indica la cantidad de átomos del
metal que se combinan con el oxígeno para formar un compuesto neutro “sin cargas”).
Los metales alcalinotérreos poseen número de oxidación +2, por lo que los óxidos que resultan de estos
metales tienen fórmula general XO (donde X es cualquier metal alcalino-térreo).
El aluminio posee número de oxidación +3, los óxidos de éste metal poseen una fórmula Al 2O3 . (Este
compuesto, como todos los que resultan de la combinación del oxígeno con un metal que este ubicado
cerca de la línea de los no metales, presenta comportamiento anfótero).
El resto de los metales presentan generalmente dos números de oxidación, formando entonces dos óxidos
de ese metal, pero de distinta fórmula. Por ejemplo, el hierro presenta los siguientes números de oxidación:
+2 y +3, y las fórmulas de estos óxidos son: FeO y Fe2O3.
Para establecer el nombre de estos compuestos se utilizan principalmente dos nomenclaturas. Una mo-
derna (denominada de numerales de Stock) y una antigua (denominada tradicional). La nomenclatura
moderna es la recomendada por la IUPAC (siglas provenientes de “Internacional Union of Pura and Applied
Chemistry).
Por ambas nomenclaturas, para nombrar un óxido debemos tener en cuenta el número de oxidación del
metal que lo forma. Cuando el metal presenta un único número de oxidación, se antepone “óxido de” al
nombre del metal. Por ejemplo: Na 2O óxido de sodio, K2O óxido de potasio, MgO óxido de magnesio, CaO
óxido de calcio, Al2O3 óxido de aluminio. Cuando el metal que forma el óxido tiene dos números de
oxidación, la nomenclatura recomendada por la IUPAC establece que para nombrarlo se antepone “óxido
de” se nombra el metal y luego se indica el número de oxidación de este, entre paréntesis y con números
romanos.
Ejemplo:
El hierro presenta dos números de oxidación +2 y +3, formando dos óxidos distintos: el FeO y Fe2O3 ,
entonces utilizando la nomenclatura moderna los nombres serían:
FeO óxido de hierro (II) y Fe2O3 óxido de hierro (III)
Otro ejemplo. El cobre tiene dos números de oxidación +1 y +2, formando entonces dos óxidos básicos.
El Cu2O con número de oxidación +1 y el CuO con +2.
Utilizando la nomenclatura de numerales de Stock (recomendada por la IUPAC) los nombres serían:
Cu2O óxido de cobre (I) y CuO óxido de cobre (II)
La nomenclatura tradicional establece que para nombrar un óxido básico donde el metal presenta varios
números de oxidación, se antepone la palabra “óxido” y luego se nombra la raíz del metal utilizando la
terminación “oso” cuando en metal actúa con el número de oxidación más pequeño y la terminación “ico”
cuando el metal actúa con el número de oxidación más grande.
Utilizando esta nomenclatura los dos óxidos del hierro serían:
FeO óxido ferroso
Fe2O3 óxido férrico
En el caso del cobre:
Cu2O óxido cuproso
CuO óxido cúprico
Guía de Nomenclatura de compuestos inorgánicos
Página 3 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
ACTIVIDAD Nº 1:
I) Indique el nombre de los siguientes óxidos: a) Li2O b) BaO c) ZnO d) NiO
II) Complete, basándose en el primer ejemplo, parte de segundo y la tabla de la pág. 15
Fórmula del compuesto Nombre tradicional Nombre moderno
FeO Óxido ferroso Óxido de hierro (II)
PbO Óxido plumboso
PbO2
Hg2O
Óxido mercúrico
En la página 16 encontrarán las respuestas de todas las actividades propuestas
FORMACIÓN DE ÓXIDOS BÁSICOS: Estos compuestos se forman, generalmente, por reacción química
entre un metal y oxígeno.
Metal + Oxígeno → Óxido básico
Nomenclatura de atomicidad en óxidos básicos
Si bien, prácticamente, ya no se utiliza para los óxidos básicos, sigue vigente para los que se detallan a
continua- ción y algunos otros más:
MnO2 dióxido de manganeso V2O5 pentóxido de vanadio TiO2 dióxido de titanio
Peróxido de sodio Un óxido muy utilizado
El sodio forma dos óxidos: óxido de sodio El óxido de calcio, cal o cal viva, es un compuesto
Na2O y peróxido de sodio Na2O2, pero esto químico de fórmula CaO. Reacciona violentamente con el
no significa que el sodio tenga dos estados agua, haciendo que ésta alcance los 90°C. Se forma
de oxidación, pues en ambos compuestos entonces hidróxido de calcio, también llamado cal
su valor es +1. El peróxido se prepara apagada, de fórmula Ca(OH)2.
calentando sodio en un exceso de aire u Se ha usado, desde la más remota antigüedad, de
oxígeno (exento de humedad y dióxido de conglomerante en la construcción; también para pintar
carbono) a una temperatura de 300-400°C. (encalar) muros y fachadas de los edificios construidos
Debido a su potencial oxidante se emplea con adobes o tapial. En algunos países, la cal se utiliza
para blanquear la pasta de madera en la en el proceso para hacer sémola de maíz y masa para
producción de papel. tortillas.
El óxido de sodio puede prepararse La cal produce irritaciones severas si es inhalada o si
calentando una mezcla de sodio y peróxido entra en contacto con piel húmeda o los ojos. Su
de sodio. inhalación puede causar tos, estornudos, y respiración
anormal.
Hidruros metálicos: En este tipo de compuestos el hidrógeno actúa con número de oxidación negativo.
Las reglas de nomenclatura son similares a la de los óxidos básicos. Si el metal posee un único número de
oxidación las dos nomenclaturas son idénticas, se antepone “hidruro de” y se menciona el metal.
Ejemplos: NaH hidruro de sodio KH hidruro de potasio CaH2 hidruro de calcio
Si el metal posee dos números de oxidación se utilizan los sufijos “oso” o “ico” en la nomenclatura tradi-
cional y los números romanos en la nomenclatura de numerales de Stock.
Ejemplos:
Fórmula del compuesto Nombre por nomenclatura Nombre por nomenclatura de
tradicional numerales de Stock
FeH2 Hidruro ferroso Hidruro de hierro (II)
FeH3 Hidruro férrico Hidruro de hierro (III)
CuH Hidruro cuproso Hidruro de cobre (I)
CuH2 Hidruro cúprico Hidruro de cobre (II)
Guía de Nomenclatura de compuestos inorgánicos
Página 4 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
ACTIVIDAD Nº 2: I) Nombre: a) MgH2 b) GaH3 c) PbH2
II) Escriba la fórmula de los siguientes hidruros:
a) Hidruro de rubidio c) Hidruro cobáltico e) Hidruro mercúrico
b) Hidruro manganoso d) Hidruro cromoso f) Hidruro de aluminio
FORMACIÓN DE HIDRUROS METÁLICOS: Estos compuestos se forman, generalmente, por reacción
química entre un metal e hidrógeno.
Metal + Hidrógeno → Hidruro metálico
Los hidruros metálicos y el inicio de las baterías sin efecto memoria
Si bien en la actualidad la mayoría de los dispositivos electrónicos portátiles usan baterías de ion litio, en la década
del 90 surgieron unas baterías denominadas Mi-MH (Níquel-Hidruro Metálico) que marcaron antes y un después en
la historia de las baterías. Fueron las primeras que menos se veían afectadas por el llamado efecto memoria, en el
que en cada recarga se limita el voltaje o la capacidad, imposibilitando el uso de toda su energía.
Fuente: https://es.wikipedia.org/wiki/Bater%C3%ADa_de_n%C3%ADquel-metal_hidruro
Sales binarias: Son compuestos iónicos muy abundantes en la naturaleza. Están constituidas por un metal
y un no metal (excepto hidrógeno y oxígeno). En solución acuosa liberan cationes metálicos y aniones no
metálicos. Desde el punto de vista de su composición, la diferencia con respecto a los hidrácidos es que las
sales binarias contienen un catión metálico y los hidrácidos hidrógeno. Generalmente los aniones son no
metales del grupo 17 o 16.
Si el no metal es del grupo 17 actúa con número de oxidación -1 y si es del grupo 16 con -2.
Para nombrar una sal se utiliza la nomenclatura tradicional o la de numerales de Stock. Si el metal posee
un único número de oxidación se menciona primero el no metal con la terminación “uro” y seguido el nom-
bre del metal.
Ejemplos:
NaCl cloruro de sodio KCl cloruro de potasio CaCl 2 cloruro de calcio
AlCl3 cloruro de aluminio NaBr bromuro de sodio CaS sulfuro de calcio
Na2S sulfuro de sodio
Si el metal presenta varios números de oxidación, para nombrarlo por la nomenclatura moderna, se men-
ciona el no metal igual que en los casos anteriores y luego el metal aclarando el número de oxidación en-tre
paréntesis y en números romanos.
Ejemplo: el hierro posee dos números de oxidación +2 y +3, cuando se combina con el cloro forma dos ti-
pos de sales: FeCl2 y FeCl3 Utilizando la nomenclatura moderna los nombres de estas sales serían:
FeCl2 cloruro de hierro (II) y FeCl 3 cloruro de hierro (III)
Utilizando nomenclatura tradicional se menciona primero el no metal de igual manera y luego la raíz del
metal agregando el sufijo “oso” o “ico” ya explicados anteriormente.
En el ejemplo del hierro, los nombres serían: FeCl 2 cloruro ferroso y FeCl3 cloruro férrico
ACTIVIDAD Nº 3: I) Nombre: a) NaI b) ZnCl 2 c) MgCl2 d) BaS
II) Complete, basándose en el primer ejemplo y en la tabla de la página 15.
Fórmula del compuesto Nombre tradicional Nombre moderno
FeCl2 Cloruro ferroso Cloruro de hierro (II)
CuCl2
PbCl2
Bromuro niqueloso
PbS
PbI2
Cloruro cobaltoso
Cloruro crómico
Guía de Nomenclatura de compuestos inorgánicos
Página 5 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
Cloruro de sodio. La sal más conocida
Popularmente denominada sal común, sal de mesa, es un compuesto químico de fórmula NaCl. El cloruro de sodio
es una de las sales responsable de la salinidad del océano y del fluido extracelular de muchos organismos. También
es el mayor componente de la sal comestible, es comúnmente usada como condimento y conservante de comida.
El cloruro de sodio es producido en masa por la evaporación de agua de mar o salmuera de otros recursos, como
lagos salados y minando la roca de sal, llamada halita.
FORMACIÓN DE SALES BINARIAS: Se pueden obtener por diversos métodos, siendo los dos más im-
portantes para nuestro estudio los que se detallan a continuación.
• Por reacción de síntesis entre un metal y un no metal (excepto hidrógeno u oxígeno).
Metal + No metal → Sal binaria
• Por reacción de neutralización entre un hidrácido y un hidróxido. (Este mecanismo será analizado
luego de estudiar los hidróxidos).
Hidrácido + Hidróxido → Sal binaria + Agua
COMPUESTOS COVALENTES BINARIOS
Óxidos ácidos: Son compuestos covalentes que están formados por un no metal y oxígeno. Por mucho
tiempo de los llamó anhídridos, pero las nomenclaturas actuales son la recomendada por la IUPAC (nu-
merales de Stock) y la de atomicidad, no se utiliza actualmente la nomenclatura tradicional en este tipo de
compuestos.
Uno de los más nombrados últimamente es el CO 2 dióxido de carbono (nomenclatura de atomicidad) anti-
guamente denominado anhídrido carbónico. Por nomenclatura de numerales de Stock, este compuesto, se
denomina óxido de carbono (IV), ya que el carbono actúa con número de oxidación + 4.
En la nomenclatura de atomicidad se antepone prefijos griegos que hacen mención de los subíndices: 1
(mono). 2 (di o bi), 3 (tri), 4 (tetra), 5 (penta) y en esta nomenclatura no se tienen en cuenta los números
de oxidación.
Ejemplos:
Fórmula del compuesto Nombre por nomenclatura de Nombre por nomenclatura de
atomicidad numerales de Stock (IUPAC)
SO Monóxido de azufre Óxido de azufre (II)
SO2 Dióxido de azufre Óxido de azufre (IV)
SO3 Trióxido de azufre Óxido de azufre (VI)
NO Monóxido de nitrógeno Óxido de nitrógeno (II) *
N2O3 Trióxido de dinitrógeno Óxido de nitrógeno (III)
N2O5 Pentóxido de dinitrógeno Óxido de nitrógeno (V)
NO2 Dióxido de nitrógeno Óxido de nitrógeno (IV) *
N2O Monóxido de dinitrógeno Óxido de nitrógeno (I) *
P2O3 Trióxido de difósforo Óxido de fósforo (III)
* En muchos óxidos ácidos los no metales actúan con números de oxidación no tan comunes, como es el caso del nitrógeno en
los ejemplos marcados.
Si el no metal presenta un único número de oxidación, no es necesario indicarlo en la nomenclatura Stock.
ACTIVIDAD Nº 4: I) Nombre: a) TeO2 b) P2O5 c) SeO2
II) Escriba la fórmula de:
a) óxido de dicloro b) dióxido de silicio c) pentóxido de dibromo
FORMACIÓN DE ÓXIDOS ÁCIDOS: Estos compuestos se forman, generalmente, por reacción química
entre un no metal y oxígeno.
No metal + Oxígeno → Óxido ácido
Guía de Nomenclatura de compuestos inorgánicos
Página 6 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
Ni ácidos ni básicos. Óxidos neutros
Por reacción con agua los óxidos básicos forman hidróxidos y los óxidos ácidos forman oxoácidos. Existe un grupo
pequeño de óxidos que no reaccionan con agua y, por lo tanto, no originan ni hidróxidos ni oxoácidos. Son deno-
minados óxidos neutros, entre ellos, está el monóxido de carbono (CO).
El monóxido de carbono es un gas inodoro, incoloro, inflamable y altamente tóxico. Puede causar la muerte cuando
se respira en niveles elevados. Se produce por la combustión incompleta de sustancias como gas, gasolina, carbón
o madera. Los vehículos detenidos con el motor encendido también lo despiden.
Peróxidos
Estos compuestos binarios se caracterizan por tener dos átomos de oxígeno unidos entre sí por medio
de una unión covalente simple. El número de oxidación del oxígeno en este tipo de compuestos es -1.
Ejemplo: H2O2 Peróxido de hidrógeno, conocido en solución acuosa como agua oxigenada.
Na2O2 Peróxido de sodio. Producto de la combustión del sodio
Compuestos no hidrogenados: Están formados por dos no metales, de los cuales ninguno es oxígeno ni
hidrógeno. La nomenclatura de atomicidad y la moderna son las más utilizadas para estos compuestos.
ACTIVIDAD Nº 5:
I) Indique el nombre de los siguientes compuestos:
a) CBr4 b) NCl3 c) CS2 d) PCl3
II) Escriba la fórmula de los siguientes compuestos:
a) Tetrafluoruro de silicio b) Tribromuro de arsénico c) Disulfuro de silicio
Compuestos hidrogenados: Constituidos por hidrógeno y un no metal. Se los divide en dos grupos.
● Formados por hidrógeno y un no metal del grupo 17 o 16 (con excepción del oxígeno).
● Formados por hidrógeno y un no metal del grupo 13, 14, 15 u oxígeno.
Los del primer grupo presentan características ácidas cuando se encuentra en solución acuosa. Por ese
motivo se los denomina hidrácidos. En estos compuestos el hidrógeno actúa con número de oxidación +1,
y el no metal con número negativo (-1 si es del grupo 17 y -2 si es del grupo 16).
Los del grupo 17 presentan las siguientes fórmulas: HF, HCl, HBr, HI y el más conocido del grupo 16: H 2S
Para nombrarlos se menciona primero el no metal (sin la última letra) se agrega la terminación “uro” y
luego se menciona “de hidrógeno”.
Ejemplos: HCl cloruro de hidrógeno HBr bromuro de hidrógeno H2S sulfuro de hidrógeno
Si el compuesto se encuentra en solución acuosa (“aq” o “ac”), se lo nombra de la siguiente manera. Se
antepone la palabra “ácido” luego se menciona el no metal con la terminación “hídrico”. Esta nomenclatura
solo es válida cuando el compuesto se encuentra en solución acuosa.
Ejemplos: HCl (aq) ácido clorhídrico H2S (aq) ácido sulfhídrico HBr (aq) ácido bromhídrico
CARACTERÍSTICAS DE LOS HIDRÁCIDOS: Un ácido es una sustancia que tiene hidrógeno y que en solución
acuosa libera cationes H+, (esta definición fue propuesta por Arrhenius a fines del siglo XIX, la tomaremos ini-
cialmente para explicar básicamente la composición de un ácido). Entonces podemos decir que un hidrácido en
solución acuosa se disocia liberando cationes H+.
Ejemplo de disociación del cloruro de hidrógeno en solución acuosa:
HCl → H+ + Cl-
Cloruro de Catión Anión
hidrógeno hidrógeno cloruro
Otras características de los hidrácidos es que son corrosivos y vuelven rosado el papel de tornasol azul.
Guía de Nomenclatura de compuestos inorgánicos
Página 7 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
Cloruro de hidrógeno
A temperatura ambiente, es un gas ligeramente amarillo, corrosivo, no inflamable, más pesado que el aire, de
olor fuertemente irritante. Cuando se expone al aire, el cloruro de hidrógeno forma vapores corrosivos densos de
color blanco. El cloruro de hidrógeno puede ser liberado por volcanes.
Tiene numerosos usos. Por ejemplo, para limpiar y galvanizar metales, curtir cueros. El cloruro de hidrógeno
puede formarse durante la quema de muchos plásticos. Cuando entra en contacto con el agua, forma ácido
clorhídrico (denominado popularmente ácido muriático). Tanto el cloruro de hidrógeno como el ácido clorhídrico
son corrosivos.
Los del segundo grupo están formados por hidrógeno y un no metal del grupo 13, 14, 15 u oxígeno. Estos
compuestos no presentan las características de los hidrácidos y reciben nombres no sistemáticos.
Ejemplos: H2O agua PH3 fosfina
NH3 amoníaco AsH3 arsina
FORMACIÓN DE COMPUESTOS HIDROGENADOS: Estos compuestos se forman, generalmente, por
reacción química entre hidrogeno y un no metal.
Hidrógeno + No metal → Compuesto hidrogenado
COMPUESTOS TERNARIOS
Están formados por tres elementos químicos. Se dividen en hidróxidos, oxoácidos y oxosales.
Hidróxidos: Se caracterizan por la presencia del ión hidróxido 1 unido a un catión metálico, por medio de
unión iónica. Ejemplos: NaOH KOH
Ión hidróxido [O-H]- (el ión hidróxido es mononegativo)
Si en el compuesto se encuentran dos o más grupos hidróxidos, los mismos se separan del metal por me-
dio de paréntesis. Ejemplos: Ca(OH)2 Al(OH)3
La fórmula general de los hidróxidos es X(OH) n en donde x es un metal.
Para nombrarlos se utilizan dos nomenclaturas: la tradicional o la moderna (de numerales de Stock). Si el
metal posee un único número de oxidación se menciona primero “hidróxido de” y seguido el nombre del
metal.
Ejemplos:
NaOH hidróxido de sodio Mg(OH) 2 hidróxido de magnesio
KOH hidróxido de potasio Al(OH)3 hidróxido de aluminio
Ca(OH)2 hidróxido de calcio
Si el metal presenta varios números de oxidación, para nombrarlo por la nomenclatura moderna, se men-
ciona “hidróxido de” y luego el metal aclarando el número de oxidación entre paréntesis y con números
romanos.
Por ejemplo, el hierro posee dos números de oxidación +2 y +3, formando básicamente dos tipos de hi -
dróxidos: Fe(OH)2 y Fe(OH)3 Utilizando la nomenclatura moderna los nombres serían:
Fe(OH)2 hidróxido de hierro (II) y Fe(OH) 3 hidróxido de hierro (III)
Utilizando nomenclatura tradicional se menciona “hidróxido” y luego la raíz del metal agregando el sufijo
“oso” o “ico” ya explicados anteriormente.
En el ejemplo del hierro, los nombres serían: Fe(OH)2 hidróxido ferroso y Fe(OH)3 hidróxido férrico.
1
Antiguamente llamado oxhidrilo.
Guía de Nomenclatura de compuestos inorgánicos
Página 8 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
ACTIVIDAD Nº 6: I) Nombre: a) Ba(OH)2 b) CsOH
II) Complete, basándose en el primer ejemplo y en la tabla de la página 15.
Fórmula del compuesto Nombre tradicional Nombre moderno
Fe(OH)2 Hidróxido ferroso Hidróxido de hierro (II)
CuOH
Cu(OH)2
Co(OH)2
Hidróxido niqueloso
FORMACIÓN DE HIDRÓXIDOS: Estos compuestos se forman, generalmente, por reacción química entre
un óxido básico y agua.
Óxido básico + Agua → Hidróxido
Hidróxido de sodio
También conocido como sosa cáustica o soda cáustica, es un compuesto corrosivo
utilizado en la industria del jabón, detergente, del papel, etc. A temperatura ambiente, es
un sólido blanco cristalino sin olor que absorbe humedad del aire (higroscópico). Cuando
se disuelve en agua libera una gran cantidad de calor que puede ser suficiente como para
encender materiales combustibles. Se encuentra comúnmente en limpiadores de desagües
y hornos.
Oxoácidos: Están formados por hidrógeno, oxígeno y otro elemento no metálico. Responden a la fórmula
general HaXOb donde H es hidrógeno, O oxígeno, y X es generalmente un no metal que actúa con número
de oxidación positivo. Los subíndices a y b son propios de cada compuesto. En los oxoácidos que
responden a la fórmula general HaXOb , X es el elemento central.
En algunos compuestos que desarrollaremos más adelante, la fórmula general puede ser H aXnOb y tam-
bién X puede ser un elemento metálico como Mn o Cr.
Son compuestos covalentes y, en solución acuosa se disocian en catión hidrógeno (H +) y en el anión co-
rrespondiente. Para nombrarlos utilizaremos la nomenclatura tradicional.
Cuando el número de oxidación del elemento central es impar, el compuesto tiene un sólo hidrógeno en su
estructura y cuando es par posee dos hidrógenos en su estructura. (Hay excepciones) 2.
Por ejemplo, el nitrógeno presenta principalmente los números de oxidación +3 y +5. Forma dos oxoáci -
dos: +1 +3 -2 +1 +5 -2
HNO2 y HNO3
Para nombrarlos por nomenclatura tradicional se antepone la palabra “ácido” y luego se menciona la raíz
con las terminaciones “oso” o “ico” según con qué número de oxidación esté actuando el no metal. Esto es
válido cuando el elemento central posee dos números de oxidación (como por ejemplo N, P, S, Se).
Los nombres de los oxoácidos mencionados anteriormente serían:
HNO2 HNO3
Ácido nitroso Ácido nítrico
Si el elemento central actúa con número de oxidación par, por ejemplo, los no metales del grupo 14 y 16,
el oxoácido posee en su estructura dos hidrógenos. Hay excepciones. Y la regla es idéntica a lo
mencionado recientemente, se antepone la palabra “ácido” luego se menciona la raíz con las terminaciones
“oso” o “ico” según el número de oxidación del elemento central. “Oso” cuando es el más chico, “ico”
cuando actúa con el más grande de esos dos.
En el caso de oxoácidos con azufre serían:
2
en los compuestos con fósforo, por ejemplo: H3PO4
Guía de Nomenclatura de compuestos inorgánicos
Página 9 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
+1 +4 -2 +1 +6 -2
H2SO3 y H2SO4
Quedando sus nombres como: H2SO3 H2SO4
Ácido sulfuroso Ácido sulfúrico
No metales con 4 números de oxidación:
Si el elemento central es cloro, bromo o yodo (poseen 4 números de oxidación), se utilizan los prefijos y
sufijos:
Número de oxidación +1: ácido hipo raíz oso
Número de oxidación +3: ácido raíz oso
Número de oxidación +5: ácido raíz ico
Número de oxidación +7: ácido per raíz ico
Por ejemplo, el cloro forma oxoácidos con cuatro números de oxidación: +1, +3, +5 y +7 :
+1 +1 -2 +1 +3 -2 +1 +5 -2 +1 +7 -2
HClO HClO2 HClO3 y HClO4
Por nomenclatura tradicional los nombres de estos oxoácidos serían:
HClO ácido hipocloroso HClO3 ácido clórico
HClO2 ácido cloroso HClO4 ácido perclórico
ACTIVIDAD Nº 7: Complete, basándose en el primer ejemplo:
Fórmula del compuesto Nombre tradicional
H2SO4 Ácido sulfúrico
HBrO
HBrO2
Ácido hipoiodoso
HBrO4
Ácido carbónico
H3PO4
FORMACIÓN DE OXOÁCIDOS: Estos compuestos se forman, generalmente, por reacción química entre un
óxido ácido y agua.
Óxido ácido + Agua → Oxoácido
Ácido sulfúrico
Conocido en la antigüedad como aceite de vitriolo. Es un compuesto
químico muy corrosivo. Reacciona violentamente con agua y compuestos
orgánicos con desprendimiento de calor.
Es el compuesto químico que más se produce en el mundo. Una gran parte
se emplea en la obtención de fertilizantes, pero también se usa para la
síntesis de otros ácidos y sulfatos y en la industria petroquímica.
CARACTERÍSTICAS DE LOS OXOÁCIDOS: Son similares a las de los hidrácidos: Son corrosivos, vuelven rosado el
papel de tornasol azul. Se disocian en agua liberando H+.
Ejemplo de disociación del ácido nítrico en solución acuosa: HNO3 → H+ + NO3-
Ácido Catión Anión (
nítrico hidrógeno nitrato
Guía de Nomenclatura de compuestos inorgánicos
Página 10 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
Oxosales: Se forman generalmente por reacción entre un hidróxido y un oxoácido. Desde el punto de vista
estructural provienen de reemplazar hidrógenos de un oxoácido por metales.
Ejemplo de oxosales: KNO3 CaSO4 NaBrO3
Las oxosales se nombran por nomenclatura moderna (numerales de Stock) y tradicional. Para establecer el
nombre a partir de su fórmula podemos seguir el siguiente mecanismo:
1) Identificar el catión y el anión.
2) Reconocer el número de oxidación del elemento central del anión.
3) Si el número de oxidación del elemento central es impar, entonces el anión es mononegativo (hay
MMMexcepciones, por ejemplo, en el fósforo). Si el número de oxidación del elemento central es par, el
MMManión es dinegativo.
4) Las cargas positivas que resultan de la suma de los cationes deben ser iguales en valor, pero de sig-
MMMno contrario que la que resulta de la suma de los aniones.
Por ejemplo, para nombrar el siguiente compuesto KNO3. Reconocemos el elemento que formará el catión
y los que formarán el anión: K (catión) NO3 (anión).
La carga del catión es +1 (ya que es un metal alcalino) quedando K +, por lo que la carga del anión es -1
(recordar regla 4 del mecanismo explicado), quedando NO3- . Y como se mencionó anteriormente cuando el
número de oxidación del elemento central es impar, el anión es mononegativo.
Para reconocer los números de oxidación de los elementos que forman el anión, recordemos que el
número de oxidación del oxígeno es -2 y el del nitrógeno puede ser +3 o +5; y como el anión en este caso
es mononegativo se deduce fácilmente que el número de oxidación del nitrógeno es +5 +1 +5 -2
KNO3
Para nombrar una oxosal por nomenclatura tradicional, se menciona primero el anión y luego el catión. Si el
elemento central presenta dos números de oxidación (ej. nitrógeno, azufre, selenio, ..) se menciona la raíz
del elemento con la terminación “ato” cuando actúa con el más grande o la terminación “ito” cuando actúa
con el más chico, y luego se menciona el catión.
Ejemplos: NaNO3 Primero se reconoce el catión y el anión: Na + (catión sodio) NO3-
(anión nitrato
porque el nitrógeno está actuando con el su número de oxidación más grande, el 5)
Luego nombramos el compuesto: NaNO3 nitrato de sodio
NaNO2 Se reconoce el catión y el anión: Na+ (catión sodio) NO2- (anión nitrito porque el
nitrógeno está actuando con el su número de oxidación más grande, el 5)
Luego nombramos el compuesto: NaNO2 nitrito de sodio
K2SO4 Se reconoce el catión y el anión K+ (catión potasio) SO42- (anión sulfato)
Luego nombramos el compuesto: K2SO4 sulfato de potasio
Cuando el metal puede actuar con dos números de oxidación se debe agregar los sufijos “oso” o “ico”
FeSO4 Se reconoce el catión y el anión Fe2+ (catión ferroso) SO42- (anión sulfato)
Y luego nombramos el compuesto: FeSO4 sulfato ferroso
Fe2(SO4)3 Se reconoce el catión y el anión Fe3+ (catión férrico) SO42- (anión sulfato)
Y luego nombramos el compuesto: Fe2(SO4)3 sulfato férrico
Si el elemento central presenta cuatro números de oxidación (cloro, bromo, yodo) se utilizan los prefijos y
sufijos:
Número de oxidación +1: hipo raíz ito
Número de oxidación +3: raíz ito
Número de oxidación +5: raíz ato
Número de oxidación +7: per raíz ato
Y luego se menciona el catión correspondiente.
Guía de Nomenclatura de compuestos inorgánicos
Página 11 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
Ejemplos: NaClO Se reconoce el catión y el anión Na+ ClO-
Catión sodio Anión hipoclorito Hipoclorito de sodio
NaClO2 Se reconoce el catión y el anión Na+ ClO2-
Catión sodio Anión clorito Clorito de sodio
+ -
NaClO3 Se reconoce el catión y el anión Na ClO3
Catión sodio Anión clorato Clorato de sodio
NaClO4 Se reconoce el catión y el anión Na+ ClO4-
Catión sodio Anión perclorato Perclorato de sodio
Otros ejemplos:
HgNO3 Nitrato mercurioso (por nomenclatura tradicional)
Cu(ClO4)2 Perclorato cúprico (por nomenclatura tradicional)
Para nombrar una oxosal por nomenclatura moderna, se sigue el mismo mecanismo explicado
recientemente pero solo se modifica la manera de mencionar el catión, cambiando las terminaciones “oso”
“ico” por números romanos. Ejemplo catión hierro (II) en lugar de ferroso, hierro (III) en lugar de férrico.
FeSO4 sulfato de hierro (II)
FeSO3 sulfito de hierro (II)
ACTIVIDAD Nº 8:
I) Indique el nombre (nomenclatura moderna y tradicional) de las siguientes oxosales:
a) NaNO3 b) NaNO2 c) Na2SO4 d) KClO3 e) CuSO4 f) CuNO3 g) Mg(NO3)2
II) Indique la fórmula de las siguientes oxosales:
a) clorato de sodio c) sulfato de mercurio (II) e) nitrato de aluminio
b) sulfato de potasio d) nitrito de potasio f) fosfato de sodio
FORMACIÓN DE OXOSALES: Estos compuestos se forman, generalmente, por reacción química entre un
hidróxido y oxoácido.
Hidróxido + Oxoácido → Oxosal + Agua
Carbonato de sodio
Sal blanca translúcida, conocida industrialmente como soda Solvay, o simplemente sosa, es
un compuesto muy utilizado para fabricar vidrios y jabones; también como materia prima para
obtener sodio y como blanqueador.
COMPUESTOS CUATERNARIOS
Se dividen en sales ácidas y sales básicas. Desarrollaremos las sales ácidas. Se nombran como las oxo-
sales por nomenclatura tradicional pero anteponiendo el prefijo “bi”. Las más conocidas son:
NaHCO3 bicarbonato de sodio NaHSO4 bisulfato de sodio
Bicarbonato de sodio
Sólido cristalino, blanco muy soluble en agua, de fórmula NaHCO3. Se puede encontrar en la naturaleza o
producir artificialmente. Cuando se expone a un ácido moderadamente fuerte se descompone en CO2 y H2O.
Debido a la capacidad de liberar dióxido de carbono, cuando se expone a un ácido, se usa junto con compuestos
acídicos como aditivo leudante en panadería y en la producción de gaseosas. Es el componente fundamental de
los polvos extintores de incendios.
Guía de Nomenclatura de compuestos inorgánicos
Página 12 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
ACTIVIDADES COMPLEMENTARIAS
9: Complete, basándose en el primer ejemplo.
Fórmula del Clase de Nombre por nom. Nombre por nom. de Nombre por nomenclatura
compuesto compuesto Tradicional Atomicidad de numerales de stock.
FeCl3 Sal binaria Cloruro férrico ------------------- Cloruro de hierro (III)
NiCl2 -------------------
NO2 -------------------
KClO2 -------------------
HgCl2 -------------------
HNO3 -------------------
Cl2O3 -------------------
Ácido sulfhídrico -------------------
------------------- Pentóxido de dicloro
Óxido cúprico -------------------
Cloruro cúprico ------------------- Cloruro de cobre (II)
SO3 -------------------
HClO4 -------------------
Sulfato cúprico -------------------
Dióxido de azufre
Nitrato de potasio -------------------
Nitrito de potasio -------------------
HCl -------------------
Ca(NO3)2 -------------------
Óxido cuproso ------------------- Óxido de cobre (I)
Fe(NO3)2 -------------------
10. Complete el siguiente esquema que muestra cómo se forman los compuestos inorgánicos:
Metal No metal
+ oxígeno + hidrógeno + hidrógeno + oxígeno
……………..… ……………..… ……………..… ……………..… ……………..…
…………….
+ agua + agua
……………..… ……………..…
……………..…
Guía de Nomenclatura de compuestos inorgánicos
Página 13 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
11. Complete:
Nombre del compuesto Fórmula Clase de compuesto
a Óxido cúprico
b Clorito de potasio
c Cloruro ferroso
d Ácido ortofosfórico
e Sulfato férrico
f Nitrato cúprico
g Sulfuro de amonio
h Hidróxido férrico
i Ácido sulfúrico
j Sulfato cúprico
k Sulfuro ferroso
l Sulfito ferroso
m Bromato ferroso
n Cianuro de potasio
o Nitrato de sodio
p Dióxido de azufre
q Hipoclorito de sodio
r Sulfato ferroso
s Nitrato cuproso
t Nitrito de amonio
Guía de Nomenclatura de compuestos inorgánicos
Página 14 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
TABLA DE ESPECIES QUÍMICAS DE USO CORRIENTE
Catión Nomenclatura Tradicional Nomenclatura moderna
Fe2+ ferroso hierro (II)
Fe3+ férrico hierro (III)
Cu+ cuproso cobre (I)
Cu2+ cúprico cobre (II)
Pb2+ plumboso plomo (II)
Pb4+ plúmbico plomo (IV)
Zn2+ cinc cinc
Ag+ plata plata
Hg+ * mercurioso mercurio (I)
Hg2+ mercúrico mercurio (II)
NH4 + amonio amonio
Co2+ cobaltoso cobalto (II)
Co3+ cobáltico cobalto (III)
Cr2+ cromoso cromo (II)
Cr3+ crómico cromo (III)
Mn2+ manganoso manganeso (II)
Mn3+ mangánico manganeso (III)
Ni2+ niqueloso níquel (II)
Ni3+ niquélico níquel (III)
Sn2+ estannoso estaño (II)
Sn4+ estánnico estaño (IV)
* Hg22+
ALGUNAS REGLAS BÁSICAS DE FORMULEO Y NOMENCLATURA
Con respecto a los números de oxidación:
- En compuestos neutros, la suma algebraica de los números de oxidación de los elementos involucra-
dos multiplicados por sus respectivas atomicidades, debe ser igual a cero.
- En los iones, la suma algebraica de los números de oxidación de los elementos involucrados multipli-
cados por sus respectivas atomicidades, debe ser igual a la carga del respectivo ión.
- El número de oxidación del hidrógeno cuando se combina es +1 (excepto en los hidruros metálicos,
donde es -1).
- El número de oxidación del oxígeno cuando se combina es -2 (excepto en los peróxidos, donde es -1).
Con respecto a la ubicación de los elementos en una fórmula:
- En la fórmula de un compuesto iónico, primeros se ubica el catión y luego el anión.
- Los elementos que forman el anión se ubican según electronegatividad creciente (excepto en el hidró-
xido).
- En la fórmula de un hidrácido o en la de un oxoácido, primero se ubica el hidrógeno.
Guía de Nomenclatura de compuestos inorgánicos
Página 15 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
Respuestas:
Act. Nº 1: I) a) óxido de litio b) óxido de bario c) óxido de cinc d) óxido de níquel (II).
II)
Fórmula del compuesto Nombre tradicional Nombre moderno
FeO Óxido ferroso Óxido de hierro (II)
PbO Óxido plumboso Óxido de plomo (II)
PbO2 Óxido plúmbico Óxido de plomo (IV)
Hg2O Óxido mercurioso Óxido de mercurio (I)
HgO Óxido mercúrico Óxido de mercurio (II)
Act. Nº 2:
I) a) Hidruro de magnesio (por ambas nomenclaturas)
b) Hidruro de galio
c) Hidruro de plomo (II) (nomenclatura de numerales de stock) y Hidruro plumboso (nomenclatura tradicional)
II) a) RbH b) MnH2 c) CoH3 d) CrH2 e) HgH2 f) AlH3
Act. Nº 3: I) a) ioduro de sodio b) cloruro de cinc c) cloruro de magnesio d) sulfuro de bario
II)
Fórmula del compuesto Nombre tradicional Nombre moderno
FeCl2 Cloruro ferroso Cloruro de hierro (II)
CuCl2 Cloruro cúprico Cloruro de cobre (II)
PbCl2 Cloruro plumboso Cloruro de plomo (II)
NiBr2 Bromuro niqueloso Bromuro de níquel (II)
PbS Sulfuro plumboso Sulfuro de plomo (II)
PbI2 Ioduro plumboso Ioduro de plomo (II)
CoCl2 Cloruro cobaltoso Cloruro de cobalto (II)
CrCl3 Cloruro crómico Cloruro de cromo (III)
Act. Nº 4:
I) a) Dióxido de telurio (nomenclatura de atomicidad) y Óxido de telurio (IV) (nomenclatura de numerales de Stock)
b) Pentóxido de difósforo (nomenclatura de atomicidad) y Óxido de fósforo (V) (nomenclatura de numerales de Stock)
c) Dióxido de selenio (nomenclatura de atomicidad) y Óxido de selenio (IV) (nomenclatura de numerales de Stock)
II) a) Cl2O b) SiO2 c) Br2O5
Act. Nº 5:
I) a) Tetrabromuro de carbono c) Disulfuro de carbono
b) Tricloruro de nitrógeno d) Tricloruro de fósforo
II) a) SiF4 b) AsBr3 c) SiS2
Act. Nº 6:
I) a) hidróxido de bario b) hidróxido de cesio
II)
Fórmula del compuesto Nombre tradicional Nombre moderno
Fe(OH)2 Hidróxido ferroso Hidróxido de hierro (II)
CuOH Hidróxido cuproso Hidróxido de cobre (I)
Cu(OH)2 Hidróxido cúprico Hidróxido de cobre (II)
Co(OH)2 Hidróxido cobaltoso Hidróxido de cobalto (II)
Ni(OH)2 Hidróxido niqueloso Hidróxido de níquel (II)
Act. Nº 7:
Fórmula del compuesto Nombre tradicional
H2SO4 Ácido sulfúrico
HBrO Ácido hipobromoso
HBrO2 Ácido bromoso
HIO Ácido hipoiodoso
HBrO4 Ácido perbrómico
H2CO3 Ácido carbónico
H3PO4 Ácido fosfórico
Act. Nº 8 I) a) nitrato de sodio
b) nitrito de sodio
c) sulfato de sodio
Guía de Nomenclatura de compuestos inorgánicos
Página 16 de 17
Colegio Nacional de Buenos Aires
Departamento de Química – 4º año
d) clorato de potasio
e) sulfato cúprico - sulfato de cobre (II)
f) nitrato cuproso - nitrato de cobre (I)
g) nitrato de magnesio
II) a) NaClO3 b) K2SO4 c) HgSO4 d) KNO2 e) Al(NO3)3 f) Na3PO4
Act. Nº 9:
Fórmula del Clase de Nombre por Nombre por Nombre por nomenclatura
compuesto compuesto nomenclatura nomenclatura de de numerales de stock.
Tradicional Atomicidad
FeCl3 Sal binaria Cloruro férrico ------------------- Cloruro de hierro (III)
NiCl2 Sal binaria Cloruro niqueloso ------------------ Cloruro de níquel (II)
NO2 Óxido ácido -------------- Dióxido de nitrógeno Óxido de nitrógeno (IV)
KClO2 oxosal Clorito de potasio ------------------- Clorito de potasio
HgCl2 Sal binaria Cloruro mercúrico ------------------- Cloruro de mercurio (II)
HNO3 oxoácido Ácido nítrico ------------------- -------------------
Cl2O3 Óxido ácido -------------- Trióxido de dicloro Óxido de cloro (III)
H2S Hidrácido Ácido sulfhídrico ------------------- Sulfuro de hidrógeno
Cl2O5 Óxido ácido ----------------- Pentóxido de dicloro Óxido de cloro (V)
CuO Óxido básico Óxido cúprico -------------------- Óxido de cobre (II)
CuCl2 Sal binaria Cloruro cúprico ----------------------- Cloruro de cobre (II)
SO3 Óxido ácido --------------- Trióxido de azufre Óxido de azufre (VI)
HClO4 Oxoácido Ácido perclórico ------------------ ------------------
CuSO4 Oxosal Sulfato cúprico ------------------ Sulfato de cobre (II)
SO2 Óxido ácido --------------- Dióxido de azufre Óxido de azufre (IV)
KNO3 Oxosal Nitrato de potasio -------------------- Nitrato de potasio
KNO2 Oxosal Nitrito de potasio ------------------- Nitrito de potasio
HCl Hidrácido Ácido clorhídrico -------------------- Cloruro de hidrógeno
Ca(NO3)2 Oxosal Nitrato de calcio ------------------- Nitrato de calcio
Cu2O Óxido básico Óxido cuproso -------------------- Óxido de cobre (I)
Fe(NO3)2 Oxosal Nitrato ferroso ------------------- Nitrato de hierro (II)
Guía de Nomenclatura de compuestos inorgánicos
Página 17 de 17
También podría gustarte
- Química de los compuestos de coordinaciónDe EverandQuímica de los compuestos de coordinaciónAún no hay calificaciones
- Cap. 1 - NomenclaturaDocumento17 páginasCap. 1 - NomenclaturaFulanoAún no hay calificaciones
- El carbón: origen, atributos, extracción y usos actuales en ColombiaDe EverandEl carbón: origen, atributos, extracción y usos actuales en ColombiaCalificación: 4.5 de 5 estrellas4.5/5 (2)
- Prontuario de QuimicaDocumento20 páginasProntuario de QuimicaDavidAún no hay calificaciones
- Compuestos InorganicosDocumento17 páginasCompuestos InorganicosGisel GomezAún no hay calificaciones
- Hidróxidos Oxácidos, Hidrácidos, Hidruros, Sales FDocumento41 páginasHidróxidos Oxácidos, Hidrácidos, Hidruros, Sales Forlando GómezAún no hay calificaciones
- Linea de Tiempo QuimicaDocumento1 páginaLinea de Tiempo QuimicaBrixon BozaAún no hay calificaciones
- Oxidos BasicosDocumento5 páginasOxidos Basicossofi mussoAún no hay calificaciones
- Funciones Quimicas InorganicasDocumento1 páginaFunciones Quimicas InorganicasツJuanes AvAún no hay calificaciones
- Nomenclatura de Compuestos InorgánicosDocumento60 páginasNomenclatura de Compuestos InorgánicosAngélica Tommaso Acevedo100% (1)
- Linea de TiempoDocumento1 páginaLinea de TiempoBrixon BozaAún no hay calificaciones
- Química InorgánicaDocumento2 páginasQuímica InorgánicaJosue CruzAún no hay calificaciones
- Funciones Quimicas 2023 Lic. Juan Sanchez GuerreroDocumento11 páginasFunciones Quimicas 2023 Lic. Juan Sanchez Guerreroelcacas cacasdxAún no hay calificaciones
- Oxoacidos AnfoterosDocumento29 páginasOxoacidos Anfoterosraul lipa50% (2)
- Guía de Aprendizaje Primeros Medios Nomenclatura Inorganica BinariaDocumento9 páginasGuía de Aprendizaje Primeros Medios Nomenclatura Inorganica BinariaAna María Millán InzunzaAún no hay calificaciones
- OxidosDocumento15 páginasOxidosjuanchoAún no hay calificaciones
- Nomenclatura Quimica InorganicaDocumento10 páginasNomenclatura Quimica InorganicaMarcel Antonio Vasquez SeverinoAún no hay calificaciones
- Nomenclatura de Los Compuestos InorgánicosDocumento42 páginasNomenclatura de Los Compuestos InorgánicosMtra Sofy ChaconAún no hay calificaciones
- QUÍMICA 2° CURSO-CIENCIAS BÁSICAS-PLAN COMÚN-Binarios Oxigenados PDFDocumento6 páginasQUÍMICA 2° CURSO-CIENCIAS BÁSICAS-PLAN COMÚN-Binarios Oxigenados PDFpuntualAún no hay calificaciones
- EQUIPO 5 TRIPTICO DE NOMENCLATURA - RemovedDocumento2 páginasEQUIPO 5 TRIPTICO DE NOMENCLATURA - RemovedFRANKLIN SANTIAGO SEBASTIÁN100% (1)
- Garcia RoviraDocumento7 páginasGarcia RoviraEfrenMendozaEstebanAún no hay calificaciones
- Gráfico de Línea de Tiempo Timeline Flujo Progreso de Proyecto o Empresa Histórico Evolución Moderno MulticolorDocumento1 páginaGráfico de Línea de Tiempo Timeline Flujo Progreso de Proyecto o Empresa Histórico Evolución Moderno MulticolorBrixon BozaAún no hay calificaciones
- Guia de Nomenclatura InorganicaDocumento10 páginasGuia de Nomenclatura InorganicaMaquillaje Moda La Serena100% (1)
- Apuntes y Ejercicios de NomenclaturaDocumento10 páginasApuntes y Ejercicios de NomenclaturaAnnia Flores GuzmanAún no hay calificaciones
- U1-Repaso. Formación y Nomenclatura de Compuestos InorgánicosDocumento19 páginasU1-Repaso. Formación y Nomenclatura de Compuestos Inorgánicoseze.perichAún no hay calificaciones
- Ciencia y TecnologíaDocumento9 páginasCiencia y TecnologíaEmily Sayumi Carrero CerroAún no hay calificaciones
- Óxidos en Nuestra Vida CotidianaDocumento3 páginasÓxidos en Nuestra Vida Cotidianamargarita cayoAún no hay calificaciones
- Guia de Nomenclatura InorganicaDocumento16 páginasGuia de Nomenclatura InorganicaJose Armando Cifuentes BarraganAún no hay calificaciones
- Proposiciones NOMENCLATIRADocumento5 páginasProposiciones NOMENCLATIRAMaria Fernanda Rueda Guzman100% (1)
- ÓXIDOSDocumento1 páginaÓXIDOSRodrigo ChabléAún no hay calificaciones
- 6646b06b90bd13da 20210823 125404L8V0pDocumento8 páginas6646b06b90bd13da 20210823 125404L8V0pChristian GonzalezAún no hay calificaciones
- Guia Tematica 1 Quimica Decimo Tercer Periodo 2021Documento5 páginasGuia Tematica 1 Quimica Decimo Tercer Periodo 2021Aleja PedrozaAún no hay calificaciones
- Guia Nomenclatura Quimica CICLO VIDocumento7 páginasGuia Nomenclatura Quimica CICLO VIIdens CúcutaAún no hay calificaciones
- LAB 8 - Funciones QuimicasDocumento12 páginasLAB 8 - Funciones QuimicasJOSE MANUEL HERRERA PESANTESAún no hay calificaciones
- Combinaciones BinariasDocumento6 páginasCombinaciones BinariasYamile MezaAún no hay calificaciones
- Nomenclatura InorganicaDocumento14 páginasNomenclatura InorganicaJuan Carlos Arias VegaAún no hay calificaciones
- Formulación y Nomenclatura - Los Óxidos - CienciaonthecrestDocumento1 páginaFormulación y Nomenclatura - Los Óxidos - CienciaonthecrestdanielitoAún no hay calificaciones
- Compuestos InorganicosDocumento21 páginasCompuestos InorganicosWilder Chavez MemenzaAún no hay calificaciones
- Nomenclatura J InorgánicaDocumento14 páginasNomenclatura J InorgánicaJ Enrique SgAún no hay calificaciones
- Contaminantes InorganicosDocumento28 páginasContaminantes InorganicoskarinaAún no hay calificaciones
- Prelaboratorio #4Documento4 páginasPrelaboratorio #4Ludwin SaminesAún no hay calificaciones
- Funciones QuímicasDocumento1 páginaFunciones QuímicasEVELYN NATHALIE CASTRO MOLINAAún no hay calificaciones
- Quimica Inorganica NomenclaturaDocumento15 páginasQuimica Inorganica NomenclaturaSamuel CZAún no hay calificaciones
- Oxidos TeoríaDocumento5 páginasOxidos TeoríaLudmila RementeriaAún no hay calificaciones
- Unidad 5 - Compuestos Quimicos - 2019Documento19 páginasUnidad 5 - Compuestos Quimicos - 2019ferhumanistaAún no hay calificaciones
- Quimica FormulaciónDocumento12 páginasQuimica FormulaciónAriel AndradeAún no hay calificaciones
- S e P A R A T A de Compuestos InorganicosDocumento14 páginasS e P A R A T A de Compuestos InorganicosNoa NatividadAún no hay calificaciones
- 3 - Nomenclatura InorgánicaDocumento8 páginas3 - Nomenclatura Inorgánicaarando estradaAún no hay calificaciones
- Funciones Quimicas 2022.Documento9 páginasFunciones Quimicas 2022.luz apazaAún no hay calificaciones
- Act. Requisito Etapa 4 Toy CantuDocumento15 páginasAct. Requisito Etapa 4 Toy CantuMigueltoy ToycantuAún no hay calificaciones
- UNIDAD 1 Elementos Químicos - FormulaciónDocumento10 páginasUNIDAD 1 Elementos Químicos - FormulaciónSilvana VázquezAún no hay calificaciones
- Los OxcidosDocumento11 páginasLos Oxcidoskaryme callejasAún no hay calificaciones
- Práctica 05 - Química 2Documento10 páginasPráctica 05 - Química 2Marko Senty Perez100% (1)
- Nomenclaturas Di RisioDocumento5 páginasNomenclaturas Di RisioRubén PachecoAún no hay calificaciones
- Tema - 1 - Formulacion - Inorganica PDFDocumento29 páginasTema - 1 - Formulacion - Inorganica PDFJavierAún no hay calificaciones
- Tema #9. - Función Inorgánica ÓxidosDocumento26 páginasTema #9. - Función Inorgánica ÓxidosRebeca RequenaAún no hay calificaciones
- Rtas CastellanoDocumento4 páginasRtas CastellanoDanny GonzalezAún no hay calificaciones
- Sintetizar El TextoDocumento2 páginasSintetizar El TextoDanny GonzalezAún no hay calificaciones
- Rtas LatínDocumento1 páginaRtas LatínDanny GonzalezAún no hay calificaciones
- Revolucion FrancesaDocumento18 páginasRevolucion FrancesaDanny GonzalezAún no hay calificaciones
- #2 Analisis de Mio CidDocumento3 páginas#2 Analisis de Mio CidDanny GonzalezAún no hay calificaciones
- TRABAJO Y ENERGÍA2 - PresentacionDocumento21 páginasTRABAJO Y ENERGÍA2 - PresentacionDanny GonzalezAún no hay calificaciones
- ENERGIA Problemas2Documento3 páginasENERGIA Problemas2Danny GonzalezAún no hay calificaciones
- Nomenclatura 2024Documento20 páginasNomenclatura 2024Danny GonzalezAún no hay calificaciones
- Trabajo y Energía2Documento7 páginasTrabajo y Energía2Danny GonzalezAún no hay calificaciones
- PRG 4Documento3 páginasPRG 4Danny GonzalezAún no hay calificaciones
- Lectura Crítica Del PMC - FunesDocumento12 páginasLectura Crítica Del PMC - FunesDanny GonzalezAún no hay calificaciones
- Guía de Estudio BuffonDocumento1 páginaGuía de Estudio BuffonDanny GonzalezAún no hay calificaciones
- YugoslaviaDocumento7 páginasYugoslaviaDanny GonzalezAún no hay calificaciones
- Guia de Actividades de Nomenclatura Quimica Inorganica CnbaDocumento4 páginasGuia de Actividades de Nomenclatura Quimica Inorganica CnbaDanny GonzalezAún no hay calificaciones
- HistoriaDocumento20 páginasHistoriaDanny GonzalezAún no hay calificaciones
- Práctica Narrativa 2023Documento1 páginaPráctica Narrativa 2023Danny GonzalezAún no hay calificaciones
- Discurso Directo y Discurso Indirecto - Mini FichaDocumento1 páginaDiscurso Directo y Discurso Indirecto - Mini FichaDanny GonzalezAún no hay calificaciones
- AlemaniaDocumento8 páginasAlemaniaDanny GonzalezAún no hay calificaciones
- AgroclimatologíaDocumento50 páginasAgroclimatologíaParroquia Santa Ana De Los Indios Guácaras100% (1)
- S 7.1metalurgia FísicaDocumento79 páginasS 7.1metalurgia FísicaVictor LaosAún no hay calificaciones
- Transesterificacion Del BiodieselDocumento2 páginasTransesterificacion Del BiodieselGingetsu 銀月Aún no hay calificaciones
- Diseño de Equipos de Transferencia de CalorDocumento37 páginasDiseño de Equipos de Transferencia de Calordaniel100% (1)
- Solución de EJERCICIOS Fisica Estado Solido Etn 501Documento3 páginasSolución de EJERCICIOS Fisica Estado Solido Etn 501Herland Alfredo Mollinedo HuancolloAún no hay calificaciones
- Calentador SolarDocumento15 páginasCalentador Solaralbeiro rojas avellanedaAún no hay calificaciones
- Análisis de YodatosDocumento13 páginasAnálisis de YodatosGustavo Manosalva HornaAún no hay calificaciones
- Electropulido 1Documento15 páginasElectropulido 1Daniela CastilloAún no hay calificaciones
- Documento Sin TítuloDocumento7 páginasDocumento Sin Títulorafael lozano rubioAún no hay calificaciones
- Guia de Propiedades Coligativas 11Documento4 páginasGuia de Propiedades Coligativas 11Julio Eduardo CiodaroAún no hay calificaciones
- Hoja de Seguridad ReactivosDocumento12 páginasHoja de Seguridad ReactivosAlberto FigueroaAún no hay calificaciones
- Transformador Monofasico y Circuito EquivalenteDocumento12 páginasTransformador Monofasico y Circuito EquivalenteAAAAAAún no hay calificaciones
- Problemas Del Libro de Quimica 6.1-6.20Documento14 páginasProblemas Del Libro de Quimica 6.1-6.20Michael FieldsAún no hay calificaciones
- Aai - Opmx01 - Guía de Flotación Cal Vs PH InacapDocumento16 páginasAai - Opmx01 - Guía de Flotación Cal Vs PH InacapValentinaAún no hay calificaciones
- Examiensprueba2 PDFDocumento6 páginasExamiensprueba2 PDFEdison SarmientoAún no hay calificaciones
- Planta de Tratamiento Del MercurioDocumento5 páginasPlanta de Tratamiento Del MercurioVictor Hugo Flores100% (2)
- Calidad Del Agua de Riego. Junta de Andalucia.Documento9 páginasCalidad Del Agua de Riego. Junta de Andalucia.María Dolores MalenoAún no hay calificaciones
- 03 MSDS - BionitDocumento8 páginas03 MSDS - BionitCinthia NiñoAún no hay calificaciones
- Rayos UV - Araceli Tapia PintoDocumento12 páginasRayos UV - Araceli Tapia PintoAraceli TpAún no hay calificaciones
- Cubeta de OndasDocumento10 páginasCubeta de OndasOrlando Leguizamon LeonAún no hay calificaciones
- Composicion de Rocas TerrigenasDocumento9 páginasComposicion de Rocas Terrigenaszuly ortizAún no hay calificaciones
- SOTEDocumento9 páginasSOTEesanroro12Aún no hay calificaciones
- Analisis GranulometricoDocumento5 páginasAnalisis Granulometricoramon burgos ballesterosAún no hay calificaciones
- Practica de Serpentin y CamisaDocumento21 páginasPractica de Serpentin y CamisaholaAún no hay calificaciones
- Tesis de Secado PDFDocumento160 páginasTesis de Secado PDFjohanna gutierrezAún no hay calificaciones
- InerciaDocumento33 páginasInerciaLizbeth Q TitoAún no hay calificaciones
- Criogenia AlimentariaDocumento7 páginasCriogenia AlimentariaDavid Parado0% (1)
- PFC ACECAT v01p01Documento168 páginasPFC ACECAT v01p01Enrique Giovanni EspinosaAún no hay calificaciones
- Lubricante Golden Bear RematerisadoDocumento11 páginasLubricante Golden Bear RematerisadoMarlon MuzoAún no hay calificaciones
- Capítulo 1 Tipos y Propiedades de SuelosDocumento45 páginasCapítulo 1 Tipos y Propiedades de SuelosShadyacAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (203)
- Liberación del trauma: Perdón y temblor es el caminoDe EverandLiberación del trauma: Perdón y temblor es el caminoCalificación: 4 de 5 estrellas4/5 (4)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Cerebro y silencio: Las claves de la creatividad y la serenidadDe EverandCerebro y silencio: Las claves de la creatividad y la serenidadCalificación: 5 de 5 estrellas5/5 (2)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Ondas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasDe EverandOndas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasCalificación: 5 de 5 estrellas5/5 (3)
- Ciencia de datos: La serie de conocimientos esenciales de MIT PressDe EverandCiencia de datos: La serie de conocimientos esenciales de MIT PressCalificación: 5 de 5 estrellas5/5 (1)
- El psoas: Músculo vital (Color)De EverandEl psoas: Músculo vital (Color)Calificación: 3.5 de 5 estrellas3.5/5 (9)
- Guía práctica para la refracción ocularDe EverandGuía práctica para la refracción ocularCalificación: 5 de 5 estrellas5/5 (2)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Cerebros rotos: Pacientes asombrosos que me enseñaron a vivirDe EverandCerebros rotos: Pacientes asombrosos que me enseñaron a vivirCalificación: 5 de 5 estrellas5/5 (3)
- Había una vez el átomo: O cómo los científicos imaginan lo invisibleDe EverandHabía una vez el átomo: O cómo los científicos imaginan lo invisibleCalificación: 5 de 5 estrellas5/5 (3)
- Guía para la aplicación de ISO 9001 2015De EverandGuía para la aplicación de ISO 9001 2015Calificación: 4 de 5 estrellas4/5 (1)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- Historia del cuerpo humano: Evolución, salud y enfermedadDe EverandHistoria del cuerpo humano: Evolución, salud y enfermedadAún no hay calificaciones
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- SNC - Soporte neurocrítico: De la urgencia a la terapia intensivaDe EverandSNC - Soporte neurocrítico: De la urgencia a la terapia intensivaAún no hay calificaciones