Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Los Oxcidos
Cargado por
karyme callejas0 calificaciones0% encontró este documento útil (0 votos)
8 vistas11 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
PPTX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
8 vistas11 páginasLos Oxcidos
Cargado por
karyme callejasCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 11
Los Oxidos
ELIUD HERRERA PANCARDO
ANETTE CASAS VALERDE
KARYME CALLEJAS VERGARA
ANGEL COBOS DE LA CRUZ
DORELY CANCINO VENAVIDES
Introduccion
El estudio dela química nos ha dado grandes aportaciones dentro
de la vida del ser humano. Esta ciencia nos ha ayudado en
diferentes aspectos de nuestras vidas, a continuación analizaremos
uno de los estudios de la química, estos son los óxidos,
explicaremos de una manera sintética que son, para que sirven y
cuantos tipos de estos existen, para poder desarrollar este tema
empezaremos por saber que son los óxidos.
¿Que son?
Los óxidos comprenden aquellos compuestos en
los que los átomos o los cationes de uno o más
metales están combinados con el oxígeno. Son
relativamente duros, densos y refractarios
y ,generalmente se presentan de forma accesoria
enrocas ígneas y metamórficas y como granos
detríticos en los sedimentos.
CLASIFICACION
Oxidos Basicos Oxidos Neutros Óxidos anfóteros
El metal presente en su Son compuestos por no
Presentan ambigüedad, en
formula puede presentar metales, ellos no reaccionan
la presencia de un ácido se
“carga eléctrica” +1 y con agua, ácido o base en razón
comportan como óxidos
+2, o sea, poseer del enlace covalente que une
básicos y en la presencia de
carácter iónico. sus componentes, de allí el
una base, como óxidos
porque de ser llamados óxidos
ácidos.
inertes.
Oxcidos Acidos OxidosDobles o Peroxidos
También conocidos como
Mixtos Compuestos que poseen
anhídridos de ácidos, son La combinación de dos
en su fórmula el grupo
óxidos de un mismo
formados por no metales y (O2)2-
elemento da origen a
presentan carácter
covalente. este tipo de óxidos.
La nomenclatura tradicional (o estequiométrica):
⃞Agrega una serie de prefijos y
sufijos al nombre del elemento
(metálico o no metálico)
dependiendo de la cantidad de
números de oxidación que tenga.
⃞Además, si es un óxido básico
se escribe ‘óxido de (nombre del
metal con sus respectivos prefijos
y sufijos)’ y si es un óxido ácido
se suele escribir también
‘anhídrido (nombre del metal con
Cuando el elemento solo tiene un número de
oxidación:
óxido (y el elemento con el sufijo incorporado -ico)’.
Por ejemplo: óxido potásico (K2O).
Cuando el elemento tiene dos números de oxidación:
Para el mayor número de oxidación: ‘óxido (y el
elemento con el sufijo incorporado -ico)’. Por
ejemplo: óxido férrico (Fe2O3).
Para el menor número de oxidación: ‘óxido (y el
elemento con el sufijo incorporado -oso)’. Por
ejemplo: óxido ferroso (FeO).
La nomenclatura sistemática:
⃞Esta nomenclatura es más sencilla que
la tradicional, y se nombra al óxido
escribiendo la palabra ‘óxido de’ y luego
el nombre del elemento, pero escribiendo
antes de cada uno de ellos el prefijo que
corresponde al número de átomos que
tiene en ese compuesto químico.
⃞El prefijo mono- es para un solo átomo,
el prefijo di- para dos, el tri- para tres, el
prefijo tetra- para cuatro, el prefijo penta-
para cinco, el prefijo hexa- para seis, el
prefijo hepta- para siete y el prefijo octa-
La nomenclatura de Stock:
Se escribe la palabra “óxido”, seguida del
nombre del metal y del número de oxidación
con que trabaje, entre paréntesis y en números
romanos. Análogamente a la nomenclatura
tradicional, se escribirá:
óxido de cloro (I) para el óxido hipocloroso
(Cl2O)
óxido de cloro (III) para el óxido cloroso
(Cl2O3)
óxido de cloro (V) para el óxido clórico
(Cl2O5)
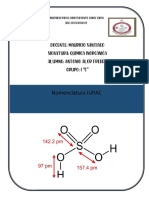
FORMULACION
OXIDOS
Formulacion (eliud)
También podría gustarte
- Formación de ÓxidosDocumento7 páginasFormación de ÓxidosBrendaAún no hay calificaciones
- HidróxidoDocumento20 páginasHidróxidoMerlysAún no hay calificaciones
- Compuestos Químicos (Oxidos)Documento9 páginasCompuestos Químicos (Oxidos)Uli RAMOSAún no hay calificaciones
- Nomenclatura de OxidosDocumento8 páginasNomenclatura de OxidosAlbert PizziAún no hay calificaciones
- Formación de Óxidos, Bases y ÁcidosDocumento12 páginasFormación de Óxidos, Bases y Ácidossocorro leonAún no hay calificaciones
- Caracteristicas Compuestos InorganicosDocumento4 páginasCaracteristicas Compuestos InorganicosDaniel Vazquez Joachin VazquezAún no hay calificaciones
- Ayuda Uce 3Documento50 páginasAyuda Uce 3Michael BedonAún no hay calificaciones
- Nomenclatura Química: Guía Completa de los Sistemas de NombramientoDocumento15 páginasNomenclatura Química: Guía Completa de los Sistemas de NombramientoArsmstrongAún no hay calificaciones
- NomenclaturaDocumento17 páginasNomenclaturaDaniel TorrealbaAún no hay calificaciones
- ACTIVIDAD DEQUIMICA 4to N1Documento15 páginasACTIVIDAD DEQUIMICA 4to N1Rosana Maria Salazar LarezAún no hay calificaciones
- Quìmica 1Documento17 páginasQuìmica 1NILLIRETH MEJIAAún no hay calificaciones
- Actividad 4 - Clasificacion, Nomenclatura y Ejemplos de OxidosDocumento4 páginasActividad 4 - Clasificacion, Nomenclatura y Ejemplos de OxidosKazuma satouAún no hay calificaciones
- EstebanDocumento7 páginasEstebanValeria RiosAún no hay calificaciones
- Nomenclaturas Di RisioDocumento5 páginasNomenclaturas Di RisioRubén PachecoAún no hay calificaciones
- Oxidos, Hidróxidos y PeróxidosDocumento2 páginasOxidos, Hidróxidos y PeróxidosNICOLAS GIRALDO BETANCURAún no hay calificaciones
- Documento 7Documento4 páginasDocumento 7yosoAún no hay calificaciones
- Óxidos binarios - nomenclatura y formaciónDocumento5 páginasÓxidos binarios - nomenclatura y formaciónLudmila RementeriaAún no hay calificaciones
- Cuales Son Las Funciones Quimicas Inorganicas Que Grupo Las IdentificaDocumento2 páginasCuales Son Las Funciones Quimicas Inorganicas Que Grupo Las IdentificaArmando Jose Gutierrez OlivaresAún no hay calificaciones
- QuimicaDocumento45 páginasQuimicaAngel MarcanoAún no hay calificaciones
- Trabajo de Nomenclarura Inorgánica - 02Documento18 páginasTrabajo de Nomenclarura Inorgánica - 02Pilar Bcrra PeraltaAún no hay calificaciones
- Compuestos Binarios ApunteDocumento10 páginasCompuestos Binarios ApuntefrancoAún no hay calificaciones
- QUÍMICA 2° CURSO-CIENCIAS BÁSICAS-PLAN COMÚN-Binarios Oxigenados PDFDocumento6 páginasQUÍMICA 2° CURSO-CIENCIAS BÁSICAS-PLAN COMÚN-Binarios Oxigenados PDFpuntualAún no hay calificaciones
- Quimica Los OxidosDocumento3 páginasQuimica Los OxidosBANI ZAún no hay calificaciones
- Oxidos e HidroxidosDocumento4 páginasOxidos e HidroxidosLuis RamirezAún no hay calificaciones
- Nomenclatura de Oxidos BasicosDocumento14 páginasNomenclatura de Oxidos BasicossinaiAún no hay calificaciones
- Prontuario de QuimicaDocumento20 páginasProntuario de QuimicaDavidAún no hay calificaciones
- Clasificación de Los ÓxidosDocumento3 páginasClasificación de Los ÓxidosEdwardo FerreyraAún no hay calificaciones
- Funciones Quimicas Oxidos BasicosDocumento5 páginasFunciones Quimicas Oxidos BasicosDanna RamirezAún no hay calificaciones
- Óxidos: Nomenclatura y tiposDocumento5 páginasÓxidos: Nomenclatura y tiposLa Niña YazminAún no hay calificaciones
- Actividades de Nomenclatura I para Cuarto Grado de SecundariaDocumento10 páginasActividades de Nomenclatura I para Cuarto Grado de SecundariavidamaAún no hay calificaciones
- OXIDOSDocumento2 páginasOXIDOSseleneavila.licAún no hay calificaciones
- Los Hidróxidos Son Compuestos Iónicos Formados Por UnDocumento11 páginasLos Hidróxidos Son Compuestos Iónicos Formados Por UnJerson David Rubín TorresAún no hay calificaciones
- Guia #5 3ero NomenclaturaDocumento4 páginasGuia #5 3ero NomenclaturaMartínAún no hay calificaciones
- Guía Nomenclatura Inorgánica II Medio RevisadaDocumento9 páginasGuía Nomenclatura Inorgánica II Medio RevisadaprofesorcienciaslabAún no hay calificaciones
- Quimica FormulaciónDocumento12 páginasQuimica FormulaciónAriel AndradeAún no hay calificaciones
- Compuestos inorgánicos binariosDocumento4 páginasCompuestos inorgánicos binariosJaime CelisAún no hay calificaciones
- Formación y tipos de óxidos básicos y ácidosDocumento2 páginasFormación y tipos de óxidos básicos y ácidosluis0% (1)
- Tema NomenclaturaDocumento31 páginasTema Nomenclaturaluchofernanflou90Aún no hay calificaciones
- Óxidos e HidroxidosDocumento6 páginasÓxidos e HidroxidosJorge Alberto Velasco FaustoAún no hay calificaciones
- Funciones Quimicas InorganicasDocumento10 páginasFunciones Quimicas Inorganicasdavid_20098594Aún no hay calificaciones
- Lectura Sobre OxidosDocumento3 páginasLectura Sobre OxidosLeopoldo Jesús Quijada BellorinAún no hay calificaciones
- YgjgyjDocumento15 páginasYgjgyjEsteban Aicardy PachecoAún no hay calificaciones
- GUÍA 1 de 3 .Óxidos e HidroxidosDocumento13 páginasGUÍA 1 de 3 .Óxidos e HidroxidosVeronica SilvaAún no hay calificaciones
- Unidad Educativa Fiscomisiona1Documento8 páginasUnidad Educativa Fiscomisiona1Emilio Jose galvez MerchanAún no hay calificaciones
- Nomenclatura InorgánicaDocumento51 páginasNomenclatura InorgánicaPumba TimonAún no hay calificaciones
- Nomenclatura química: elementos, compuestos, valencia y funcionesDocumento11 páginasNomenclatura química: elementos, compuestos, valencia y funcionesGabriel MarteAún no hay calificaciones
- BB5m Oxidos e HidrurospdfDocumento24 páginasBB5m Oxidos e HidrurospdfpuntualAún no hay calificaciones
- Combinaciones Binarias OxigenadasDocumento9 páginasCombinaciones Binarias OxigenadasMelissa Cardozo67% (3)
- Química inorgánica 2022 - NomenclaturaDocumento24 páginasQuímica inorgánica 2022 - NomenclaturaxdemorfeoxAún no hay calificaciones
- Nomenclatura BinariosDocumento6 páginasNomenclatura BinariosRaul Fernandez PereiraAún no hay calificaciones
- Quimica Nestor CoelloDocumento12 páginasQuimica Nestor CoelloNestor CoelloAún no hay calificaciones
- Expo QuimicaDocumento6 páginasExpo QuimicaLiz Vega LopezAún no hay calificaciones
- TrabajoDocumento34 páginasTrabajoGandy BolilloAún no hay calificaciones
- Formulación y Nomenclatura - Los Óxidos - CienciaonthecrestDocumento1 páginaFormulación y Nomenclatura - Los Óxidos - CienciaonthecrestdanielitoAún no hay calificaciones
- Nomenclatura de ÓxidosDocumento71 páginasNomenclatura de ÓxidosNicol ArteagaAún no hay calificaciones
- Infografias Compuestos QuimicosDocumento2 páginasInfografias Compuestos QuimicosValentina MedinaAún no hay calificaciones
- 3.1 AmaeDocumento46 páginas3.1 AmaeMónica AltamiranoAún no hay calificaciones
- Presentacion QumicaDocumento21 páginasPresentacion Qumicadanae12345maikiAún no hay calificaciones
- Óxidos ÁcidosDocumento5 páginasÓxidos ÁcidosGabriel lugoAún no hay calificaciones
- Química de los compuestos de coordinaciónDe EverandQuímica de los compuestos de coordinaciónAún no hay calificaciones
- QUIMICADocumento3 páginasQUIMICARaimy Rey Reyes NarvaezAún no hay calificaciones
- TEORIANOMENCLATURAINORGANICOSDocumento45 páginasTEORIANOMENCLATURAINORGANICOSLuz RodriguezAún no hay calificaciones
- Formulación y Nomenclatura InorgánicaDocumento16 páginasFormulación y Nomenclatura InorgánicaIrina Martinex MenarguezAún no hay calificaciones
- Nomenclatura InorgánicaDocumento6 páginasNomenclatura InorgánicaLuis F. González AñezAún no hay calificaciones
- TP 2 TP Qca Inor.Documento7 páginasTP 2 TP Qca Inor.Brenda Nynna Mendez100% (1)
- Formulacion - Inorganica - APUNTES Y EJERCICIOSDocumento17 páginasFormulacion - Inorganica - APUNTES Y EJERCICIOSJuan Ramón Navarro BautistaAún no hay calificaciones
- Clase 3 Nomenclatura Inorgánica IDocumento22 páginasClase 3 Nomenclatura Inorgánica IPatricio Vasquez Estay100% (1)
- Taller 7 Grupo Funcional Sal.Documento8 páginasTaller 7 Grupo Funcional Sal.Leidy Reyes0% (1)
- Compuestos - Ternarios CamilaDocumento11 páginasCompuestos - Ternarios CamilaCamila QuimbitaAún no hay calificaciones
- Estados físicos de la materia y nomenclatura inorgánicaDocumento31 páginasEstados físicos de la materia y nomenclatura inorgánicaKatakuri Caceres0% (1)
- Texto de Quimica 3roDocumento22 páginasTexto de Quimica 3roIrma GomezAún no hay calificaciones
- Unidad IV. Formulación y Nomenclatura Química de Los Compuestos Inorgánicos I-2014Documento2 páginasUnidad IV. Formulación y Nomenclatura Química de Los Compuestos Inorgánicos I-2014Jose BrachoAún no hay calificaciones
- Tarea EnlacesDocumento15 páginasTarea EnlacesCarlos Alexander Agurto MartínezAún no hay calificaciones
- Nomenclatura Quimica InorganicaDocumento207 páginasNomenclatura Quimica InorganicamelissaAún no hay calificaciones
- Resumen Nomenclatura en 3 SistemasDocumento4 páginasResumen Nomenclatura en 3 SistemasGuille AguilarAún no hay calificaciones
- Nomenclatura Introducción Q III (AJUSTADA 2021-2022)Documento17 páginasNomenclatura Introducción Q III (AJUSTADA 2021-2022)Gio Sub200Aún no hay calificaciones
- Tarea Semana 2 QuimicaDocumento4 páginasTarea Semana 2 QuimicaAnonymous uWagR524hSAún no hay calificaciones
- Cap 8 Quimica 3er AñoDocumento22 páginasCap 8 Quimica 3er AñoUniverso EducatideAún no hay calificaciones
- TIPOS DE NOMENCLATURA - 4° y 5° SecDocumento5 páginasTIPOS DE NOMENCLATURA - 4° y 5° SecTefita BelicosoAún no hay calificaciones
- Tipos de Nomenclatura InorgánicaDocumento8 páginasTipos de Nomenclatura InorgánicaJorge OspinaAún no hay calificaciones
- 09 - El Lenguaje de La Química - RespuestasDocumento13 páginas09 - El Lenguaje de La Química - RespuestasTomi PattiAún no hay calificaciones
- Formulación Inorgánica IDocumento10 páginasFormulación Inorgánica IMaryMondayGrrrlAún no hay calificaciones
- IupacDocumento15 páginasIupacBrendithaa Gpe KstlloAún no hay calificaciones
- Nomenclatura Inorganica IIIDocumento4 páginasNomenclatura Inorganica IIIP Rz PieroAún no hay calificaciones
- Guía de Química Inorganica 3 Periodo.Documento24 páginasGuía de Química Inorganica 3 Periodo.Juan Eduardo Mendoza NavarroAún no hay calificaciones
- NOMENCLATURADocumento39 páginasNOMENCLATURALEIDY LIZBETH SAAVEDRA ROSASAún no hay calificaciones
- Reglas NomenclaturaDocumento15 páginasReglas NomenclaturaAsun CanoAún no hay calificaciones
- Sem 05 - Ses 09 - Nomenclatura Inorgánica (I) - 2Documento29 páginasSem 05 - Ses 09 - Nomenclatura Inorgánica (I) - 2Richard CastilloAún no hay calificaciones
- TRABAJO Nomenclatura InorganicaDocumento3 páginasTRABAJO Nomenclatura InorganicaPaolitaSolanoVillabonaAún no hay calificaciones