Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Números Cuánticos
Cargado por
silviacr0540 calificaciones0% encontró este documento útil (0 votos)
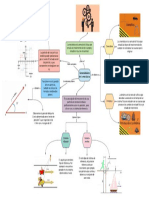
6 vistas1 páginaEste documento resume los números cuánticos y la configuración electrónica. Explica que los números cuánticos (n, l, m, s) describen la posición y energía de los electrones en un átomo y que la configuración electrónica muestra cómo los electrones se distribuyen en los diferentes niveles de energía de acuerdo con el orden de llenado establecido. También discute algunas anomalías aparentes en el orden de llenado debido a factores de estabilidad.
Descripción original:
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento resume los números cuánticos y la configuración electrónica. Explica que los números cuánticos (n, l, m, s) describen la posición y energía de los electrones en un átomo y que la configuración electrónica muestra cómo los electrones se distribuyen en los diferentes niveles de energía de acuerdo con el orden de llenado establecido. También discute algunas anomalías aparentes en el orden de llenado debido a factores de estabilidad.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
6 vistas1 páginaNúmeros Cuánticos
Cargado por
silviacr054Este documento resume los números cuánticos y la configuración electrónica. Explica que los números cuánticos (n, l, m, s) describen la posición y energía de los electrones en un átomo y que la configuración electrónica muestra cómo los electrones se distribuyen en los diferentes niveles de energía de acuerdo con el orden de llenado establecido. También discute algunas anomalías aparentes en el orden de llenado debido a factores de estabilidad.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
APUNTES QUIMICA GENERAL
NÚMEROS CUÁNTICOS
Tabla periódica: números cuán…
NÚMEROS CUÁNTICOS Y CON…
Con"guracinelectrnica from instituto integrado de
comercio
Numero cuantico from Leonardo Pachas
La propuesta de Schrodinger , considerado como el
5° modelo atómico, radica en describir las
características de todos los electrones de un átomo, y
para ello uso lo que conocemos como números
cuánticos.
Los números cuánticos se denominan con las
letras n, m, l y s y nos indican la posición y la energía
del electrón. Ningún electrón de un mismo átomo
puede tener los mismos números cuánticos.
El signi"cado de los números cuánticos es:
n = número cuántico principal, que indica el nivel de
energía donde se encuentra el electrón, asume
valores enteros positivos, del 1 al 7.
l = número cuántico secundario, que indica el orbital
en el que se encuentra el electrón, puede ser s, p, d y f
(0, 1, 2 y 3).
m = número cuántico magnético, representa la
orientación de los orbitales en el espacio, o el tipo de
orbital, dentro de un orbital especi"co. Asume
valores del número cuántico secundario negativo (-l)
pasando por cero, hasta el número cuántico positivo
(+l).
s = número cuántico de spin, que describe la
orientación del giro del electrón. Este número tiene
en cuenta la rotación del electrón alrededor de su
propio eje a medida que se mueve rodeando al
núcleo. Asume únicamente dos valores +1/2 y -
En resumen los números cuánticos se expresan:
N: Nivel de energía (1, 2, 3, 4, 5, 6, 7)
L: Orbital (s=0, p=1, d=2 y f=3) del =0 (orbital s) hasta
n - 1.
m: magnético (m=-ll ,0 +11) desde -ll, pasando por cero,
hasta +ll.
s: spin (-1, + 1).
Los números cuánticos sirven a su vez para entender
la información que aporta la con"guración
electrónica
De esta forma se pueden obtener los números
cuánticos de los electrones de los niveles superiores.
Para mayor facilidad se presentará una tabla para
asignar los números cuánticos correctos, conociendo
la con"guración electrónica y la localización exacta
del electrón.
1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p6-5s2-4d10-5p6-
6s2-4f14-5d10-6p6-7s2-5f14-6d10-7p6
El número que precede al orbital es igual al número
cuántico principal, por ejemplo para los electrones
que están en el orbital 4p, el nivel = 4.
El número cuántico secundario se establece
observando el orbital referido, por ejemplo para el
orbital 4p, el subnivel es el orbital, l = 1 (p)
Existen tres tipos de orbitales p (px, py y pz) por lo
que se dice que hay tres espacios donde se acomodan
dos electrones en cada uno, esos espacios o tipos de
orbitales reciben el número cuántico magnético de
-1, 0 y +1. Es decir para el orbital p existen 3 números
cuánticos magnéticos.
Si nos referimos al cuarto nivel de energía,
4s23d104p6? , y se menciona al orbital 4p, el
superíndice indica el total de electrones de ese
orbital, si se sabe que el orbital p siempre tiene los
números cuánticos m (-1, 0, +1), entonces se agrupan
de dos en dos, es decir 2 electrones para cada número
cuántico magnético.
De tal manera que dos electrones (los apareados)
diferirán únicamente del número cuántico s o de
spin, ya que uno tendrá s = - 1/2 y el otro s = + 1/2.
CONFIGURACIÓN ELECTRÓNICA
La con"guración electrónica del átomo de un
elemento corresponde a la ubicación de los
electrones en los orbitales de los diferentes niveles
de energía . Aunque el modelo de Scrödinger es
exacto sólo para el átomo de hidrógeno, para otros
átomos es aplicable el mismo modelo mediante
aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los
electrones en un átomo, es a través de
la con!guración electrónica . El orden en el que se
van llenando los niveles de energía es: 1s, 2s, 2p, 3s,
3p, 4s, 3d, 4p. El esquema de llenado de los orbitales
atómicos, lo podemos tener utilizando la regla de la
diagonal , para ello debes seguir atentamente la #echa
del esquema comenzando en 1s; siguiendo la #echa
podrás ir completando los orbitales con los
electrones en forma correcta
DO
Para escribir la con"guración electrónica de un
átomo es necesario:
Saber el número de electrones que el átomo
tiene; basta conocer el número atómico (Z) del
átomo en la tabla periódica. Recuerda que el
número de electrones en un átomo neutro es
igual al número atómico (Z = p+).
Ubicar los electrones en cada uno de los
niveles de energía, comenzando desde el nivel
más cercano al núcleo (n = 1).
Respetar la capacidad máxima de cada
subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Ejemplo:
Los orbitales se llenan en orden creciente de
energía, con no más de dos electrones por orbital,
según el principio de construcción de Au"au.
Litio (Z = 3). Este elemento tiene 3 electrones.
Empezaremos llenando el orbital de menor energía
con dos electrones que tendrán distinto spin (ms). El
electrón restante ocupará el orbital 2s, que es el
siguiente con menor energía:
La #echa indica el valor del cuarto número cuántico,
el de spin: para +1/2: y para –1/2, respectivamente:
También podemos describir la distribución de
electrones en el átomo de litio como:
Los electrones que tienen números de espín opuestos
cancelan los efectos magnéticos y se dice que
sonelectrones apareados . Un ejemplo son los dos
electrones que ocupan el orbital 1s en el átomo de
Litio. De manera similar decimos que el electrón que
ocupa el orbital 2s orbital está desapareado .
En la tabla a continuación vemos como se
distribuyen los electrones de los átomos en orden
creciente a su número atómico Z
En el helio se completa el primer nivel (n=1), lo que
hace que la con!guración del He sea muy estable.
Para el Boro el quinto electrón se sitúa en un
orbital 2p y al tener los tres orbitales 2p la misma
energía no importa cuál de ellos ocupa.
En el carbono el sexto electrón podría ocupar el
mimo orbital que el quinto u otro distinto. La
respuesta nos la da:
la regla de Hund: la distribución más estable de los
electrones en los subniveles es aquella que tenga el
mayor número de espínes paralelos.
Los electrones se repelen entre sí y al ocupar distintos
orbitales pueden situarse más lejos uno del otro. Así
el carbono en su estado de mínima energía tiene dos
electrones desapareados, y el nitrógeno tiene 3.
El neón completa el nivel dos y al igual que el helio
tiene una con"guración estable.
Las con"guraciones electrónicas pueden también
escribirse de manera abreviada haciendo referencia
al último nivel completo. Para ello, debemos ocupar
la con!guración de los gases nobles, ya que ellos
tienen todos su orbitales completos con electrones
(s2p6), como por ejemplo en el caso del helio (s2) y
neón (s2p6) como se muestra en la tabla anterior.
Así la con"guración del sodio Na, la podemos
escribir como [Ne]3s1
También podemos escribir la con"guración
del litio como [He]2s1
A los electrones que pertenecen a un nivel
incompleto se les denomina electrones de valencia .
El gas noble Argón representa el "nal del período
iniciado por el sodio para n=3
En el siguiente elemento, el potasio con 19
electrones , deberíamos empezar a llenar los orbitales
3d. Sin embargo el comportamiento químico del
potasio es similar al de litio y el sodio, ambos con un
electrón de valencia desapareado en un orbital s, por
lo que al potasio le correspondería la con"guración
[Ar] 4s1. Por lo tanto, el orbital 4s tendrá que tener
menor energía que los orbitales 3d (el
apantallamiento de los electrones en los orbitales 3d
es mayor que el de los electrones en los orbitales 4s).
Lo mismo ocurre a partir del elemento Sc (Z = 21)
[Ar] 3d1 4s2. El último electrón no se agrega al
subnivel 4p, sino al 3d, como lo indica el orden
energético. Lo mismo sucede con las con"guraciones
de los elementos Ti (Z = 22) y V (Z = 23). Con el
cromo (Cr Z = 24) surge otra aparente anomalía
porque su con"guración es [Ar] 3d5 4s1. La lógica de
llenado habría llevado a [Ar] 3d4 4s2, sin embargo la
distribución fundamental correcta es la primera. Esto
se debe a que el semillenado de orbitales d es de
mayor estabilidad, puesto que su energía es más baja.
Con el cobre Cu Z = 29 sucede algo similar al cromo,
puesto que su con"guración fundamental es [Ar]
3d10 4s1. La con"guración [Ar] 3d9 4s2 es de mayor
energía. La con"guración con 10 electrones en
orbitales d, es decir, el llenado total de estos orbitales
es más estable.
Version: Mobile | Web
Created with Weebly
También podría gustarte
- Practica 4. Numeros CuanticosDocumento10 páginasPractica 4. Numeros Cuanticosdavid cruzAún no hay calificaciones
- Valores de Los Números CuánticosDocumento8 páginasValores de Los Números CuánticosHeriberto I. FdezAún no hay calificaciones
- Números Cuánticos QUIMICADocumento8 páginasNúmeros Cuánticos QUIMICAR Carlos HCAún no hay calificaciones
- Numeros CuanticosDocumento11 páginasNumeros CuanticosHari SofiaAún no hay calificaciones
- Configuración ElectrónicaDocumento28 páginasConfiguración ElectrónicaEliezer Xivir88% (8)
- Configuracion ElectronicaDocumento7 páginasConfiguracion ElectronicaNAHOMY ALEXANDRA MEZA ALFAROAún no hay calificaciones
- Configuracion ElectronicaDocumento28 páginasConfiguracion ElectronicaAnonymous cWKbRCtUQIAún no hay calificaciones
- Configuración ElectrónicaDocumento7 páginasConfiguración ElectrónicaEnmanuel CruzAún no hay calificaciones
- Electron DiferencialDocumento11 páginasElectron DiferencialJavi Quiñonez50% (2)
- Configuracion ElectronicaDocumento27 páginasConfiguracion Electronicadavid felipe medina ramirezAún no hay calificaciones
- Configuracion ElectronicaDocumento5 páginasConfiguracion ElectronicaJuan Jose OrtizAún no hay calificaciones
- QuimicaDocumento29 páginasQuimicaIs Morales0% (1)
- QC03Números Cuánticos y Configuración ElectrónicaDocumento15 páginasQC03Números Cuánticos y Configuración ElectrónicaDiego SosaAún no hay calificaciones
- Apuntes Configuracion ElectronicaDocumento6 páginasApuntes Configuracion ElectronicaAngy NGAún no hay calificaciones
- Guía - 02 - Números Cuánticos y Configuración ElecrónicaDocumento13 páginasGuía - 02 - Números Cuánticos y Configuración ElecrónicaYayo Pizarro AlarconAún no hay calificaciones
- Laboratorio Configuracion Electronica y La Tabla PeriodicaDocumento8 páginasLaboratorio Configuracion Electronica y La Tabla Periodicamaria cedeñoAún no hay calificaciones
- Laboratorio Configuracion Electronica y La Tabla PeriodicaDocumento7 páginasLaboratorio Configuracion Electronica y La Tabla PeriodicaErick Jesus quinteroAún no hay calificaciones
- Los Números Cuánticos y La Configuración ElectrónicaDocumento3 páginasLos Números Cuánticos y La Configuración ElectrónicaJosé Luis RubíAún no hay calificaciones
- Identificación de Los Numeros CuanticosDocumento15 páginasIdentificación de Los Numeros CuanticosJervin Gómez100% (1)
- Regla de La LluviaDocumento5 páginasRegla de La Lluviapanky199650% (2)
- Propiedades PeriódicasDocumento32 páginasPropiedades PeriódicasArianna PaniaguaAún no hay calificaciones
- Geometría MolecularDocumento13 páginasGeometría MolecularjanzaquispeAún no hay calificaciones
- Números Cuanticos y Configuración Electrónica PDVDocumento15 páginasNúmeros Cuanticos y Configuración Electrónica PDVPaula Astudillo VegaAún no hay calificaciones
- Distribucion ElectronicaDocumento17 páginasDistribucion ElectronicaJulio TiradoAún no hay calificaciones
- Config ElecDocumento8 páginasConfig ElecPedro SolaresAún no hay calificaciones
- 01 Distribución ElectrónicaDocumento28 páginas01 Distribución ElectrónicaDavid Calderon MamaniAún no hay calificaciones
- Configuración Electrónica-EjerciciosDocumento6 páginasConfiguración Electrónica-EjerciciosnikonovoaAún no hay calificaciones
- Tabla PeriodicaDocumento16 páginasTabla PeriodicaViicky SoledadAún no hay calificaciones
- Guia de Quimica para RevisionDocumento37 páginasGuia de Quimica para RevisionLorena Betzabeth Gutierrez GodoyAún no hay calificaciones
- Configuración ElectrónicaDocumento5 páginasConfiguración ElectrónicaMoMoAún no hay calificaciones
- Distribucion ElectronicaDocumento17 páginasDistribucion ElectronicaVíctor Cárcamo EcheverríaAún no hay calificaciones
- Guia 3 de Quimica PDVDocumento12 páginasGuia 3 de Quimica PDVBarbara CamposAún no hay calificaciones
- 15 A Configuracion Electronica 1 PDFDocumento41 páginas15 A Configuracion Electronica 1 PDFusscoailAún no hay calificaciones
- Configuración ElectrónicaDocumento4 páginasConfiguración ElectrónicaFABIANA MUÑOZAún no hay calificaciones
- Nube ElectrónicaDocumento7 páginasNube ElectrónicaVictor PerezAún no hay calificaciones
- Clases de Química InorgánicaDocumento42 páginasClases de Química InorgánicaRobert Cazar100% (3)
- Principio de Edificación ProgresivaDocumento6 páginasPrincipio de Edificación ProgresivaRamiro O CF40% (5)
- Configuración Electrónica 1Documento30 páginasConfiguración Electrónica 1Jorge MéndezAún no hay calificaciones
- LECTURA 2.2.3 Configuración ElectrónicaDocumento5 páginasLECTURA 2.2.3 Configuración ElectrónicaBernaMValenzuelaAún no hay calificaciones
- Guia de Numeros Cuanticos y ConfiguracionDocumento11 páginasGuia de Numeros Cuanticos y ConfiguracionPATRICIA3812Aún no hay calificaciones
- Qué Son Los Niveles de EnergíaDocumento8 páginasQué Son Los Niveles de EnergíaAnthony JG100% (2)
- Actividad 16 Ensayo de Los Numeros CuanticosDocumento4 páginasActividad 16 Ensayo de Los Numeros Cuanticosdaniel alejandro guerrra parraAún no hay calificaciones
- BII-Sesión de Aprendizaje 03Documento6 páginasBII-Sesión de Aprendizaje 03Adiel Sebastian Panduro EspinozaAún no hay calificaciones
- Guia de Estudio Configuración ElectronicaDocumento10 páginasGuia de Estudio Configuración ElectronicaPaula R. TarifeñoAún no hay calificaciones
- Configuración Electrónica (O Periódica) : Modelo Atómico GeneralDocumento15 páginasConfiguración Electrónica (O Periódica) : Modelo Atómico GeneralDaimely GonzalezAún no hay calificaciones
- Estructura Atómica CompletaDocumento29 páginasEstructura Atómica Completacristianespinoza07Aún no hay calificaciones
- 1.5 Distribución Electrónica en Sistemas PolielectrónicosDocumento7 páginas1.5 Distribución Electrónica en Sistemas PolielectrónicosAlonso Curiel Lopez20% (5)
- Espin Del ElectronDocumento7 páginasEspin Del ElectronMARIA ISABEL MESA PEREZAún no hay calificaciones
- Semana 11Documento7 páginasSemana 11sofiasanchez0307Aún no hay calificaciones
- Niveles de EnergíaDocumento9 páginasNiveles de EnergíaDaniel Hernandez ClaroAún no hay calificaciones
- 2014 Solucionario Clase 3 Teoría Atómica IIDocumento13 páginas2014 Solucionario Clase 3 Teoría Atómica IIIgnacio ZuñigaAún no hay calificaciones
- Modelo Actual Del AtomoDocumento56 páginasModelo Actual Del AtomoCarlos Vicente100% (1)
- CONFIGURACIÓN ELECTRÓNICA (Separata)Documento6 páginasCONFIGURACIÓN ELECTRÓNICA (Separata)Ana Nomberto LuperdiAún no hay calificaciones
- Que Es El AtomoDocumento10 páginasQue Es El AtomoDavidCovicAún no hay calificaciones
- Configuración Electrónica y Números Cuánticos 10°Documento19 páginasConfiguración Electrónica y Números Cuánticos 10°PinguinaaaaAún no hay calificaciones
- Configuración ElectrónicaDocumento10 páginasConfiguración ElectrónicaJaime Borja SalazarAún no hay calificaciones
- 1 Guia Quimica 10°Documento4 páginas1 Guia Quimica 10°Nikol JimenaAún no hay calificaciones
- Ficha 1 Periferia - AtomicaDocumento5 páginasFicha 1 Periferia - Atomicalevs508Aún no hay calificaciones
- Orden y DesordenDocumento2 páginasOrden y DesordenPaola CalderomAún no hay calificaciones
- Trabajo para La Mis Katy .Documento1 páginaTrabajo para La Mis Katy .rosa AMELIA cOBEÑAS LAMDRIDAún no hay calificaciones
- OnadasDocumento18 páginasOnadasEsther Mendoza MoránAún no hay calificaciones
- PedrozaMartinez WendyGuadalupe M18S2AI3Documento5 páginasPedrozaMartinez WendyGuadalupe M18S2AI3David Ortiz Romero0% (1)
- Preguntas 1 CorteDocumento7 páginasPreguntas 1 CorteOscar Leonel Torres CruzAún no hay calificaciones
- ▷ Ley de Coulomb - Ejercicios Resueltos 【Paso a Paso】Documento6 páginas▷ Ley de Coulomb - Ejercicios Resueltos 【Paso a Paso】BellAún no hay calificaciones
- Configuración ElectrónicaDocumento6 páginasConfiguración ElectrónicaYassiell Yaireth Córdoba FloresAún no hay calificaciones
- INTEGRALES DE SUPERFICIE TrabajoDocumento3 páginasINTEGRALES DE SUPERFICIE TrabajoMaykcol Ordoñez100% (1)
- Pensum Fisica v4Documento2 páginasPensum Fisica v4C0UNDEAún no hay calificaciones
- 93ES MONO 4 Conjetura HodgeDocumento7 páginas93ES MONO 4 Conjetura Hodgemarcelo pacheco ubedaAún no hay calificaciones
- Resumen de Funciones de Varias VariablesDocumento13 páginasResumen de Funciones de Varias Variablesleopardo014Aún no hay calificaciones
- Tarea 1 El Concepto de Integral.Documento35 páginasTarea 1 El Concepto de Integral.Diego VargasAún no hay calificaciones
- A 10 Autovalores y AutovectoresDocumento2 páginasA 10 Autovalores y AutovectoresMarco Ignacio FerreiraAún no hay calificaciones
- Tarea Química UNEMIDocumento6 páginasTarea Química UNEMIIsaac GutierrezAún no hay calificaciones
- Actividad L Aecuaciones Diferenciales PDFDocumento8 páginasActividad L Aecuaciones Diferenciales PDFCarolina Vélez LondoñoAún no hay calificaciones
- Integrales Resueltas 1 15Documento15 páginasIntegrales Resueltas 1 15wenaelmanoAún no hay calificaciones
- 15 10-DinamicaDocumento2 páginas15 10-DinamicaShuen AheAún no hay calificaciones
- Derivada Direccional FinalDocumento3 páginasDerivada Direccional FinalNicolas AgueroAún no hay calificaciones
- Clase 5 Load Center LocationDocumento13 páginasClase 5 Load Center LocationDaniel PilarteAún no hay calificaciones
- Fisica VectorialDocumento22 páginasFisica VectorialVictor TipanAún no hay calificaciones
- FinalDocumento10 páginasFinalRafael BelloAún no hay calificaciones
- Fisica 11 - Didáctica Multimedia - Edición 2019Documento200 páginasFisica 11 - Didáctica Multimedia - Edición 2019hzunigaAún no hay calificaciones
- Act. 2 - Cuadro ComparativoDocumento3 páginasAct. 2 - Cuadro ComparativoSergio Enrique Pérez RivasAún no hay calificaciones
- El Interés Por Conocer La Longitud de Una Circunferencia Surge enDocumento11 páginasEl Interés Por Conocer La Longitud de Una Circunferencia Surge enLennin Brayan Diaz HerreraAún no hay calificaciones
- Syllabus Relatividad 2019 1Documento3 páginasSyllabus Relatividad 2019 1Santiago MoyaAún no hay calificaciones
- Generalidades de La MecánicaDocumento1 páginaGeneralidades de La MecánicaEmiliano Santos0% (2)
- Foro1-Cálculo VectorialDocumento10 páginasForo1-Cálculo VectorialgabrielaAún no hay calificaciones
- Solución de Problemas de Valor Inicial Mediante La Transformada de LaplaceDocumento4 páginasSolución de Problemas de Valor Inicial Mediante La Transformada de LaplaceElieb MolaAún no hay calificaciones
- Modelo de EinsteinDocumento4 páginasModelo de EinsteinMelvin Manuel Cruz ViciosoAún no hay calificaciones
- S - Sem04 - Ses07 - Planos Rectas y SuperficiesDocumento2 páginasS - Sem04 - Ses07 - Planos Rectas y SuperficiesLuis Angel Jeremias MelendrezAún no hay calificaciones
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (205)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Cómo Aprender por tu Cuenta: Los Secretos de los Mejores Autodidáctas para Acelerar tu Aprendizaje sin Depender de los DemásDe EverandCómo Aprender por tu Cuenta: Los Secretos de los Mejores Autodidáctas para Acelerar tu Aprendizaje sin Depender de los DemásCalificación: 4 de 5 estrellas4/5 (10)
- Cuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresDe EverandCuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresCalificación: 5 de 5 estrellas5/5 (2)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- PREM de Pediatría: capacitación para el ENARMDe EverandPREM de Pediatría: capacitación para el ENARMCalificación: 1 de 5 estrellas1/5 (1)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Ondas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasDe EverandOndas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasCalificación: 5 de 5 estrellas5/5 (3)
- Manual de pruebas diagnósticas: Traumatología y ortopediaDe EverandManual de pruebas diagnósticas: Traumatología y ortopediaCalificación: 4 de 5 estrellas4/5 (3)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Confección de cojines y ropa de hogar. TCPF0309De EverandConfección de cojines y ropa de hogar. TCPF0309Aún no hay calificaciones
- Manual de ortopedia maxilar: Modelo diagnóstico de maloclusiones para pacientes en crecimientoDe EverandManual de ortopedia maxilar: Modelo diagnóstico de maloclusiones para pacientes en crecimientoCalificación: 4.5 de 5 estrellas4.5/5 (14)
- UF0054: APROVISIONAMIENTO DE MATERIAS PRIMAS EN COCINA (HOTR0108)De EverandUF0054: APROVISIONAMIENTO DE MATERIAS PRIMAS EN COCINA (HOTR0108)Aún no hay calificaciones
- El Método Agile: Lo que Necesita Saber Sobre Gestión de Proyectos Agile, el Proceso Kanban, Pensamiento Lean, y ScrumDe EverandEl Método Agile: Lo que Necesita Saber Sobre Gestión de Proyectos Agile, el Proceso Kanban, Pensamiento Lean, y ScrumCalificación: 5 de 5 estrellas5/5 (1)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Liberación del trauma: Perdón y temblor es el caminoDe EverandLiberación del trauma: Perdón y temblor es el caminoCalificación: 4 de 5 estrellas4/5 (4)
- Anatomía del caballo: Guía práctica ilustradaDe EverandAnatomía del caballo: Guía práctica ilustradaCalificación: 4 de 5 estrellas4/5 (9)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- Puntos gatillo y cadenas musculares funcionales en osteopatía y terapia manual (Bicolor)De EverandPuntos gatillo y cadenas musculares funcionales en osteopatía y terapia manual (Bicolor)Calificación: 4.5 de 5 estrellas4.5/5 (23)