Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ejercicios Tema8
Cargado por
Mauricio Rivero0 calificaciones0% encontró este documento útil (0 votos)
9 vistas2 páginasEjercicios quimica general
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEjercicios quimica general
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
9 vistas2 páginasEjercicios Tema8
Cargado por
Mauricio RiveroEjercicios quimica general
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
Ejercicio 1: Se construye una celda electroquímica a 298 K, colocando
electrodos inertes de platino en dos recipientes distintos, que se conectan
con un puente salino. El recipiente anódico contiene una disolución de
FeSO4, Fe2 (S04)3 y H2SO4 (todos 0,020 M); el otro contiene KMnO4, MnS04
y H2S04 (todos 0,020 M).
A) Escribe la ecuación química igualada.
B) Calcula el potencial estándar de la celda.
C) Calcula el potencial en las condiciones dadas.
D) Calcula la constante de equilibrio para la reacción de la celda. Datos:
MA: Cu = 63,5; 𝜀o 𝑀𝑛𝑂 /𝑀𝑛 = 1,51 V; 𝜀o 𝐹𝑒 /𝐹𝑒 =0,77 V
Si desea escribir el resultado con notación científica deberá expresarla con
un número del 1 al 9 (con las adecuadas cifras significativas que considere
necesarias) seguido de la letra "e" y el valor de la potencia
correspondiente. Ejemplo: para expresar 0,075 deberá escribir 7,5e-2
Ejercicio2: 1) Considere una celda de concentración conformada por dos
electrodos de hidrógeno. En el cátodo se encuentra el electrodo estándar
de hidrógeno y en el ánodo hay un electrodo de hidrógeno inmerso en
una solución de [𝐻 ] desconocida, menor de 1M. La presión
de hidrógeno gaseoso en este electrodo también es igual
a la presión normal. Se desea saber:
a) ¿Cuál será el valor leído en el voltímetro Cuándo la
solución de concentración desconocida tenga un pH de
4,676?
b) ¿Cuál sería el pH de la solución de concentración
desconocida si la fem de la celda fuera 0,1559 V?
2) En una reacción redox: 𝑂𝑥 + 2𝑅𝑒𝑑 2𝑅𝑒𝑑 + 𝑂𝑥 , que se verifica
intercambiando 𝑛 = 2 electrón/es.
¿Cuál debe ser el valor de Eo para esta reacción si alcanza el equilibrio
cuando [𝑂𝑥 ] = 0,02734 𝑀; [𝑅𝑒𝑑 ] = 0,04596 𝑀;
[𝑂𝑥 ] = 1,211 𝑀; [𝑅𝑒𝑑 ] = 1,115 𝑀 a 25°C.
3) Se tienen dos cubas electrolíticas que contienen disoluciones acuosas
de plata y ácido sulfúrico respectivamente. Al pasar una corriente eléctrica
simultáneamente por ambas, en la primera se depositan
0,2591 g de plata. Dato: MA Ag: 108
a) Si la intensidad de corriente es de 2,015 A. ¿Cuánto
tiempo duró el proceso?
b) ¿Qué volumen de hidrógeno (en mililitros) medido a
1 atm de presión y 34 °C se desprende en Ia segunda?
Ejercicio 3: Se conectan dos cubas electrolíticas en serie. En la
primera se coloca una disolución de ácido sulfúrico y en la segunda, una
disolución de nitrato de cobre (II).
Después de una hora del paso de una determinada cantidad de
electricidad ,en la primera cuba se recogen 600 mL hidrogeno molecular
en la a primera 27oC y cuba 1atm de presión.
A) Calcule la masa de cobre depositado en la segunda cuba.
B) Determine la intensidad de corriente que circuló
Ejercicio 4: La corrosión puede ocurrir en medio básico según:
2𝐹𝑒 → 2𝐹𝑒 + 4𝑒 𝜀 =0,44 V
𝑂 (𝑔) + 𝐻 𝑂(𝑙) + 4𝑒 → 4𝑂𝐻 𝜀 =0,40 V
Si ocurriera en medio ácido el ∆𝜀 =1.67 V. Entonces la
corrosión en medio ácido es más importante que la que
Ocurre en medio básico.
Seleccione una:
Verdadero
Falso
También podría gustarte
- Taller para La Practica Calificada 2Documento17 páginasTaller para La Practica Calificada 2Antonio LeonAún no hay calificaciones
- Taller de Repaso para La Practica Calificada 2Documento12 páginasTaller de Repaso para La Practica Calificada 2Adolf ReinhardtAún no hay calificaciones
- S12.s1.Resolver EjerciciosDocumento3 páginasS12.s1.Resolver EjerciciosBrayam Stalyn Bonifacio AyalaAún no hay calificaciones
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaDe EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaAún no hay calificaciones
- Actividad RemedialDocumento9 páginasActividad RemedialMateo SamaniegoAún no hay calificaciones
- P.D. N°11Documento2 páginasP.D. N°11RafaelAún no hay calificaciones
- Selectividad Redox Desde 2009Documento18 páginasSelectividad Redox Desde 2009P M RAún no hay calificaciones
- Problemas Tema 09Documento2 páginasProblemas Tema 09LeandroAún no hay calificaciones
- ElectroquímicaDocumento153 páginasElectroquímicaDiego Cuya GarciaAún no hay calificaciones
- Ejercicios de ElectroquímicaDocumento11 páginasEjercicios de ElectroquímicaAntony Jesus Ynca Nova0% (1)
- Problemas Exam Final FQ CGT 2022Documento7 páginasProblemas Exam Final FQ CGT 2022Keivin jhan Cerna benavidesAún no hay calificaciones
- Ejercicios de FQ-ELECTROQUÍMICADocumento5 páginasEjercicios de FQ-ELECTROQUÍMICAMeliza Buitron NeyraAún no hay calificaciones
- Tercer TallerDocumento2 páginasTercer TallerEDWIN PAUL MONTAÑEZ CALACHUAAún no hay calificaciones
- 2006 2 60Documento2 páginas2006 2 60alfonsocerezoAún no hay calificaciones
- Serie Primer Parcial 2020Documento3 páginasSerie Primer Parcial 2020Arlez HernandezAún no hay calificaciones
- Seminario Redox 2018Documento3 páginasSeminario Redox 2018gaAún no hay calificaciones
- Tema 6 - Reacciones de Transferencia de ElectronesDocumento16 páginasTema 6 - Reacciones de Transferencia de ElectronesRaúl GarridoAún no hay calificaciones
- Practica Calificada 4Documento5 páginasPractica Calificada 4mishellaguilar667Aún no hay calificaciones
- Electroquimica 2014Documento4 páginasElectroquimica 2014Luis VacaAún no hay calificaciones
- Ejercícios ElectroquímicaDocumento2 páginasEjercícios ElectroquímicarocrosduAún no hay calificaciones
- SEMINARIO ElectroquimicaDocumento6 páginasSEMINARIO ElectroquimicaIsrael CamposAún no hay calificaciones
- Taller Grupal FisicoquimicaDocumento1 páginaTaller Grupal FisicoquimicaAlexander Miguel Mamani De La CruzAún no hay calificaciones
- Ejercicios Electroquímica-Material ComplementarioDocumento6 páginasEjercicios Electroquímica-Material ComplementarioMIRIAM MEJIA DIAZ0% (1)
- Guía Leyes de Farday 1Documento5 páginasGuía Leyes de Farday 1charly floydAún no hay calificaciones
- Taller de CulombimetríaDocumento3 páginasTaller de CulombimetríaLiliana BuenoAún no hay calificaciones
- Electrolisis PreguntasDocumento3 páginasElectrolisis PreguntasAlfonso HernangilAún no hay calificaciones
- Examenes de QuimicaDocumento5 páginasExamenes de QuimicaJorge Leonardo ReinosoAún no hay calificaciones
- Examen Final de Química Física I LIBRES 02 Julio de 2020Documento2 páginasExamen Final de Química Física I LIBRES 02 Julio de 2020totojul1Aún no hay calificaciones
- Problemas Quimica ETSIAEDocumento19 páginasProblemas Quimica ETSIAEJuan De Torres CabreraAún no hay calificaciones
- Quimica 1Documento31 páginasQuimica 1Victor Hugo Valdez IllanesAún no hay calificaciones
- ElectrogravimetríaDocumento44 páginasElectrogravimetríajaneAún no hay calificaciones
- Electro Qu Í MicaDocumento2 páginasElectro Qu Í MicaOmar Sánchez CastañedaAún no hay calificaciones
- Evaluación Parcial 1Documento1 páginaEvaluación Parcial 1ines yulizaAún no hay calificaciones
- Exámenes Parciales:: Udb - Química Química GeneralDocumento9 páginasExámenes Parciales:: Udb - Química Química GeneralMati GoldmanAún no hay calificaciones
- Boletín Red-Ox 20-21Documento7 páginasBoletín Red-Ox 20-21Viqui R.Aún no hay calificaciones
- Guia RedoxDocumento7 páginasGuia RedoxJosé David Pacheco GarcíaAún no hay calificaciones
- Taller Previo Ex. Final - Quimica Inorganica UgoDocumento1 páginaTaller Previo Ex. Final - Quimica Inorganica UgoEver Chuquisengo ZeladaAún no hay calificaciones
- Prob 2 BACHRedoxDocumento4 páginasProb 2 BACHRedoxAdriana RodriguezAún no hay calificaciones
- Ejercicios de ElectroquimicaDocumento81 páginasEjercicios de ElectroquimicaMoises CasillaAún no hay calificaciones
- Ejercicios-ElectroquimicaMOISES C11ADocumento12 páginasEjercicios-ElectroquimicaMOISES C11AMoises CasillaAún no hay calificaciones
- Serie 08Documento4 páginasSerie 08Sandra FanchiottiAún no hay calificaciones
- 1.1. Taller Introducción Métodos Electroanalíticos PDFDocumento4 páginas1.1. Taller Introducción Métodos Electroanalíticos PDF'Sebastian OrtizAún no hay calificaciones
- Problemas de Pilas y Electrolisis2Documento4 páginasProblemas de Pilas y Electrolisis2Teresa TorrijosAún no hay calificaciones
- Problemas Pilas Electroquímicas2020Documento4 páginasProblemas Pilas Electroquímicas2020jojlllAún no hay calificaciones
- U3 - S5 - Ejercicios Electroquímica CDDocumento10 páginasU3 - S5 - Ejercicios Electroquímica CDmaicot donayreAún no hay calificaciones
- R 14Documento4 páginasR 14Antonio Joaquin Roca VejarAún no hay calificaciones
- Informe Celda ElectroliticaDocumento3 páginasInforme Celda ElectroliticaGianella BonifasAún no hay calificaciones
- Coligativas UTNDocumento12 páginasColigativas UTNAnonymous ZAr1RKAún no hay calificaciones
- ELECTRODEPOSICION FinalDocumento9 páginasELECTRODEPOSICION FinalChristian Pavel Raico ChoqueAún no hay calificaciones
- Electroquimica Ejercicios 155 FQ 24943Documento8 páginasElectroquimica Ejercicios 155 FQ 24943jAún no hay calificaciones
- ELECTROQUÍMICADocumento10 páginasELECTROQUÍMICACarlos Alfonso Jara Benites67% (3)
- Tarea 2Documento9 páginasTarea 2Junior Hector JuniorAún no hay calificaciones
- CORECCIONESDocumento17 páginasCORECCIONESJOSHUA JAI BASTIDAS JIMENEZAún no hay calificaciones
- Seminario 2 Redox 2022Documento3 páginasSeminario 2 Redox 2022gaAún no hay calificaciones
- Final QG - 22-02-2023Documento1 páginaFinal QG - 22-02-2023Sofía FabbroAún no hay calificaciones
- No Olviden También Repasar Los Conceptos, Pues Tendremos Preguntas de Teoría en El ExamenDocumento3 páginasNo Olviden También Repasar Los Conceptos, Pues Tendremos Preguntas de Teoría en El ExamenSalima GutierrezAún no hay calificaciones
- Tema 6. Reacciones RedoxDocumento15 páginasTema 6. Reacciones RedoxB Pilar Moreno CAún no hay calificaciones
- Tablas de Distribuciones de ProbabilidadDocumento19 páginasTablas de Distribuciones de ProbabilidadPaola DiazAún no hay calificaciones
- 4 Array Busqueda BinariaDocumento15 páginas4 Array Busqueda BinariaMauricio RiveroAún no hay calificaciones
- 5-Insercion en OrdenDocumento3 páginas5-Insercion en OrdenMauricio RiveroAún no hay calificaciones
- Cartilla PVC Euler BesselDocumento13 páginasCartilla PVC Euler BesselMauricio RiveroAún no hay calificaciones
- Ejercicio Electroquimica y Ley de FaradayDocumento4 páginasEjercicio Electroquimica y Ley de FaradayMauricio RiveroAún no hay calificaciones
- Expedición de Copias Certificadas de Documentos Agrarios en - Gob - MXDocumento2 páginasExpedición de Copias Certificadas de Documentos Agrarios en - Gob - MXComercializadora MayaAún no hay calificaciones
- Disepser FT-VHC-VPCDocumento2 páginasDisepser FT-VHC-VPCjesusAún no hay calificaciones
- Planificación-Pintamos La Artesanía de Mi Región 4 Años ADocumento6 páginasPlanificación-Pintamos La Artesanía de Mi Región 4 Años Arebeca murayariAún no hay calificaciones
- Ejemplo Aplicación Del MGRSDDocumento38 páginasEjemplo Aplicación Del MGRSDYackeline Sales DavilaAún no hay calificaciones
- LEROI-GOURHAN - ANDRÉ - El Simbolismo de Los Grandes Signos en El Arte Rupestre Paleolítico - 1958Documento15 páginasLEROI-GOURHAN - ANDRÉ - El Simbolismo de Los Grandes Signos en El Arte Rupestre Paleolítico - 1958Cesar Augusto Velandia Jagua100% (2)
- Nativo Modelo de Negocio para Comercializacion de Vodka Ready To Drink Con Insumos PeruanosDocumento94 páginasNativo Modelo de Negocio para Comercializacion de Vodka Ready To Drink Con Insumos PeruanosYhon SaturnoAún no hay calificaciones
- 10 Bebidas Típicas de GuatemalaDocumento8 páginas10 Bebidas Típicas de GuatemalaElmer AcabalAún no hay calificaciones
- Kuri, Carlos - INTRODUCCIÓN AL PSICOANÁLISIS PDFDocumento154 páginasKuri, Carlos - INTRODUCCIÓN AL PSICOANÁLISIS PDFLeonardo MolloAún no hay calificaciones
- UntitledDocumento8 páginasUntitledArgelis Sarai Pérez BandresAún no hay calificaciones
- Anexo 1 Ejercicios Tarea 2 16-01 2022Documento13 páginasAnexo 1 Ejercicios Tarea 2 16-01 2022Fabian GarciaAún no hay calificaciones
- La Misión de La UniversidadDocumento2 páginasLa Misión de La UniversidadWilmer Enrique Mejia MendezAún no hay calificaciones
- PPT - ALIMENT - COMPLE - MANUAL CAP. 241121 - Rev.17.02Documento16 páginasPPT - ALIMENT - COMPLE - MANUAL CAP. 241121 - Rev.17.02Thali AnticonaAún no hay calificaciones
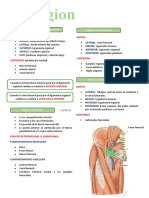
- Región CruralDocumento4 páginasRegión CruralNicole RomeroAún no hay calificaciones
- XVI XVI: Xiii Concurso de Comprensión Lectora Xiii Concurso de Comprensión Lectora Xiii Concurso de Comprensión LectoraDocumento2 páginasXVI XVI: Xiii Concurso de Comprensión Lectora Xiii Concurso de Comprensión Lectora Xiii Concurso de Comprensión LectoraEdwin Mateo Barja FloresAún no hay calificaciones
- III Módulo Trastorno Por Déficit AtencionalDocumento150 páginasIII Módulo Trastorno Por Déficit Atencionalkaren riosAún no hay calificaciones
- Escalera de InferenciaDocumento4 páginasEscalera de Inferenciarabas_Aún no hay calificaciones
- Robert Cialdini - Las Armas de La PersuasiónDocumento143 páginasRobert Cialdini - Las Armas de La PersuasiónMaria Isabel Aguirre Alvarez100% (3)
- Sanidad AndaluciaDocumento56 páginasSanidad AndaluciaMarta JiménezAún no hay calificaciones
- Ejercicios Resueltos Mecanica de SuelosDocumento7 páginasEjercicios Resueltos Mecanica de SuelosJames_Arnold_YiTvga100% (3)
- Charla de 5 Minutos - Semana 38Documento5 páginasCharla de 5 Minutos - Semana 38MaferVanOordtRocaZelaAún no hay calificaciones
- Fa 3 - Tarea 7Documento3 páginasFa 3 - Tarea 7Carlos ZetAún no hay calificaciones
- Historia de Los Censos en BoliviaDocumento5 páginasHistoria de Los Censos en BoliviaOdalis Mariana CuellarYucoAún no hay calificaciones
- Manual Etica y Valores DiapositivasDocumento77 páginasManual Etica y Valores DiapositivasAlexis Chima CouohAún no hay calificaciones
- FICHA - TECNICA - BIOMERK - TG - TABLETAS GrasasDocumento1 páginaFICHA - TECNICA - BIOMERK - TG - TABLETAS GrasasJosePallaresGarnicaAún no hay calificaciones
- Banco de Preguntas y Respuesta para Analista de RedesDocumento8 páginasBanco de Preguntas y Respuesta para Analista de RedesComputoAún no hay calificaciones
- Los ProfetasDocumento9 páginasLos ProfetasInfancia MisioneraAún no hay calificaciones
- Triptico ComisionistasDocumento50 páginasTriptico ComisionistasDiego ZeballosAún no hay calificaciones
- Informe Practica Banco de Condensadores DidacticoDocumento3 páginasInforme Practica Banco de Condensadores DidacticoRICARDO ABRIL ROJASAún no hay calificaciones
- El Oso PerezosoDocumento4 páginasEl Oso PerezosoJosué De León Bernal0% (1)
- Informe de Practica PACE UCNDocumento36 páginasInforme de Practica PACE UCNAracelly Aravena FredesAún no hay calificaciones
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (201)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Trucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasDe EverandTrucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasCalificación: 4.5 de 5 estrellas4.5/5 (3)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Proyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadDe EverandProyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadCalificación: 5 de 5 estrellas5/5 (1)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- La vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizDe EverandLa vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizCalificación: 5 de 5 estrellas5/5 (7)
- Manual técnico para la interpretación de análisis de suelos y fertilización de cultivosDe EverandManual técnico para la interpretación de análisis de suelos y fertilización de cultivosCalificación: 4 de 5 estrellas4/5 (1)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Guía de cálculo y diseño de conductos para ventilación y climatizaciónDe EverandGuía de cálculo y diseño de conductos para ventilación y climatizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Magia con Bicarbonato de Sodio: Decenas de Remedios y Usos Caseros que te Ahorrarán Dinero y Tiempo Utilizando el Bicarbonato de SodioDe EverandMagia con Bicarbonato de Sodio: Decenas de Remedios y Usos Caseros que te Ahorrarán Dinero y Tiempo Utilizando el Bicarbonato de SodioCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Prescripción de ejercico físico para la saludDe EverandPrescripción de ejercico físico para la saludCalificación: 5 de 5 estrellas5/5 (1)
- La causa raiz de los accidentes: Historias de accidentes en la industriaDe EverandLa causa raiz de los accidentes: Historias de accidentes en la industriaCalificación: 5 de 5 estrellas5/5 (1)